Какие продукты выделяются при электролизе раствора нитрата серебра
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
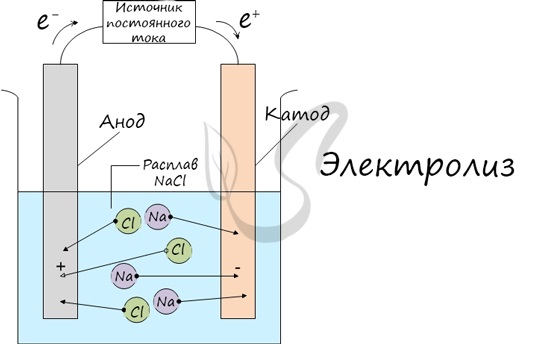
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
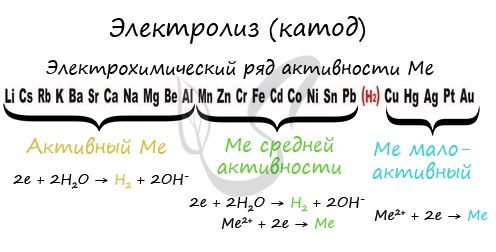
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
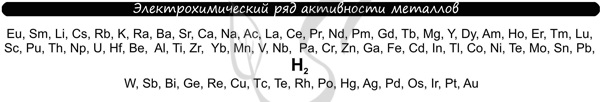
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
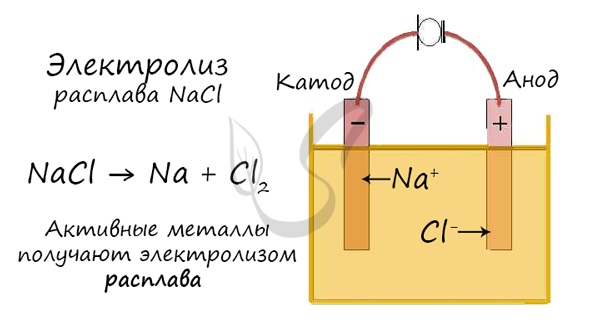
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Цели первого урока: научить писать схемы
электролиза растворов и расплавов солей и
применять полученные знания для решения
расчетных задач; продолжить формирование
навыков работы с учебником, тестовыми
материалами; обсудить применение электролиза в
народном хозяйстве.
П л а н п е р в о г о у р о к а
1. Повторение изученных способов получения
металлов.
2. Объяснение нового материала.
3. Решение задач из учебника Г.Е.Рудзитиса,
Ф.Г.Фельдмана «Химия-9» (М.: Просвещение, 2002), с. 120,
№ 1, 2.
4. Проверка усвоения знаний на тестовых
заданиях.
5. Сообщение о применении электролиза.
Цели первого урока: научить писать схемы
электролиза растворов и расплавов солей и
применять полученные знания для решения
расчетных задач; продолжить формирование
навыков работы с учебником, тестовыми
материалами; обсудить применение электролиза в
народном хозяйстве.
ХОД ПЕРВОГО УРОКА
Повторение изученных
способов получения металлов на примере
получения меди из оксида меди(II).
Запись уравнений соответствующих реакций:

Еще один способ
получения металлов из растворов и расплавов их
солей – электрохимический, или электролиз.
Электролиз – это
окислительно-восстановительный процесс,
происходящий на электродах при пропускании
электрического тока через расплав или раствор
электролита.
Электролиз расплава хлорида натрия:
NaCl Na+ + Cl–;
катод (–) (Na+): Na+ + е = Na0,
анод (–) (Cl–): Cl– – е = Cl0, 2Cl0
= Cl2;
2NaCl = 2Na + Cl2.
Электролиз раствора хлорида натрия:
NaCl Na+ + Cl–,
H2O Н+
+ ОН–;
катод (–) (Na+; Н+): H+ + е = H0,
2H0 = H2
(2H2O + 2е = H2 + 2OH–),
анод (+) (Cl–; OН–): Cl– – е = Cl0,
2Cl0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2 + H2.
Электролиз раствора нитрата меди(II):
Cu(NO3)2 Cu2+ +
Н2O H+
+ OH–;
катод (–) (Cu2+; Н+): Cu2+ + 2е = Cu0,
анод (+) ( OН–): OH– – е = OH0,
4H0 = O2 + 2H2O;
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3.
Эти три примера показывают, почему электролиз
проводить выгоднее, чем осуществлять другие
способы получения металлов: получаются металлы,
гидроксиды, кислоты, газы.
Мы писали схемы электролиза, а теперь попробуем
написать сразу уравнения электролиза, не
обращаясь к схемам, а только используя шкалу
активности ионов:

Примеры уравнений электролиза:
2HgSO4 + 2H2O = 2Hg + O2 + 2H2SO4;
Na2SO4 + 2H2O = Na2SO4
+ 2H2 + O2;
2LiCl + 2H2O = 2LiOH + H2 + Cl2.
Решение задач из
учебника Г.Е.Рудзитиса и Ф.Г.Фельдмана (9-й класс,
с. 120, № 1, 2).
Задача 1. При электролизе раствора хлорида
меди(II) масса катода увеличилась на 8 г. Какой газ
выделился, какова его масса?
Решение
CuCl2 + H2O = Cu + Cl2 + H2O,
(Cu) = 8/64 = 0,125
моль,
(Cu) = (Сl2) = 0,125 моль,
m(Cl2) = 0,125•71 = 8,875 г.
Ответ. Газ – хлор массой 8,875 г.
Задача 2. При электролизе водного раствора
нитрата серебра выделилось 5,6 л газа. Сколько
граммов металла отложилось на катоде?
Решение
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3,
(O2) = 5,6/22,4 =
0,25 моль,
(Ag) = 4(O2) = 4•25 = 1 моль,
m(Ag) = 1•107 = 107 г.
Ответ. 107 г серебра.
Тестирование
Вариант 1
1. При электролизе раствора гидроксида
калия на катоде выделяется:
а) водород; б) кислород; в) калий.
2. При электролизе раствора сульфата меди(II)
в растворе образуется:
а) гидроксид меди(II);
б) серная кислота;
в) вода.
3. При электролизе раствора хлорида бария на
аноде выделяется:
а) водород; б) хлор; в) кислород.
4. При электролизе расплава хлорида
алюминия на катоде выделяется:
а) алюминий; б) хлор;
в) электролиз невозможен.
5. Электролиз раствора нитрата серебра
протекает по следующей схеме:
а) AgNO3 + H2O Ag + Н2 + HNO3;
б) AgNO3 + H2O Ag + О2 + HNO3;
в) AgNO3 + H2O AgNO3
+ Н2 + О2.
Вариант 2
1. При электролизе раствора гидроксида
натрия на аноде выделяется:
а) натрий; б) кислород; в) водород.
2. При электролизе раствора сульфида натрия
в растворе образуется:
а) сероводородная кислота;
б) гидроксид натрия;
в) вода.
3. При электролизе расплава хлорида ртути(II)
на катоде выделяется:
а) ртуть; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра
на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора нитрата ртути(II)
протекает по следующей схеме:
а) Hg(NO3)2 + H2O Hg + Н2 + HNO3;
б) Hg(NO3)2 + H2O Hg + О2 + HNO3;
в) Hg(NO3)2 + H2O Hg(NO3)2 + Н2 + О2.
Вариант 3
1. При электролизе раствора нитрата меди(II)
на катоде выделяется:
а) медь; б) кислород; в) водород.
2. При электролизе раствора бромида лития в
растворе образуется:
а) вода;
б) бромоводородная кислота;
в) гидроксид лития.
3. При электролизе расплава хлорида серебра
на катоде выделяется:
а) серебро; б) хлор; в) электролиз невозможен.
4. При электролизе раствора хлорида
алюминия алюминий выделяется на:
а) катоде; б) аноде; в) остается в растворе.
5. Электролиз раствора бромида бария
протекает по следующей схеме:
а) BaBr2 + H2O Br2
+ Н2 + Ba(OH)2;
б) BaBr2 + H2O Br2
+ Ba + H2O;
в) BaBr2 + H2O Br2
+ О2 + Ba(OH)2.
Вариант 4
1. При электролизе раствора гидроксида
бария на аноде выделяется:
а) водород; б) кислород; в) барий.
2. При электролизе раствора йодида калия в
растворе образуется:
а) йодоводородная кислота;
б) вода; в) гидроксид калия.
3. При электролизе расплава хлорида
свинца(II) на катоде выделяется:
а) свинец; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра
на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора сульфида натрия
протекает по следующей схеме:
а) Na2S + H2O S + Н2 + NaOH;
б) Na2S + H2O Н2 + O2 + Na2S;
в) Na2S + H2O Н2 + Na2S + NaOH.
Ответы
| Вариант | Вопрос 1 | Вопрос 2 | Вопрос 3 | Вопрос 4 | Вопрос 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |
Применение
электролиза в народном хозяйстве
1. Для защиты металлических изделий от
коррозии на их поверхность наносят тончайший
слой другого металла: хрома, серебра, золота,
никеля и т.д. Иногда, чтобы не расходовать дорогие
металлы, производят многослойное покрытие.
Например, внешние детали автомобиля сначала
покрывают тонким слоем меди, на медь наносят
тонкий слой никеля, а на него – слой хрома.
При нанесении покрытий на металл электролизом
они получаются ровными по толщине, прочными.
Таким способом можно покрывать изделия любой
формы. Эту отрасль прикладной электрохимии
называют гальваностегией.
2. Кроме защиты от коррозии гальванические
покрытия придают красивый декоративный вид
изделиям.
3. Другая отрасль электрохимии, близкая по
принципу к гальваностегии, названа
гальванопластикой. Это процесс получения точных
копий различных предметов. Для этого предмет
покрывают воском и получают матрицу. Все
углубления копируемого предмета на матрице
будут выпуклостями. Поверхность восковой
матрицы покрывают тонким слоем графита, делая ее
проводящей электрический ток.
Полученный графитовый электрод опускают в
ванну с раствором сульфата меди. Анодом служит
медь. При электролизе медный анод растворяется, а
на графитовом катоде осаждается медь. Таким
образом получается точная медная копия.
С помощью гальванопластики изготавливают
клише для печати, грампластинки, металлизируют
различные предметы. Гальванопластика открыта
русским ученым Б.С.Якоби (1838).
Изготовление штампов для грампластинок
включает нанесение тончайшего серебряного
покрытия на пластмассовую пластинку, чтобы она
стала электропроводной. Затем на пластинку
наносят электролитическое никелевое покрытие.
Чем следует сделать пластинку в
электролитической ванне – анодом или катодом?
(О т в е т. Катодом.)
4. Электролиз используют для получения
многих металлов: щелочных, щелочно-земельных,
алюминия, лантаноидов и др.
5. Для очистки некоторых металлов от
примесей металл с примесями подключают к аноду.
Металл растворяется в процессе электролиза и
выделяется на металлическом катоде, а примесь
остается в растворе.
6. Электролиз находит широкое применение
для получения сложных веществ (щелочей,
кислородсодержащих кислот), галогенов.
 |
Схема электролиза воды |
Практическая работа
(второй урок)
Цели урока. Провести электролиз воды,
показать гальваностегию на практике, закрепить
знания, полученные на первом уроке.
Оборудование. На столах учащихся:
плоская батарейка, два провода с клеммами, два
графитовых электрода, химический стакан,
пробирки, штатив с двумя лапками, 3%-й раствор
сульфата натрия, спиртовка, спички, лучина.
На столе учителя: то же + раствор медного
купороса, латунный ключ, медная трубка (кусок
меди).
Инструктаж учащихся
1. Прикрепить провода клеммами к электродам.
2. Электроды поставить в стакан, чтобы они не
соприкасались.
3. Налить в стакан раствор электролита (сульфата
натрия).
4. В пробирки налить воды и, опустив их в стакан с
электролитом кверху дном, надеть их на
графитовые электроды поочередно, закрепив
верхний край пробирки в лапке штатива.
5. После того как прибор будет смонтирован,
концы проводов прикрепить к батарейке.
6. Наблюдать выделение пузырьков газов: на аноде
их выделяется меньше, чем на катоде. После того
как в одной пробирке почти вся вода вытеснится
выделяющимся газом, а в другой – наполовину,
отсоединить провода от батарейки.
7. Зажечь спиртовку, осторожно снять пробирку,
где вода почти полностью вытеснилась, и поднести
к спиртовке – раздастся характерный хлопок газа.
8. Зажечь лучину. Снять вторую пробирку,
проверить тлеющей лучиной газ.
Задания для учащихся
1. Зарисовать прибор.
2. Написать уравнение электролиза воды и
пояснить, почему надо было проводить электролиз
в растворе сульфата натрия.
3. Написать уравнения реакций, отражающие
выделение газов на электродах.
Учительский демонстрационный
эксперимент
(могут выполнять лучшие ученики класса
при наличии соответствующего оборудования)
1. Подсоединить клеммы проводов к медной трубке
и латунному ключу.
2. Опустить трубку и ключ в стакан с раствором
сульфата меди(II).
3. Подсоединить вторые концы проводов к
батарейке: «минус» батарейки к медной трубке,
«плюс» к ключу!
4. Наблюдать выделение меди на поверхности
ключа.
5. После выполнения эксперимента вначале
отсоединить клеммы от батарейки, затем вынуть
ключ из раствора.
6. Разобрать схему электролиза с растворимым
электродом:
CuSО4 = Сu2+ + ![]()
анод (+): Сu0 – 2e = Cu2+,
катод (–): Cu2+ + 2e = Сu0.
Суммарное уравнение электролиза с растворимым
анодом написать нельзя.
Электролиз проводился в растворе сульфата
меди(II), поскольку:
а) нужен раствор электролита, чтобы протекал
электрический ток, т.к. вода является слабым
электролитом;
б) не будут выделяться какие-либо побочные
продукты реакций, а только медь на катоде.
|
Ученик 9-го класса проводит |
7. Для закрепления пройденного написать
схему электролиза хлорида цинка с угольными
электродами:
ZnCl2 = Zn2+ + 2Cl–,
катод (–): Zn2+ + 2e = Zn0,
2H2O + 2e = H2 + 2OH–,
анод (+): 2Cl– – 2e = Cl2.
Суммарное уравнение реакции в данном случае
написать нельзя, т.к. неизвестно, какая часть
общего количества электричества идет на
восстановление воды, а какая – на восстановление
ионов цинка.
 |
Схема демонстрационного |
Домашнее задание
1. Написать уравнение электролиза раствора,
содержащего смесь нитрата меди(II) и нитрата
серебра, с инертными электродами.
2. Написать уравнение электролиза раствора
гидроксида натрия.
3. Чтобы очистить медную монету, ее надо
подвесить на медной проволоке, присоединенной к
отрицательному полюсу батареи, и опустить в 2,5%-й
раствор NаОН, куда следует погрузить также
графитовый электрод, присоединенный к
положительному полюсу батареи. Объясните, каким
образом монета становится чистой. (Ответ. На
катоде идет восстановление ионов водорода:
2Н+ + 2е = Н2.
Водород вступает в реакцию с оксидом меди,
находящимся на поверхности монеты:
СuО + Н2 = Сu + Н2О.
Этот способ лучше, чем чистка порошком, т.к. не
стирается монета.)
М.А.АЛЕКСАНДРОВА,
учитель химии школы № 81
(Москва)
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз – основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H₂O → O₂ + 2H₂
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами или электролиза растворов, в которых содержится несколько растворенных веществ, в ЕГЭ по химии пока нет.
Давайте рассмотрим несколько простых задач на электролиз, а затем перейдем к более сложным.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO₃ + 2H₂O → 4Ag + 4HNO₃ + O₂
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/107 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O₂) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O₂) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO₃) = n(Ag) = 0,02 моль
m(HNO₃) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO₃) = m(HNO₃)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O₂) = 0,112 л, ω(HNO₃) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H₃PO₄) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H₂O → 2KOH + Cl₂ + H₂
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H₃PO₄) = mр-ра(H₃PO₄) ·ω(H₃PO₄) = 50 г · 0,196 = 9,8 г
n(H₃PO₄) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H₃PO₄ + KOH → KH₂PO₄ + H₂O
H₃PO₄ + 2KOH → K₂HPO₄ + 2H₂O
H₃PO₄ + 3KOH → K₃PO₄ + 3H₂O
При соотношении кислоты и щелочи n(H₃PO₄):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K₂HPO₄) = n(H₃PO₄) = 0,1 моль
Ответ: K₂HPO₄
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H₂O → O₂ + 2H₂
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто – за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,₂(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H₂O) = mр-ра,1(NaOH) – mр-ра,₂ (NaOH) = 525 – 241,5 = 283,5 г
n(H₂O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H₂) = n(H2O) = 15,75 моль
V(H₂) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О₂) = 1/2·n(H2O) = 7,875 моль
V(O₂) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H₂) = 352,8 л, V(O₂) = 176,4 л
Задачи на электролиз встретились в ЕГЭ по химии в 2018 году. Вот одна из задач реального экзамена по химии:
4. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO₄ + 2H₂O → 2Cu + 2H₂SO₄ + O₂
Находим массу чистого сульфата меди:
m(CuSO₄) = mраствора*ω(CuSO₄) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO₄) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O₂) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O₂) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра₂ равна:
mр-ра₂ = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля.
Найдем массовую долю сульфата меди ω(CuSO₄)₂ и серной кислоты ω(H₂SO₄) в растворе, который остался после электролиза:
m(CuSO₄)ост = n*M = 0,4*160 = 64 г
ω(CuSO₄)₂ = m(CuSO₄)₂/*mр-ра₂ = 64/492 = 0,13 = 13%
ω(H₂SO₄) = m(H₂SO₄)/*mр-ра₂ = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO₄)3 = ω(CuSO₄)₂ *mр-ра3 = 0,13*98,4 = 12,79 г
m(H₂SO₄)₂ = ω(H₂SO₄)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO₄) = m/M = 12,79/160 = 0,08 моль
n(H₂SO₄) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H₂SO₄ + 2NaOH = Na₂SO₄ + 2H₂O
CuSO₄ + 2NaOH = Cu(OH)₂ + 2H₂O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: mр-ра = 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
5. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение и ответ:
Уравнения реакций:
2CuSO₄ + 2H2O = 2Cu↓ + 2H2SO₄ + O2↑ (электролиз)
BaCl₂ + H₂SO₄ = BaSO₄↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO₄) = 640 · 0,15 = 96 г
n(CuSO₄) = 96 / 160 = 0,6 моль
n(O₂) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO₄) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H₂SO₄) = n(CuSO₄) = 0,6 моль
При электролизе сульфата меди может выделится максимальное количество кислорода:
n(O₂ [1]) = 0,5n(CuSO₄) = 0,3 моль
Однако, по условию, на аноде всего выделилось 0,5 моль газа. Следовательно, дальше протекает электролиз воды:
2H₂O → O₂ + 2H₂ (электролиз)
Количество кислорода ,который выделится при электролизе воды:
n(O₂ [2]) = 0,5 – 0,3 = 0,2 моль
Отсюда можно найти массу воды, которая разложилась под действием тока:
n(H₂O прореаг.) = 2n(O₂ [2]) = 0,4 моль
m(H₂O прореаг.) = 0,4 · 18 = 7,2 г
m(O₂ [1]) = 32 · 0,3 = 9,6 г
m(BaCl₂) = 665,6 · 0,25 = 166,4 г
n(BaCl₂) = 166,4 / 208 = 0,8 моль
n(BaCl₂ прореаг.) = n(H₂SO₄) = 0,6 моль
n(BaCl₂ осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl₂ осталось) = 0,2 · 208 = 41,6 г
n(BaSO₄) = n(BaCl₂ прореаг.) = 0,6 моль
m(BaSO₄) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl₂) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl₂) = 3,7 %
Еще больше задач на электролиз вы можете найти в моей статье.
Источник

