Какие свойства бензола доказывают что в его молекуле нет двойных связей
Арены – ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда – бензол – C6H6.
Общая формула их гомологического ряда – CnH2n-6.
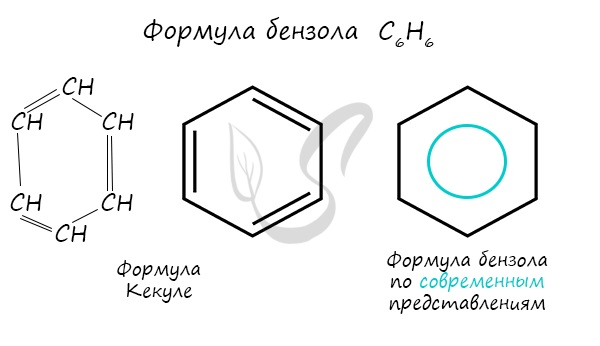
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям,
двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол – 120°.
Номенклатура и изомерия аренов
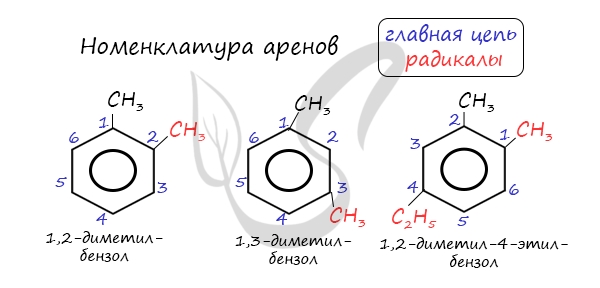
Названия аренов формируются путем добавления названий заместителей к главной цепи – бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
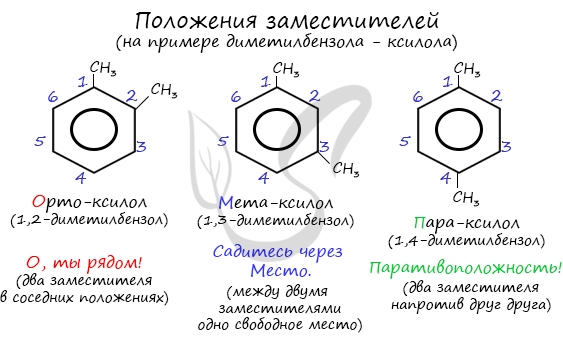
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
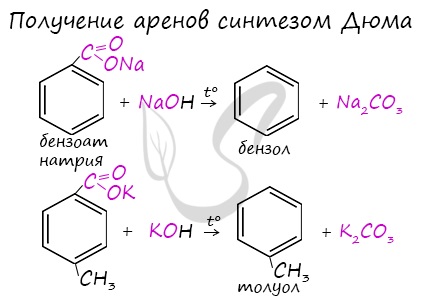
Получение аренов
Арены получают несколькими способами:
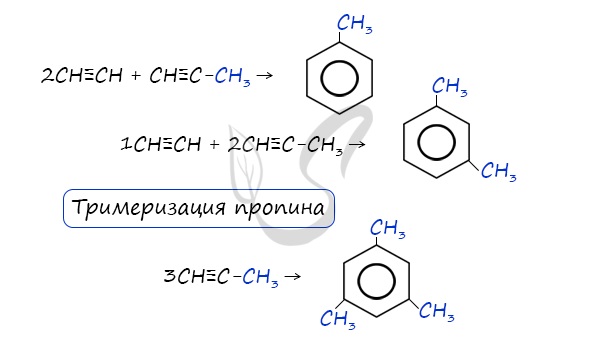
- Реакция Зелинского (тримеризация ацетилена)
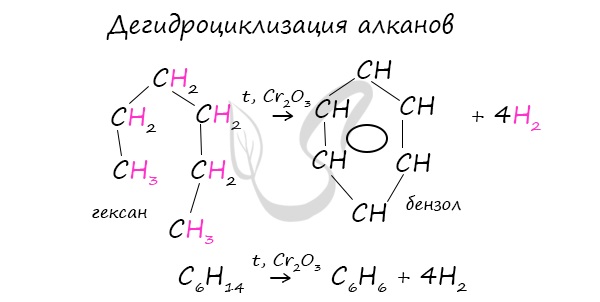
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород – бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора – Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
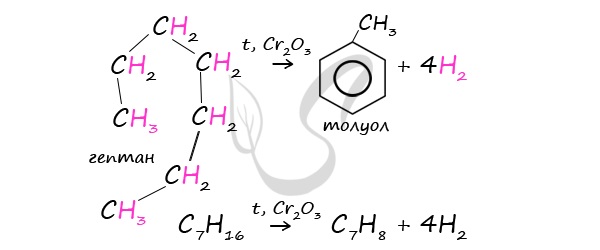
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже “готовых” циклов – циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.

Химические свойства аренов
Арены – ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

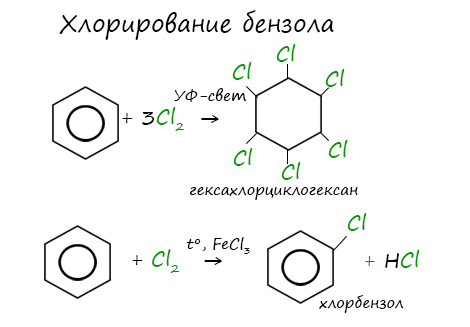
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
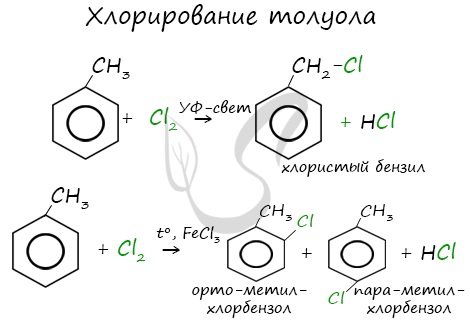
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
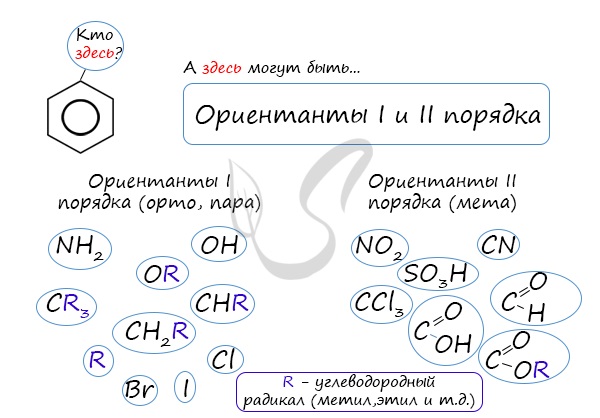
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
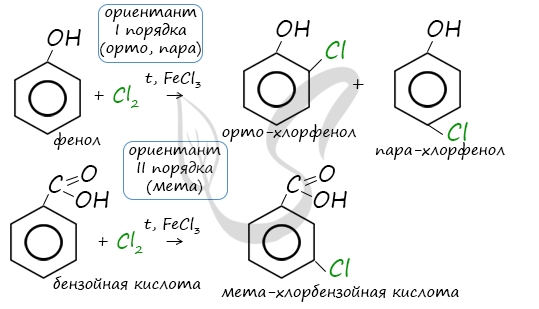
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
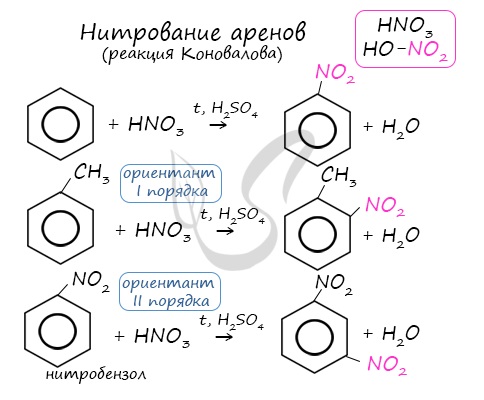
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
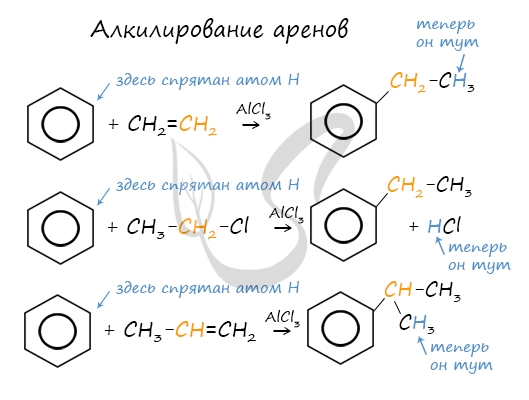
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
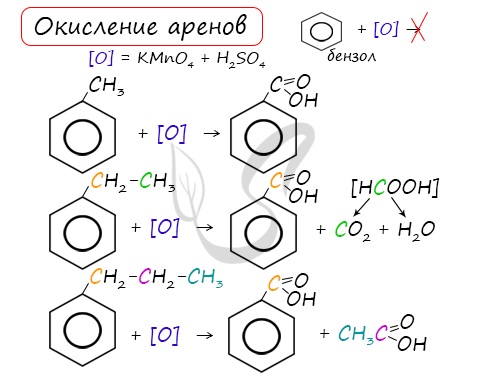
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
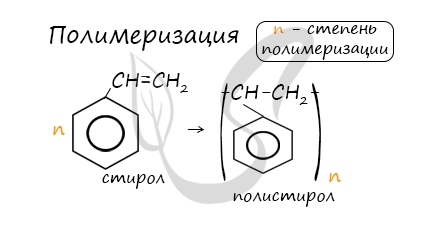
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Конспект урока «Ароматические углеводороды. Бензол»
Цель: расширить знания учащихся об углеводородах, познакомить с ароматическими углеводородами, на примере бензола сформировать понятие об ароматичности связи, особенностях электронного строения и обуславливаемых ею химических свойства, способами получения и применением аренов, показать токсичность воздействия аренов на здоровье человека, применение Цифровых Образовательных Ресурсов (ЦОР) и Федерального центра информационно-образовательных ресурсов (ФЦИОР).
Задачи:
образовательные – показать зависимость химических свойств от строения вещества, умение работать с Интернет ресурсами, позволяющие подготовить к самостоятельной познавательной деятельности
развивающие – развивать интеллектуальные умения выделять главное, анализировать, сравнивать, делать выводы, использовать ранее накопленные знания по химии в контексте нового материала, расширить научную лексику путем введения в активный словарь новых терминов, продолжить формирование умений оформлять результаты своей работы и делать обобщения на основании полученных результатов
воспитательные – воспитывать коммуникативные навыки, формировать научное мировоззрение, интерес к предмету, поддерживать устойчивую мотивацию к изучению химии на основании положительного эмоционального восприятия предмета, умение находить информацию в различных источниках.
Планируемые результаты обучения.
- учащиеся должны знать строение бензола, способы его получения и применения.
- уметь объяснять свойства бензола на основе его строения, записывать уравнения реакций, доказывающие химические свойства бензола.
- уметь сравнивать химические свойства бензола со свойствами предельных и непредельных углеводородов.
- на примере химических свойств бензола, раскрыть многообразие генетических связей между углеводородами.
- уметь, используя полученные на уроке знания, с помощью средств Microsoft Word, Microsoft Excel, Microsoft Power Point, Microsoft Office подготовить презентацию, реферат, доклад.
Оборудование: мультимедийное оборудование, компьютер.
Какие ассоциации вызывает этот слайд?
Представьте себе Англию начала 19 века. Уже в 1814 году улицы и набережные Лондона по вечерам освещались газовыми фонарями. В специальных горелках уличных фонарей сжигали светильный газ, получаемый из китового и трескового жира. Но не все жители туманного Альбиона были довольны новым освещением. Вальтер Скотт писал: “Мир перевернулся, Лондон будет освещаться угольным дымом”. А производители свечей открыто громили новые фонари. К тому же у “светильного газа” имелся существенный недостаток: в летние ночи освещение было ярким, а зимой в сильные холода быстро становилось тусклым. Газ не давал яркого света, поэтому жителям Лондона не так приятно было гулять по набережной Темзы. Владельцы газового завода обратились за помощью к известному учёному М. Фарадею.
В 1825 году Фарадей установил, что часть светильного газа собирается на дне баллона в виде прозрачной жидкости. Учёный установил, что вещество состоит из углерода и водорода. Какую же формулу имел УВ открытый Фарадеем? Вашим домашним заданием было решить задачу на вывод формулы данного соединения. Состав этого веществ: углерода -92,3%, водорода -7,7%. Плотность паров этого вещества по воздуху составляет 2, 69. Решение записано на доске. Сверьтесь с ним. Какую молекулярную формулу мы получили? Выясним, как же называется данное вещество.
Выберите характеристики, относящиеся к разным классам углеводородов. Из полученных букв образуется слово — название углеводорода, который мы сегодня будем изучать.
Какое же вещество мы сегодня будем изучать? Запишем тему урока.
Мы знаем молекулярную формулу. Что мы должны узнать ещё об этом веществе?
Цель урока: изучить строение бензола.
Проанализируем эту формулу. Что мы можем сказать о принадлежности этого вещества к уже изученным классам углеводородов? (сильно непредельное соединение)
Сделайте предположение: Какой характер имеет это соединение? (по составу молекулы).
Выяснено, что однозамещённые производные бензола не имеют изомеров. О какой особенности строения говорит данный факт?
Смоделируем модель молекулы бензола, зная, что она имеет циклическое строение.
Работа учащихся с моделями (в парах). Запишем на доске структурную формулу.
В 1865 году Кекуле предложил такую же формулу.
КОРЗИНА ИДЕЙ.
Что можно сказать о строении, исходя из этой формулы? Какие связи есть в молекуле бензола? Можем ли мы качественным путём доказать наличие пи связей в молекуле?
Видеоопыт: Взаимодействие бензола с бромной водой и перманганатом калия. Какое возникло противоречие? Кекуле тоже увидел это противоречие и предложил гипотезу, согласно которой в молекуле бензола должно происходить постоянное чередование двойных и одинарных связей. Другими словами, их место должно постоянно меняться.
Какую проблему нам необходимо решить сегодня в ходе урока? (какое строение имеет бензол и к какому классу УВ его относят)
Работа в парах
1 пара
1)Изучите текст параграфа по теме «Строение бензола». Заполните таблицу:
«Строение молекулы бензола»
Форма молекулы | Длина связи углерод-углерод | Валентный угол | Тип гибридизации атомов углерода |
Правильный плоский шестиугольник | 0, 140 нм | 120 | Sp 2 |
2)Изучите предложенный текст
В начале XIX века на улицах больших городов — Лондона, Петербурга, Берлина — появилось газовое освещение. В специальных фонарях горел светильный газ, получаемый из китового и трескового жира. Газ хранился в железных баллонах под давлением 30 атм. Зимой яркость свечения уменьшалась, а в баллонах образовывался жидкий конденсат. Именно из такого конденсата М. Фарадей в 1825 г. выделил 3 г углеводорода, имеющего состав C6Н 6. Это и был бензол.
Информация. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии (рака крови) и анемии (недостатка гемоглобина в крови). Сильный канцероген. Бензол является одним из продуктов выбросов автотранспорта, присутствует в выбросах различных технологических процессов. Это один из основных продуктов горения такого известного всем материала, как поливинилхлорид. Выделяется бензол и из горящей полиэтиленовой бутылки. Таким образом, невидимый и необнаруживаемый, он соседствует с нами в городском воздухе. Предельно допустимая концентрация для бензола — 5 мг/м3.
Ответьте на вопрос: почему учащимся запрещено проводить опыты с бензолом?
2 пара
1)Используя текст учебника и текст в задании, подготовьте ответы на предложенные вопросы.
Текст: Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углеродного цикла.
Сочетание шести -связей с единой -электронной системой называется ароматической связью. Электронная плотность распределена равномерно. Следовательно, в молекуле бензола нет ни простых, ни двойных связей. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные для бензола свойства. Цикл из шести атомов углерода, связанных шестью -cвязями и единым -электронным облаком, называют бензольным кольцом или бензольным ядром.
Ароматические углеводороды, или арены — это углеводороды, в молекулах которых имеется одно или несколько бензольных колец.
- Какие экспериментальные данные о строении бензола доказывают, что в молекуле бензола нет двойных и одинарных связей.
- Как называется связь в молекуле бензола?
- Что такое бензольное кольцо или бензольное ядро?
- Как правильно изображать структурную формулу бензола? Что означает окружность внутри?
- Какие углеводороды относят к аренам?
- Какова их общая формула?
3 пара
1)Используя текст учебника, заполните пропуски в схеме.
- Молекула бензола плоская→атомы углерода находятся в…..гибридном состоянии.
- Гибридные облака атомов углерода образуют три сигма-связи с валентным углом между ними, равным….
- Длина всех углерод-углеродных связей одинакова в правильном шестиугольнике →сигма –скелет молекулы бензола схематически можно изобразить так…….
- Каждый атом углерода имеет одну негибридную…орбиталь. Всего их….Они располагаются …плоскости сигма-скелета и…………друг другу →образуют единое электронное облако. П –электронное облако можно изобразить следующим образом……
2) Составьте рассказ, используя полученную схему и рисунки учебника.
4 пара
1)Изучите предложенный текст.
2) Выпишите экспериментальные доказательства, подтверждающие циклическое шестичленное строение бензола. Составьте необходимые уравнения реакций.
В 1866 году Бертло синтезировал в электрическом разряде бензол из ацетилена. Формально это можно представить так: одна из трех связей в молекуле ацетилена затрачивается на образование простой связи с атомом углерода другой молекулы. Оставшиеся по две связи в 3-х молекулах бывшего ацетилена сохраняются. Образуя шестичленный цикл с чередующимися двойными и простыми связями.
В 1900 г. французский химик Сабатье провел реакцию гидрирования бензола и получил циклогексан. При этом 1 молекула бензола присоединила 3 молекулы водорода.
В 1912 г. русский ученый Зелинский осуществил обратный процесс – дегидрирование циклогексана.
Отчёт учащихся по парам. Порядок: шестичленность бензола, экспериментальные доказательства; экспериментально полученные данные о строении бензола; Образование связей в молекуле бензола; понятие ароматических связей и бензольного кольца.
Подведение итогов.
КОРЗИНА ИДЕЙ.
КОНСТРУИРОВАНИЕ МОЛЕКУЛЫ БЕНЗОЛА.
Тестирование.
Рефлексия.
1) В какой мере ты удовлетворен занятием?
3- полностью удовлетворен
2 – в основном
1 – частично
0 – не удовлетворен
2) В какой мере ты проявил себя на занятии?
3- в полной мере
2 – в значительной мере
1 – частично
0 – не и проявил себя
3) В какой мере ты усвоил материал?
3- в полной мере
2 – в значительной мере
1 – частично
0 – не усвоил
4) Насколько занятие было полезным для тебя?
3- полезно во всем
2 — много было полезно
1 – не очень полезно
0 – бесполезно
5) В какой мере ты удовлетворен отношениями с ребятами на занятиях?
3- в полной мере
2 – в значительной мере
1 – частично
0 – не удовлетворен
6) Насколько новым был для тебя материал этого занятия?
3- все было новым
2 — многое было новым
1 – многое уже известно
0 – ничего нового
Источник
Бензол – простейший представитель класса аренов или ароматических углеводородов. Он состоит из шести атомов углерода и шести атомов водорода, образующих так называемое бензольное кольцо.

Строение
Изначально формулу бензола предложил Фридрих Кекуле в 1865 году. Он предполагал, что молекула бензола содержит двойные связи. Тогда бы бензол вступал в реакции присоединения по разрыву двойной связи. Однако для бензола и других аренов характерна реакция замещения водорода.
Как выяснилось позже, бензол имеет более сложное строение. Его формула – С6Н6. Атомы углерода в возбуждённом состоянии имеют электронную конфигурацию 2s1p3.
В бензоле атомы углерода находятся в состоянии sp2-гибридизации. Гибридизированные орбитали каждого атома углерода лежат в одной плоскости и сцеплены между собой в кольцо (шестиугольник) посредством σ-связей или ковалентных химических связей. Такие же связи образуются между атомами углерода и водорода.
Перпендикулярно sp2-гибридизации располагается третья негибридизированная р-орбиталь. Концы этих орбиталей у каждого атома углерода взаимодействуют между собой, образуя прочную связь, условно называемую бензольным кольцом.
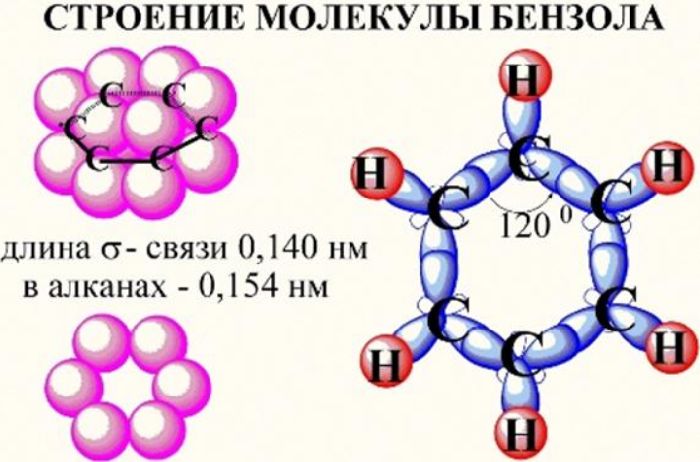
Рис. 1. Строение молекулы бензола.
Вторую формулу бензола, включающую обозначение бензольного кольца, предложил Лайнус Полинг. Атомы углерода и водорода не записывают, а обозначают молекулу в виде шестиугольника с окружностью внутри.
Гомологический ряд
Бензол образует гомологический ряд аренов с общей формулой CnH2n-6.
Гомологи отличаются от бензола предельными углеводородными радикалами, которые замещают один или несколько атомов водорода в кольце.
Названия гомологов формируются с помощью суффикса «-ол». Также используются тривиальные названия:
- бензол – С6Н6;
- метилбензол (толуол) – C7H8;
- этилбензол – C8H10;
- пропилбензол – C9H12;
- бутилбензол (дурол) – C10H14.
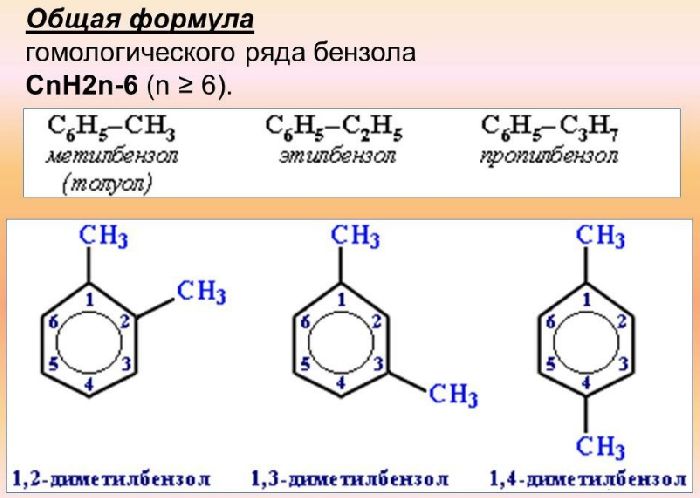
Рис. 2. Структурные формулы гомологов бензола.
Для гомологов характерна структурная изомерия по углеродному скелету радикала и по положению заместителей в бензольном кольце. Чем длиннее радикал, тем больше изомеров он образует. Заместители могут располагаться друг напротив друга (пара-вещества), у соседних атомов углерода в бензольном кольце (орто-вещества) или через один атом (мета-вещества).
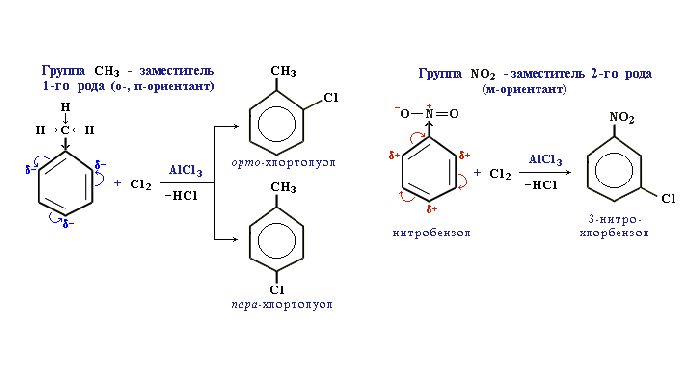
Рис. 3. Возможное размещение заместителей в бензольном кольце.
К бензолу могут присоединяться как предельные, так и непредельные углеводороды. Однако во втором случае образованные вещества не являются гомологами бензола, так как не соответствуют формуле.
Физические свойства
Бензол – бесцветная маслянистая жидкость с неприятным запахом. Обладает высокой токсичностью и наркотическим действием. Молярная масса бензола – 78,11 г/моль. Основные свойства:
- температура плавления – 5,5°C;
- температура кипения – 80,1°C;
- плотность – 0,879 г/см3.
Бензол хорошо смешивается с бензином, эфиром, с другими органическими растворителями. Горит коптящим пламенем. В литре воды растворяется 1,79 г бензола при нормальных условиях.
Химические свойства
Бензолу характерны реакции замещения. Вещество реагирует с алкенами, галогенами, азотной, серной кислотами:
- алкилирование с образованием гомологов бензола:
C6H6 + CH2=CH-CH3 → C6H5CH(CH3)2;
- галогенирование с хлором или бромом:
C6H6 + Cl2 → C6H5Cl + H2O;
- нитрование:
C6H6 + HNO3 → C6H5NO2 + H2O;
- сульфирование:
C6H6 + H2SO4 → C6H6O3S + H2O.
При реакциях бензольное кольцо не разрывается. Для разрыва бензольного кольца необходимы определённые условия: высокая температура, давление.
Что мы узнали?
Из урока химии 10 класса узнали, что такое бензол и как устроена его молекула. Бензол относится к классу аренов или ароматических углеводородов. От других классов углеводородов арены отличаются наличием бензольного кольца, которое образуется за счёт негибридизированных орбиталей атомов углерода. Бензол – токсичная жидкость с резким запахом, плохо растворимая в воде, но хорошо растворимая в органических растворителях. Образует гомологический ряд. Гомологи отличаются длиной предельного углеводородного радикала. За счёт прочных связей бензольного кольца бензол и его гомологи вступают в реакцию замещения атомов углерода.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 630.
Источник
