Какие свойства фенола лежат
1. Фенолы – производные
ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН)
непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные
фенолы в зависимости от количества ОН-групп в молекуле:

В соответствии с количеством
конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро –
производные бензола), нафтолы (2 конденсированных ядра – производные
нафталина), антранолы (3 конденсированных ядра – производные антрацена) и
фенантролы:

3. Изомерия и номенклатура фенолов
Возможны
2 типа изомерии:
- изомерия
положения заместителей в бензольном кольце
- изомерия
боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют
тривиальные названия, сложившиеся исторически. В названиях замещенных
моноядерных фенолов используются также приставки орто-, мета- и
пара -, употребляемые в номенклатуре ароматических соединений. Для более
сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с
помощью цифровых индексов указывают положение заместителей
4. Строение молекулы
Фенильная группа C6H5 –
и гидроксил –ОН взаимно влияют друг на друга
- неподеленная электронная пара атома кислорода притягивается 6-ти
электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее
поляризуется. Фенол – более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака,
электронная плотность повышается в положении 2, 4, 6. Это делает более
реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного
кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных
условиях представляют собой бесцветные кристаллические вещества с невысокой температурой
плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо
растворяются в органических растворителях, токсичны, при хранении на воздухе
постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая
кислота) — бесцветное
кристаллическое вещество на воздухе окисляется и становится розовым, при
обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с
водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги
кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций
нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки
глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается
даже через неповрежденные участки кожи и уже через несколько минут начинает
воздействовать на ткани головного мозга. Сначала возникает кратковременное
возбуждение, а потом и паралич дыхательного центра. Даже при воздействии
минимальных доз фенола наблюдается чихание, кашель, головная боль,
головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления
характеризуются бессознательным состоянием, синюхой, затруднением дыхания,
нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом,
нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1.
Производство синтетических
смол, пластмасс, полиамидов
2.
Лекарственных препаратов
3.
Красителей
4.
Поверхностно-активных веществ
5.
Антиоксидантов
6.
Антисептиков
7.
Взрывчатых веществ
8. Получение фенола в
промышленности
1). Кумольный
способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества
метода: безотходная технология (выход полезных продуктов > 99%) и
экономичность. В настоящее время кумольный способ используется как основной в
мировом производстве фенола.
2).
Из каменноугольной смолы(как побочный
продукт – выход мал):
C6H5ONa + H2SO4(разб) → С6H5 – OH + NaHSO4
фенолят натрия
(продукт обработки смолы едким натром)
3).
Из галогенбензолов:
С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
4).
Сплавлением солей ароматических сульфокислот с твёрдыми щелочами:
C6H5-SO3Na + NaOH t→ Na2SO3 + С6H5 – OH
натриевая соль
бензолсульфокислоты
9. Химические свойства фенола (карболовой кислоты)
I.Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов
не меняют):
- С активными
металлами–
2C6H5-OH + 2Na → 2C6H5-ONa
+ H2
фенолят натрия
- Со щелочами –
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты,
разлагаются угольной кислотой –
C6H5-ONa
+ H2O + СO2 → C6H5-OH + NaHCO3
По
кислотным свойствам фенол превосходит этанол в 106 раз. При этом во
столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол
не может вытеснить угольную кислоту из её солей
C6H5–OH + NaHCO3 =реакция не идёт – прекрасно
растворяясь в водных растворах щелочей, он фактически не растворяется в водном
растворе гидрокарбоната натрия.
Кислотные
свойства фенола усиливаются под влиянием связанных с бензольным кольцом
электроноакцепторных групп (NO2–, Br–)
C6H5–OH< п-нитрофенол <
2,4,6-тринитрофенол
2,4,6-тринитрофенол или пикриновая кислота сильнее
угольной
II. Свойства бензольного кольца
1).
Взаимное
влияние атомов в молекуле фенола проявляется не только в особенностях поведения
гидроксигруппы (см. выше), но и в большей реакционной способности
бензольного ядра. Гидроксильная группа повышает электронную плотность в
бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект
ОН-группы):
Поэтому фенол
значительно активнее бензола вступает в реакции электрофильного замещения в
ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3
фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3
образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной
температуре взаимодействует с бромной водой с образованием белого осадка
2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с
альдегидами.
Например:
Фенолформальдегидные смолы
2).
Гидрирование фенола
C6H5-OH + 3H2Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная
реакция – обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5–OH)3](C6H5O)3 + 3HCl
FeCl3 – светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 – фиолетовый раствор
Видео-опыты:
Изучение физических свойств фенола
Взаимодействие фенола сметаллическим натрием
Взаимодействие фенола с раствором щелочи
Качественная реакция на фенол
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ:
Качественные реакции спиртов и фенола
Источник
Фенол является простейшим представителем веществ, которые относятся к классу фенолов или так называемых ароматических углеводородов. Чаще всего это вещество используется для нужд строительства, производства органических материалов (пластмассы) и химической промышленности. Также он востребован и в других отраслях науки, в том числе в медицине и сельскохозяйственной химии.
Основные характеристики вещества
В 1834 году, в процессе перегонки каменноугольных смол было открыт фенол, причём его не синтезировали, как некоторые другие вещества, а выделили из угольных пластов. За более чем полтора века вещество успело поменять название (старое название — «карболовая кислота», химики до сих пор называют его «карболка»).
На сегодняшний день наименование химического соединения, к которому относится фенол — гидроксибензол. Со временем были уточнены некоторые физические свойства фенола, которые в XIX веке установить без погрешностей было проблематично. Молярная масса фенола равна 94,11 г/моль, его плотность составляет 1.07 грамм на кубический сантиметр.
Интересно, что при температуре в 40,9 градусов по Цельсию вещество — которое в своём обычном агрегатное состоянии является кристаллическим — начинает плавиться, приобретая характерный оттенок. При обычной (комнатной) температуре фенол представляет собой небольшие кристаллы, не имеющие цвета. Эти кристаллы сильно пахнут гуашью, запах фенола очень специфичен и способен надолго «прицепляться» к предметам и одежде.
Способность гидроксибензола к образованию однородных систем с другими веществами (проще говоря, растворимость) не очень высокая, это вещество не может полностью раствориться в воде. Фенол, формула которого C6H5OH, является токсическим и едким веществом, относящимся к ирритантам — раздражителям слизистой оболочки и кожных покровов человека.
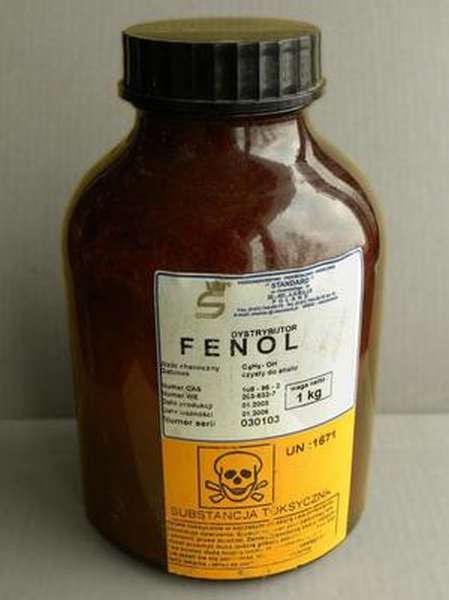
Ещё одна особенность фенола — в его сильных кислотных свойствах. Также он может вступать в реакцию с щелочными растворами, образуя феноляты или соли. При реакции с гидроксидом натрия (Na OH) образуется фенолят натрия (C6H5ONa). Для класса фенолов характерно сочетание химических свойств ароматических углеводородов и спиртов.
Значение предельно допустимой концентрации (ПДК) фенола для человека в жилой зоне составляет 0,03мг/м в кубе, для рабочей зоны это значение равно 0.3 мг/м в кубе. Являясь летучим веществом, фенол опасен при попадании через дыхательную систему человека, а также через кожу, на которой он оставляет химические ожоги. В некоторых случаях симптомы отравления фенолом можно спутать с аллергией, так как имеются похожие симптомы (в виде тошноты, рвоты, опухания кожи).
Использование в промышленности
Для промышленного производства чаще всего используют фенольные соединения, которые можно разделить на 4 небольших группы:
- Жидкости, получаемые посредством перегонки каменноугольного или древесного дёгтя. К примеру, лизол или креозот.
- Соединения, полученные в естественной среде (природные). К ним относят флавоноиды, эвгенол, лигнин, а также капсаицин.
- Хлорфенолы и бутилфенолы.
- Сама карболовая кислота.
Эти соединения получили обширное применение в различных сферах и отраслях. С помощь фенолов производят лакокрасочные изделия, которые имеют хорошую стойкость к воде и многим растворителям. Иногда для изготовления лаков используют алкилфенольные смолы, которые значительно увеличивают их срок службы.
Моющие средства, а также некоторые гели для уборки делают при помощи фенола. Однако в последнее время, в связи с новыми исследованиями, производители стараются отказываться от добавления в состав средства вредных для здоровья веществ. Фенол, наряду с хлором, кислотами и щелочами относится именно к таким веществам.
Широчайшее распространение получил фенола в производстве пластмассовых изделий, а также различных типов синтетических тканей (типа капрона и нейлона). Их делают при помощи синтетических фенолформальдегидных смол. Свойства, которыми обладает фенолформальдегид, позволяют этому материалу до сих пор оставаться востребованным и полезным:
- Высокие показатели электроизоляционных свойств.
- Устойчивость к сильным механическим нагрузкам.
- Превосходная коррозийная стойкость.
- Универсальность для использования.
Из этой синтетической смолы изготавливают много различных приспособлений, предметов и деталей по типу вилок, розеток, электроутюгов, электросчётчиков, выключателей, клеммных коробок и прочих электротехнических изделий.
Список можно дополнить абразивными инструментами, деталями военной техники и оружия, элементами бытовых и кухонных приборов, текстолитов, канцтоваров, различных связующих материалов, сувениров, шахмат и шашек, а также упоминаемых выше лаков и клеёв.
Применение в медицинской сфере
В медицине довольно часто применяют средства, которые могут быть очень опасны для человека, если, к примеру, неправильно заклеить рану или превысить дозу препарата. Примером таких средств может служить цианистый акрилат (ЦА), а также фенол и похожие на него вещества.
Класс фенолов имеет высокие бактерицидные свойства, которые активно используют для обеззараживания медицинских инструментов и помещений. При растворении 5% фенола в воде получается антисептический раствор, хорошо себя зарекомендовавший для обработки ран.
В силу своей токсичности, фенол применяют для дезинфекции только в смесях с другими веществами и средствами. Часто для дезинфицирующих мероприятий используют фенольный раствор, в котором содержится калийное мыло, благодаря чему возможно замачивать бельё и обеззараживать помещения без особого вреда для здоровья человека.
Применение фенола также нашло себя и в лечении некоторых кожных заболеваний, таких, как кондиломы (папилломы), фолликулиты, фликтена, сикоз, импетиго, пиодермия и гнойные раны. Для таких процедур используют, как правило, глицериновый раствор фенола. Тем не менее при таком лечении могут быть побочные эффекты в случае попадания препарата в дыхательные пути.
Помимо прочего, фенол является необходимым компонентом для препаратов, которыми пользуются люди на протяжении длительного времени. К ним можно отнести следующие лекарства:
- Аспирин. После получения аминосалициловой кислоты из фенола (на латыни — Acidum Aminosalicylicum), аспирин стал широко распространён, так как стало возможным наладить его производство в промышленных масштабах.
-
Пурген. Такое вещество, как фенолфталеин (латинское название — Phenolphthaleinum) входит в состав Пургена и многих других эффективных слабительных.
- Противотуберкулёзные препараты, изготовленные на основе парааминосалициловой кислоты, которая тоже является производной фенола.
- Фукорцин. Противогрибковое средство, имеющее в своём составе до 40 мг фенола. Это лекарство также может использоваться при лечении стрептодермии, ветрянки, герпеса, лишая и подобных заболеваний.
- Ксероформ. Его могут назначить при хронической диарее, колитах и энтероколитах, а также при наличии других воспалительных процессов кожи и слизистой оболочки.
В последнее время набирает популярность фенолового пилинга лица и кожи. Это одна из процедур омоложения, которое достигается за счёт химического прижигания некоторых кожных участков с помощью фенола. Этот процесс способствует развитию регенерации и, как следствие, появлению новых молодых клеток.
Востребованность в сельском хозяйстве
Токсичные особенности фенольных веществ используют при борьбе с насекомыми-вредителями, а также против сорняков и паразитов. Инсектицидные средства на основе фенола обладают высокими обжигающими свойствами, благодаря которым также есть возможность лечить некоторые заболевания растений.
Учитывая современные разработки в области пестицидов, инсектицидов и прочих химических средств, фенол для сельскохозяйственных нужд используется значительно реже, чем прежде. Это объясняется не только потенциальным вредом для человека и животных, но и ввиду наличия более эффективных веществ.
К пестицидам на фенольной основе следует отнести все препараты, имеющие в своём составе 2,4-Дихлорфеноксиуксусную кислоту: Клопэфир, Дикопур, Антал, Альянс, Диамакс, Килео и другие.
Следует учитывать, что эти средства вредны для пчёл, поэтому вблизи пасеки их лучше не использовать.
Вред для здоровья человека
Отравление организма вследствие вдыхания паров фенола наступает очень быстро, за счёт чего можно без труда определить основные признаки интоксикации. При сильной концентрации вещества может наступить летальный исход либо же серьёзное поражение нервной системы, головного мозга и дыхательных путей.
Для взрослого человека такая смертельная доза может равняться всего одному грамму. В целом имеет смысл разделить симптомы отравления на две группы:
-

Видимые признаки. Их возникновение говорит о большой концентрации ядовитого вещества, попавшего в организм пострадавшего человека. К ним относятся потеря сознания, сильная рвота, дезориентация человека в пространстве, заметное изменение цвета кожи, затруднённое дыхание (или удушье), несвязная речь. Человек слабо реагирует на внешние стимулы.
- Признаки, возникающие со временем. Возникновение диареи либо запоров, тошноты, головокружения, приступов мигрени (сильные головные боли), частые «неполадки» с желудком, постепенное изменение цвета кожи, появление волдырей, красных пятен. Нарушается работа дыхательной системы, может ощущаться сильное жжение в области груди, невозможность долгой задержки дыхания (не более 5−7 секунд).
Чаще всего подобные отравления происходят на химических фабриках и заводах. Нужно помнить, что если в воздухе рабочего присутствуют смеси различных химических веществ (не только фенол) — влияние на организм человека будет пагубным, даже при отсутствии признаков отравления. Нарушение техники безопасности никогда не приводит к хорошим последствиям.
Опасность, помимо заводов и фабрик, могут представлять лекарства, содержащие фенольные вещества либо же вдыхание паров бытовой химии (при уборке, к примеру). По этой же причине специалисты рекомендуют тщательно проветривать помещения после их покраски, особенно учитывая то, что в гидроксибензол довольно часто используется в лакокрасочной промышленности.
Плюс ко всему возможны несчастные случаи отравления фенолом, предугадать которые попросту невозможно. Именно поэтому следует знать, что надо делать в таких ситуациях.
Алгоритм действий при отравлении фенолом
Ядовитое вещество может попасть в организм 2 путями — через кожные покровы (фенол хорошо всасывается в кожу, после чего оказывает влияние на работу головного мозга) и через дыхательную систему. При вдыхании этот яд оказывает воздействие на дыхательную систему и способен остановить процесс дыхания, поэтому перво-наперво необходимо изолировать пострадавшего от отравляющего источника.
После чего нужно срочно звонить в скорую помощь. После чего следует открыть все форточки (если в помещении) или же снять верхнюю одежду пострадавшего для обеспечения свежего воздуха. Если яд попал через рот человека, нужно дать ему воды для полоскания. Эту воду глотать нельзя — она необходима только для смачивания поражённых участков слизистой оболочки рта.
Обработка поражённых участков кожи должна выполняться строго водой, недопустимы никакие спиртосодержащие жидкости, мази, масла и жирные вещества. Если с собой есть какой-либо вид сорбентов, следует дать человеку его выпить. Для этой цели подойдут такие препараты, как энтеросгель, полисорб, лактофильтрум, и, само собой, активированный уголь.
В качестве антидота к фенолу используют 10% раствор глюконата кальция (как правило, внутривенно). Однако следует заметить, что если человек никогда в жизни не делал никому инъекции, то лучше будет дождаться приезда врачей, где в токсикологическом отделении пострадавшему окажут необходимую помощь.
Загрузка…
Источник
Ôåíîëû – ïðîèçâîäíûå àðîìàòè÷åñêèõ óãëåâîäîðîäîâ, â ñîñòàâ êîòîðûõ ìîãóò âõîäèòü îäíà èëè íåñêîëüêî ãèäðîêñèëüíûõ ãðóïï, ñîåäèíåííûõ ñ áåíçîëüíûì êîëüöîì.
Êàê íàçûâàòü ôåíîëû?
Ïî ïðàâèëàì ÈÞÏÀÊ ñîõðàíÿåòñÿ íàçâàíèå «ôåíîë». Íóìåðàöèÿ àòîìîâ èäåò îò àòîìà, êîòîðûé íåïîñðåäñòâåííî ñâÿçàí ñ ãèäðîêñè-ãðóïïîé (åñëè îíà – ñòàðøàÿ) è íóìåðóþò òàê, ÷òîáû çàìåñòèòåëè ïîëó÷èëè íàèìåíüøèé íîìåð.
Ïðåäñòàâèòåëü – ôåíîë – Ñ6Í5ÎÍ:

Ñòðîåíèå ôåíîëà.
Ó àòîìà êèñëîðîäà íà âíåøíåì óðîâíå íàõîäèòñÿ íåïîäåëåííàÿ ýëåêòðîííàÿ ïàðà, êîòîðàÿ «âòÿãèâàåòñÿ» â ñèñòåìó êîëüöà (+Ì-ýôôåêò ÎÍ-ãðóïïû). Â ðåçóëüòàòå ìîãóò âîçíèêíóòü 2 ýôôåêòà:
1) ïîâûøåíèå ýëåêòðîííîé ïëîòíîñòè áåíçîëüíîãî êîëüöà â ïîëîæåíèÿ îðòî- è ïàðà-. Â îñíîâíîì, òàêîé ýôôåêò ïðîÿâëÿåòñÿ â ðåàêöèÿõ ýëåêòðîôèëüíîãî çàìåùåíèÿ.
2) óìåíüøàåòñÿ ïëîòíîñòü íà àòîìå êèñëîðîäà, âñëåäñòâèå ÷åãî ñâÿçü Î-Í îñëàáëÿåòñÿ è ìîæåò ðâàòüñÿ. Ýôôåêò ñâÿçàí ñ ïîâûøåííîé êèñëîòíîñòè ôåíîëà ïî ñðàâíåíèþ ñ ïðåäåëüíûìè ñïèðòàìè.
Ìîíîçàìåùåííûå ïðîèçâîäíûå ôåíîëà (êðåçîë) ìîãóò áûòü â 3õ ñòðóêòóðíûõ èçîìåðàõ:

Ôèçè÷åñêèå ñâîéñòâà ôåíîëîâ.
Ôåíîëû – êðèñòàëëè÷åñêèå âåùåñòâà ïðè êîìíàòîé òåìïåðàòóðå. Ïëîõî ðàñòâîðèìû â õîëîäíîé âîäå, íî õîðîøî – â ãîðÿ÷åé è â âîäíûõ ðàñòâîðàõ ùåëî÷åé. Îáëàäàþò õàðàêòåðíûì çàïàõîì. Âñëåäñòâèå îáðàçîâàíèÿ âîäîðîäíûõ ñâÿçåé, îáëàäàþò âûñîêîé òåìïåðàòóðîé êèïåíèÿ è ïëàâëåíèÿ.
Ïîëó÷åíèå ôåíîëîâ.
1. Èç ãàëîãåíáåíçîëîâ. Ïðè íàãðåâàíèè õëîðáåíçîëà è ãèäðîêñèäà íàòðèÿ ïîä äàâëåíèåì ïîëó÷àþò ôåíîëÿò íàòðèÿ, êîòîðûé ïîñëå âçàèìîäåéñòâèÿ ñ êèñëîòîé, ïðåâðàùàåòñÿ â ôåíîë:

2. Ïðîìûøëåííûé ñïîñîá: ïðè êàòàëèòè÷åñêîì îêèñëåíèè êóìîëà íà âîçäóõå ïîëó÷àåòñÿ ôåíîë è àöåòîí:

3. Èç àðîìàòè÷åñêèõ ñóëüôîêèñëîò ñ ïîìîùüþ ñïëàâëåíèÿ ñ ùåëî÷àìè. ×àùå ïðîâîäÿò ðåàêöèþ äëÿ ïîëó÷åíèÿ ìíîãîàòîìíûõ ôåíîëîâ:

Õèìè÷åñêèå ñâîéñòâà ôåíîëîâ.
ð-îðáèòàëü àòîìà êèñëîðîäà îáðàçóåò ñ àðîìàòè÷åñêèì êîëüöîì åäèíóþ ñèñòåìó. Ïîýòîìó ýëåêòðîííàÿ ïëîòíîñòü íà àòîìå êèñëîðîäå óìåíüøàåòñÿ, â áåíçîëüíîì êîëüöå – óâåëè÷èâàåòñÿ. Ïîëÿðíîñòü ñâÿçè Î-Í ïîâûøàåòñÿ, è âîäîðîä ãèäðîêñèëüíîé ãðóïïû ñòàíîâèòñÿ áîëåå ðåàêöèîíîñïîñîáíûì è ëåãêî ìîæåò áûòü çàìåùåí àòîìîì ìåòàëëà äàæå ïðè äåéñòâèè ùåëî÷åé.
Êèñëîòíîñòü ôåíîëîâ âûøå, ÷åì ó ñïèðòîâ, ïîýòîìó ìîæíî ïðîâîäèòü ðåàêöèè:


Íî ôåíîë – ñëàáàÿ êèñëîòà. Åñëè ÷åðåç åãî ñîëè ïðîïóñêàòü óãëåêèñëûé èëè ñåðíèñòûé ãàç, òî âûäåëÿåòñÿ ôåíîë, ÷òî äîêàçûâàåò, ÷òî óãîëüíàÿ è ñåðíèñòàÿ êèñëîòà ÿâëÿþòñÿ áîëåå ñèëüíûìè êèñëîòàìè:

Êèñëîòíûå ñâîéñòâà ôåíîëîâ îñëàáëÿþòñÿ ïðè ââåäåíèè â êîëüöî çàìåñòèòåëåé I ðîäà è óñèëèâàþòñÿ – ïðè ââåäåíèè II.
2) Îáðàçîâàíèå ñëîæíûõ ýôèðîâ. Ïðîöåññ ïðîòåêàåò ïðè âîçäåéñòâèå õëîðàíãèäðèäîâ:

3) Ðåàêöèÿ ýëåêòðîôèëüíîãî çàìåùåíèÿ. Ò.ê. ÎÍ-ãðóïïà ÿâëÿåòñÿ çàìåñòèòåëåì ïåðâîãî ðîäà, òî ðåàêöèîííàÿ ñïîñîáíîñòü áåíçîëüíîãî êîëüöà â îðòî- è ïàðà- ïîëîæåíèÿõ ïîâûøàåòñÿ. Ïðè äåéñòâèè íà ôåíîë áðîìíîé âîäû íàáëþäàåòñÿ âûäåëåíèå îñàäêà – ýòî êà÷åñòâåííàÿ ðåàêöèÿ íà ôåíîë:

4) Íèòðîâàíèå ôåíîëîâ. Ðåàêöèþ ïðîâîäÿò íèòðèðóþùåé ñìåñüþ, â ðåçóëüòàòå ÷åãî îáðàçóåòñÿ ïèêðèíîâàÿ êèñëîòà:

5) Ïîëèêîíäåíñàöèÿ ôåíîëîâ. Ðåàêöèÿ ïðîòåêàåò ïîä âîçäåéñòâèè êàòàëèçàòîðîâ:

6) Îêèñëåíèå ôåíîëîâ. Ôåíîëû ëåãêî îêèñëÿþòñÿ êèñëîðîäîì âîçäóõà:

7) Êà÷åñòâåííîé ðåàêöèåé íà ôåíîë ÿâëÿåòñÿ âîçäåéñòâèå ðàñòâîðà õëîðèäà æåëåçà è îáðàçîâàíèå êîìïëåêñà ôèîëåòîâîãî öâåòà.
Ïðèìåíåíèå ôåíîëîâ.
Ôåíîëû èñïîëüçóþò ïðè ïîëó÷åíèè ôåíîëôîðìàëüäåãèäíûõ ñìîë, ñèíòåòè÷åñêèõ âîëîêîí, êðàñèòåëåé è ëåêàðñòâåííûõ ñðåäñòâ, äåçèíôèöèðóþùèõ âåùåñòâ. Ïèêðèíîâàÿ êèñëîòà èñïîëüçóåòñÿ â êà÷åñòâå âçðûâ÷àòûõ âåùåñòâ.
Источник
