Какие свойства характерны для алканов

Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
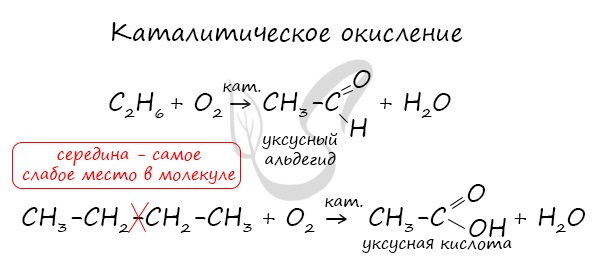
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
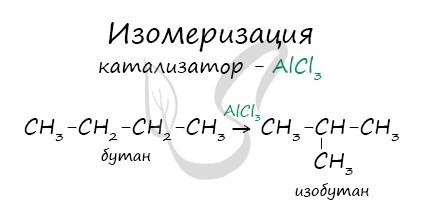
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Источник
Àëêàíû – íàñûùåííûå (ïðåäåëüíûå) óãëåâîäîðîäû. Ïðåäñòàâèòåëåì ýòîãî êëàññà ÿâëÿåòñÿ ìåòàí (ÑÍ4). Âñå ïîñëåäóþùèå ïðåäåëüíûå óãëåâîäîðîäû îòëè÷àþòñÿ íà ÑÍ2– ãðóïïó, êîòîðàÿ íàçûâàåòñÿ ãîìîëîãè÷åñêîé ãðóïïîé, à ñîåäèíåíèÿ – ãîìîëîãàìè.
Îáùàÿ ôîðìóëà – ÑnH2n+2.

Ñòðîåíèå àëêàíîâ.
Êàæäûé àòîì óãëåðîäà íàõîäèòñÿ â sp3 – ãèáðèäèçàöèè, îáðàçóåò 4 σ– ñâÿçè (1 Ñ-Ñ è 3 Ñ-Í). Ôîðìà ìîëåêóëû â âèäå òåòðàýäðà ñ óãëîì 109,5°.
Ñâÿçü îáðàçóåòñÿ ïîñðåäñòâîì ïåðåêðûâàíèÿ ãèáðèäíûõ îðáèòàëåé, ïðè÷åì ìàêñèìàëüíàÿ îáëàñòü ïåðåêðûâàíèÿ ëåæèò â ïðîñòðàíñòâå íà ïðÿìîé, ñîåäèíÿþùåé ÿäðà àòîìîâ. Ýòî íàèáîëåå ýôôåêòèâíîå ïåðåêðûâàíèå, ïîýòîìó σ-ñâÿçü ñ÷èòàåòñÿ íàèáîëåå ïðî÷íîé.
Èçîìåðèÿ àëêàíîâ.
Äëÿ àëêàíîâ ñâîéñòâåííà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà. Ïðåäåëüíûå ñîåäèíåíèÿ ìîãóò ïðèíèìàòü ðàçëè÷íûå ãåîìåòðè÷åñêèå ôîðìû, ñîõðàíÿÿ ïðè ýòîì óãîë ìåæäó ñâÿçÿìè. Íàïðèìåð,

Ðàçëè÷íûå ïîëîæåíèÿ óãëåðîäíîé öåïè íàçûâàþòñÿ êîíôîðìàöèÿìè.  íîðìàëüíûõ óñëîâèÿõ êîíôîðìàöèè àëêàíîâ ñâîáîäíî ïåðåõîäÿò äðóã â äðóãà ñ ïîìîùüþ âðàùåíèÿ Ñ-Ñ ñâÿçåé, ïîýòîìó èõ ÷àñòî íàçûâàþò ïîâîðîòíûìè èçîìåðàìè. Ñóùåñòâóåò 2 îñíîâíûå êîíôîðìàöèè – «çàòîðìîæåííîå» è «çàñëîíåííîå»:

Èçîìåðèÿ óãëåðîäíîãî ñêåëåòà àëêàíîâ.
Êîëè÷åñòâî èçîìåðîâ âîçðàñòàåò ñ óâåëè÷åíèåì ðîñòà óãëåðîäíîé öåïè. Íàïðèìåð ó áóòàíà èçâåñòíî 2 èçîìåðà:

Äëÿ ïåíòàíà – 3, äëÿ ãåïòàíà – 9 è ò.ä.
Åñëè ó ìîëåêóëû àëêàíà îòíÿòü îäèí ïðîòîí (àòîì âîäîðîäà), òî ïîëó÷èòñÿ ðàäèêàë:
Ôèçè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ – Ñ1-Ñ4 – ãàçû, Ñ5-Ñ17 – æèäêîñòè, à óãëåâîäîðîäû ñ êîëè÷åñòâîì àòîìîâ óãëåðîäà áîëüøå 18 – òâåðäûå âåùåñòâà.
Ñ ðîñòîì öåïè ïîâûøàåòñÿ òåìïåðàòóðà êèïåíèÿ è ïëàâëåíèÿ. Ðàçâåòâëåííûå àëêàíû èìåþò áîëåå íèçêèå òåìïåðàòóðû êèïåíèÿ, ÷åì íîðìàëüíûå.
Àëêàíû íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðÿþòñÿ â íåïîëÿðíûõ îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Ëåãêî ñìåøèâàþòñÿ äðóã ñ äðóãîì.
Ïîëó÷åíèå àëêàíîâ.
Ñèíòåòè÷åñêèå ìåòîäû ïîëó÷åíèÿ àëêàíîâ:
1. Èç íåíàñûùåííûõ óãëåâîäîðîäîâ – ðåàêöèÿ «ãèäðèðîâàíèÿ» ïðîòåêàåò ïîä âîçäåéñòâèåì êàòàëèçàòîðà (íèêåëü, ïëàòèíà) è ïðè òåìïåðàòóðå:
2. Èç ãàëîãåíïðîèçâîäíûõ – ðåàêöèÿ Âþðöà: âçàèìîäåéñòâèå ìîíîãàëîãåíàêëêàíîâ ñ ìåòàëëè÷åñêèì íàòðèåì, â ðåçóëüòàòå ÷åãî ïîëó÷àþòñÿ àëêàíû ñ óäâîåííûì ÷èñëîì óãëåðîäíûõ àòîìîâ â öåïè:
3. Èç ñîëåé êàðáîíîâûõ êèñëîò. Ïðè âçàèìîäåéñòâèè ñîëè ñ ùåëî÷è, ïîëó÷àþòñÿ àëêàíû, êîòîðûå ñîäåðæàò íà 1 àòîì óãëåðîä ìåíüøå ïî ñðàâíåíèþ ñ èñõîäíîé êàðáîíîâîé êèñëîòîé:
4. Ïîëó÷åíèå ìåòàíà.  ýëåêòðè÷åñêîé äóãå â àòìîñôåðå âîäîðîäà:
Ñ + 2Í2 = ÑÍ4.
 ëàáîðàòîðèè ìåòàí ïîëó÷àþò òàê:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Õèìè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ àëêàíû – õèìè÷åñêè èíåðòíûå ñîåäèíåíèÿ, îíè íå ðåàãèðóþò ñ êîíöåíòðèðîâàííîé ñåðíîé è àçîòíîé êèñëîòîé, ñ êîíöåíòðèðîâàííîé ùåëî÷üþ, ñ ïåðìàíãàíàòîì êàëèÿ.
Óñòîé÷èâîñòü îáúÿñíÿåòñÿ ïðî÷íîñòüþ ñâÿçåé è èõ íåïîëÿðíîñòüþ.
Ñîåäèíåíèÿ íå ñêëîííû ê ðåàêöèÿõ ðàçðûâà ñâÿçè (ðåàêöèÿ ïðèñîåäèíåíèÿ), äëÿ íèõ ñâîéñòâåííî çàìåùåíèå.
1. Ãàëîãåíèðîâàíèå àëêàíîâ. Ïîä âîçäåéñòâèåì êâàíòà ñâåòà íà÷èíàåòñÿ ðàäèêàëüíîå çàìåùåíèå (õëîðèðîâàíèå) àëêàíà. Îáùàÿ ñõåìà:
Ðåàêöèÿ èäåò ïî öåïíîìó ìåõàíèçìó, â êîòîðîé ðàçëè÷àþò:
À) Èíèöèèðîâàíèå öåïè:
Á) Ðîñò öåïè:
Â) Îáðûâ öåïè:
Ñóììàðíî ìîæíî ïðåäñòàâèòü â âèäå:
2. Íèòðîâàíèå (ðåàêöèÿ Êîíîâàëîâà) àëêàíîâ. Ðåàêöèÿ ïðîòåêàåò ïðè 140 °Ñ:
Ëåã÷å âñåãî ðåàêöèÿ ïðîòåêàåò ñ òðåòèòè÷íûì àòîìîì óãëåðîäà, ÷åì ñ ïåðâè÷íûì è âòîðè÷íûì.
3. Èçîìðèçàöèÿ àëêàíîâ. Ïðè êîíêðåòíûõ óñëîâèÿõ àëêàíû íîðìàëüíîãî ñòðîåíèÿ ìîãóò ïðåâðàùàòüñÿ â ðàçâåòâëåííûå:

4. Êðåêèíã àëêàíîâ. Ïðè äåéñâèè âûñîêèõ òåìïåðàòóð è êàòàëèçàòîðîâ âûñøèå àëêàíû ìîãóò ðâàòü ñâîè ñâÿçè, îáðàçóÿ àëêåíû è àëêàíû áîëåå íèçøèå:
5. Îêèñëåíèå àëêàíîâ.  ðàçëè÷íûõ óñëîâèÿõ è ïðè ðàçíûõ êàòàëèçàòîðàõ îêèñëåíèå àëêàíà ìîæåò ïðèâåñòè ê îáðàçîâàíèþ ñïèðòà, àëüäåãèäà (êåòîíà) è óêñóñíîé êèñëîòû.  óñëîâèÿõ ïîëíîãî îêèñëåíèÿ ðåàêöèÿ ïðîòåêàåò äî êîíöà – äî îáðàçîâàíèÿ âîäû è óãëåêèñëîãî ãàçà:

Ïðèìåíåíèå àëêàíîâ.
Àëêàíû íàøëè øèðîêîå ïðèìåíåíèå â ïðîìûøëåííîñòè, â ñèíòåçå íåôòè, òîïëèâà è ò.ä.
Источник
Органическая химия
Мы приступаем к новому разделу – органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) – насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями – содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
– CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen – имя + calare – созывать) – совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса “ан”: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos –
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

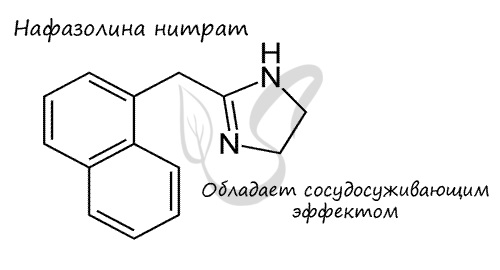
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros – составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

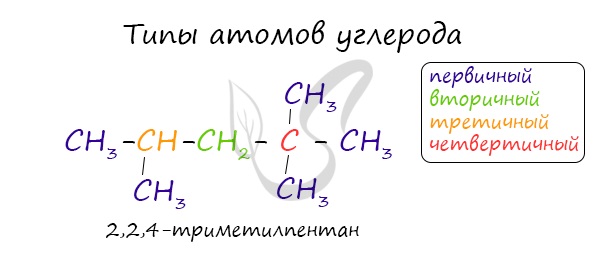
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
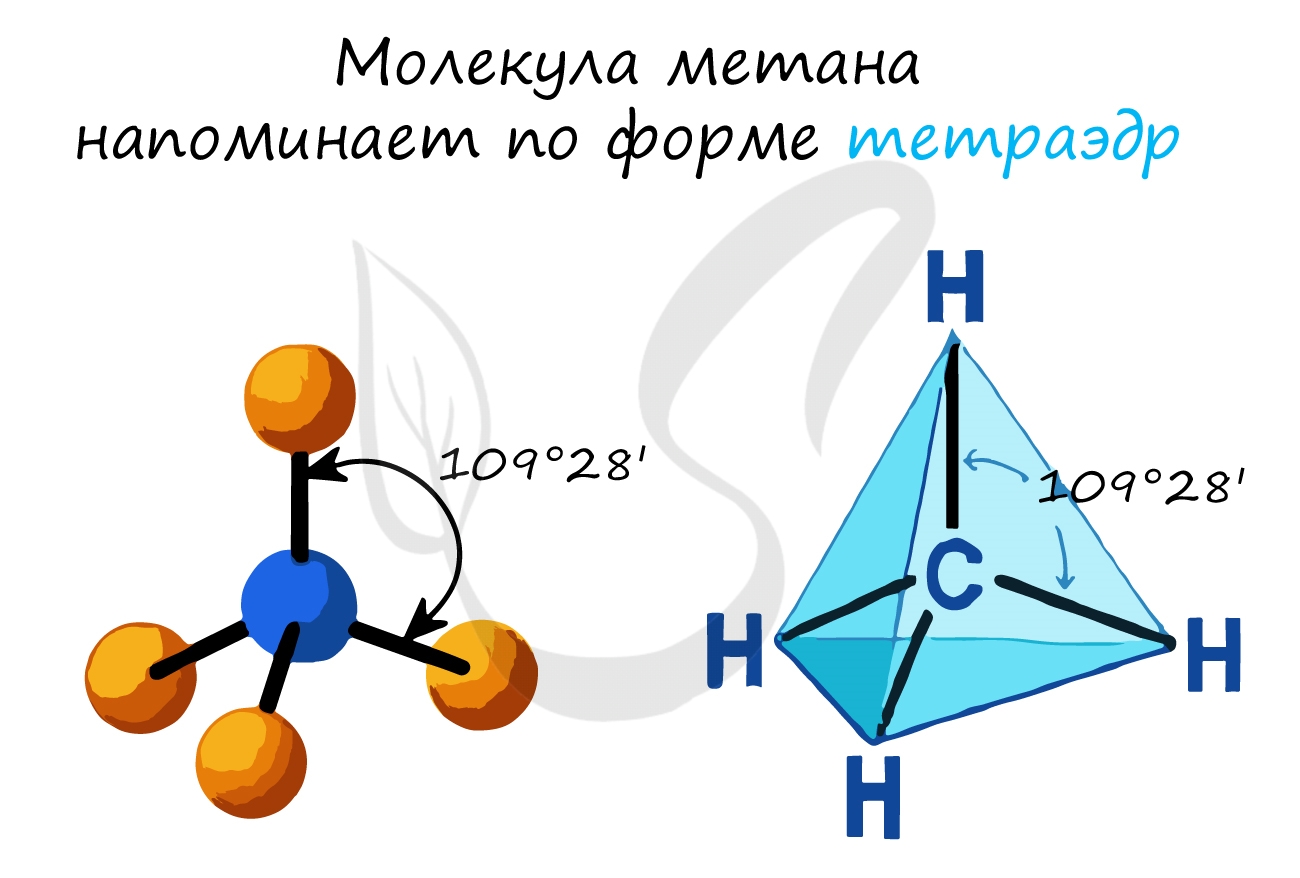
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода – sp3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
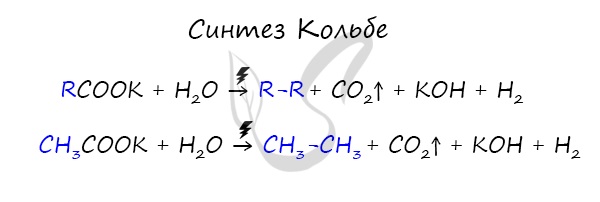
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

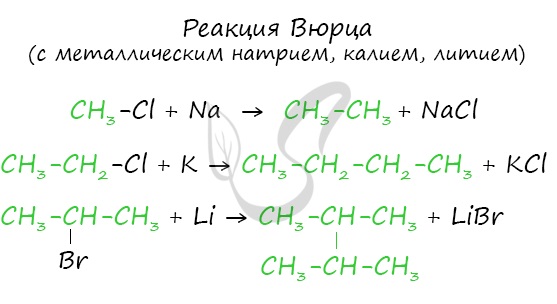
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы – насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее – у вторичного и значительно труднее – у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту – HNO3 – можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
Пиролиз (греч. πῦρ – огонь + λύσις – разложение) – термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения – в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
