Какие свойства характерны для цементита

Химическое соединение железа с углеродом в определённых пропорциях приводит к появлению карбида железа, который называется цементит. Обладая низкой растворимостью в любой фракции железа этот процесс возможен только при высокой температуре. Это обусловлено низкой растворимостью углерода в железе.Структура цементита имеет форму правильного ромба. Химическая формула цементита указывает на наличие в молекуле трёх атомов железа и одного атома углерода. Она записывается следующим образом Fe3C.
Кристаллическая решётка такого соединения выглядит достаточно сложно. Она состоит из нескольких геометрических фигур, которые называются октаэдрами. У каждого из октаэдров в одной из вершин расположен атом углерода. Общая связь атомов железа и углерода получается достаточно сложной. Как показала металлургия, отдельный атом углерода находится в окружении восьми атомов железа. У каждого атома железа имеет связь с тремя атомами углерода. Их главные оси ориентированы относительно друг друга под некоторыми углами. Проведенный нейтронографический анализ наглядно подтвердил, что решётка цементита имеет именно такую форму.
Химические свойства
Как химическое соединение цементит обладает своими физическими, химическими и механическими характеристиками. Он имеет серый кристаллический вид на изломе, относительно твёрдый с высокой термической устойчивостью. Основные химические свойства цементита выражаются в следующих показателях:
- химическая формула Fe3C;
- разложение структуры происходит при температуре более 1650°С;
- подвержен воздействию различных кислот (особенно высоко концентрированных);
- быстро вступает в реакцию с кислородом.
На основании существующих химических свойств сформированы физические и механические свойства. К основным физическим свойствам относятся:
- температура плавления равняется 1700 °С;
- молекулярная масса составляет 179,55 а.е.м.;
- плотность цементита равна 7,7 г/см3 при температуре равной 20 °С.
К основным механическим свойствам относятся:
- твердость;
- стойкость к ударным воздействиям (хрупкость);
- сопротивление на излом;
- пластичность.
Твёрдость этого соединения достигает больших значений и равна НВ 8000 МПа или HRC 70. Однако он обладает достаточной хрупкостью и низкой пластичностью.
Обладая перечисленными свойствами, цементит активно используется при производстве литых деталей различного назначения. Образование различного вида цементита и его соединений с другими формами приводит к изменению характеристик получаемой стали или чугуна, следовательно, к улучшению или снижению отдельных потребительских свойств.
Например, для получения белого чугуна и придания ему высокой прочности и пластичности стараются перевести цементит в графит. Это достигается при проведении операции отжига. При возрастании температуры он распадается на две составляющие: феррит и графит.
Иногда вместо феррита в чугуне образуется перлит. В этих случаях получается две формы чугуна. Первая называется ферритным, вторая – перлитным.
В зависимости от требуемых свойств в чугуне стараются сохранить требуемое количество цементита. Особенно это касается так называемого свободной фракции этого соединения. Для снижения его концентрации применяют различные способы химической и термической обработки. Для решения этой задачи применяют раствор азотной кислоты в чистом спирте. Структурно свободный цементит выпадает в осадок в результате кипячения чугунной болванки в этом растворе. Кроме этого применяют три вида обработки: отжиг, нормализацию и закалку.
Техническое железо содержит третичный цементит в сочетании с ферритом. Он проявляется по границе феррита при содержании углерода от 0,01% до 0,025%. Для повышения качества стали стараются снизить содержание свободного цементита. Особенно его концентрация наблюдается в мягких марках стали. Большое влияние на качество штамповки оказывает содержание этой смеси и перлита в единице объёма. Излишнее присутствие третичного цементита, особенно в форме продолжительной цепочки или сетки приводит к образованию разрывов во время штамповки. Поэтому для получения хорошей ковочной стали стараются снизить количество третичного цементита. Структура таких образований не должна превышать второго балла по установленной шкале. Получаемая твёрдость не должна превышать HB 50 единиц.
Первичный, вторичный и третичный цементит
По способу и области образования он подразделяется на три основных вида:
- первичный;
- вторичный;
- третичный.
Образование первичного цементита наблюдается в процессе кристаллизации заэвтектического чугуна. В этот момент образуются кристаллы вытянутой формы. Они образовывают первичный карбид. Первичное образование может проявляться в доэвтектическом чугуне в составе ледебурита в процессе кристаллизации расплава. Проведенные исследования показали, что такая смесь железа и углерода присутствует не только в белом чугуне. Она может проявиться в сером чугуне после завершения операции так называемой графитизации.
Процесс образования вторичного вида наблюдается в основном при охлаждении аустенита. Это явление наблюдается при снижении температуры ниже 1147 °С. При такой температуре происходит снижение концентрации углерода в аустените. Освободившиеся атомы углерода вступают в новые связи, и образуется цементит, который называется вторичным. При дальнейшем снижении температуры до эвтектоидной продолжается его формирование. Даже при комнатной температуре он встречается в составе перлита. В этих условиях его можно обнаружить в заэвтектоидной стали. Он образовывается на границах зернистой структуры.
Процесс охлаждения феррита формирует так называемый третичный цементит. Данный вид достаточно сложно зафиксировать, и проводит дальнейшее наблюдение за его образованием. Эта проблема связана с появлением третичного цементита в небольших количествах. Исследования образования данной фракции показали, что он приобретает несколько форм: пластинки, прожилки или в форме иголок. Все эти элементы формируются в зёрнах феррита. Третичное образование достаточно сложно получить, потому что при повышении процентного содержания углерода третичный цементит соединяется с перлитом. При повышении скорости охлаждения содержание углерода сохраняется в растворе металла и образование третичной фракции прекращается. Явным признаком образования является результат постепенного старения феррита. В этом случае в содержании феррита изменяется концентрация углерода.
Из приведенного выше описания можно сделать следующие выводы:
- первичная фракция образовывается в результате кристаллизации расплава;
- вторичный – в результате последовательного охлаждения аустенита;
- третичный – после охлаждения феррита.
В различных марках стали и чугуна цементит первичный обладает высокой вариативностью формы. Это могут быть пластины правильной формы полоски или образования в форме иголок. При проведении операции отжига он может принимать форму округлых образований. Как результат трансформируется в зернистый перлит.
Источник
Цементит – химическое соединение углерода с железом (карбид железа), Fe3C – одна из структурных составляющих
железоуглеродистых сплавов
(чугун, сталь),
содержит 6,67% C.
Цементит относится к неустойчивым соединениям и при определённых условиях распадается с образованием свободного углерода в виде
графита.
Цементит способен образовывать твёрдые растворы замещения. Атомы углерода (C) могут замещаться атомами
неметаллов – N, O; атомы железа (Fe) – металлами Mn, Cr, W и другими. Такой твёрдый раствор на базе решётки
цементита называется легированным цементитом. Обычное обозначение легированного цементита M3C, где под буквой M понимается
железо и другие металлы, замещающие атомы железа в решётке цементита.
Цементит Fe3C имеет ромбическую структуру. Периоды решётки: a=0,45244±0,0005 нм,
b=0,50885±0,0005 нм, c=0,67431±0,0005 нм; последующие исследования подтвердили эту структуру и дали близкие
значения периодов. Нейтронографический анализ также подтвердил ромбическую структуру цементита. Температура перехода
цементита из ферромагнитного в парамагнитное состояние равна 215°С.
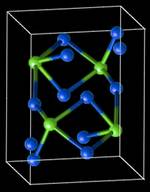
На рисунке [5] представлена ячейка кристаллической решётки цементита. Кристаллическая структура цементита очень сложна.
Кристалл цементита состоит из ряда октаэдров, оси которых расположены друг к другу под некоторыми углами. Внутри каждого октаэдра
располагается атом углерода. На рисунке зелёным цветом выделены атомы углерода: каждый атом углерода окружён восемью атомами железа;
каждый атом железа связан с тремя атомами углерода.
Свойства цементита
Цементит имеет металлические свойства (электропроводность, металлический блеск и т.д.) благодаря тому, что в решётке и железо и углерод
положительно ионизованы, то есть и металл и углерод ведут себя в соединении, как металл.
Цементит хрупок, имеет высокую твёрдость (HB более 800); tпл=1250°C;
Цементит имеет чрезвычайно низкую, практически нулевую пластичность. Эти свойства цементита являются, вероятно, следствием сложности
строения кристаллической решётки цементита.
При низких температурах цементит слабо ферромагнитен. Магнитные свойства цементит, согласно различным источникам, теряет
при температуре 215-217°.
Температура плавления цементита
Согласно данным Гуляева А.П. [2] температура плавления цементита – около 1600°.
По расчётным данным [3], виртуальная температура плавления цементита оценивается равной 1200-1450°. Возможно, цементит испытывает
инконгруэнтное разложение при температурах 1250-1300°.
Первичный цементит
Различают первичный, вторичный и третичный цементит. Первичный цементит выделяется из жидкости. Первичный цементит выделяется только
при закалке сплавов, содержащих до 5,5% (по массе) углерода [3]. Форма первичного цементита: длинные крупные пластины.
Вторичный цементит
Вторичный цементит выделяется из аустенита – γ-твёрдого раствора. При охаждении выделение происходит по линии ES
(диаграмма Fe-C). Форма вторичного цементита: цементитная сетка, цементит по границам зёрен.
Третичный цементит
Третичный цементит выделяется из феррита. Форма третичного цементита: пластинки и прожилки, а также выделения в виде иголок в ферритном зерне.
При более быстром охлаждении часть углерода остаётся в твёрдом растворе; выделение третичного цементита подавляется.
Другие формы существования цементита (по Хоу): цементит перлита,
цементит ледебурита, цементит Стеда, зернистый цементит, специальные карбиды.
Автор обзора: Корниенко А.Э. (ИЦМ)
Лит.:
- Иванов В.Н. Словарь-справочник по литейному производству. – М.: Машиностроение, 1990. – 384 с.: ил. ISBN 5-217-00241-1
- Гуляев А.П. Металловедение. – М.: Металлургия, 1977. – УДК669.0(075.8)
- Диаграммы состояния двойных и многокомпонентных систем на основе железа: Справ. изд./ Банных О.А., Будберг П.Б., Алисова С.П. и др. М.: Металлургия, 1986. 440 с. УДК 669.15.017.12(083)
- Циммерман Р., Гюнтер К. Металлургия и материаловедение. Справ изд. Пер. с нем. М.: Металлургия, 1982. 480 с.
- H. K. D. H. Bhadeshia. The Structure of Cementite // Department of Materials Science and Metallurgy/ University of Cambridge [Электронный ресурс], Last updated 19/6/2008 – Режим доступа: https://www.msm.cam.ac.uk/, свободный. – Загл. с экрана.
См. также Железоуглеродистые сплавы, Диаграмма состояния системы железо-цементит.
Источник
Цементит – это химическое соединение состава Fe3C – карбид железа. Известно, что растворимость углерода в железе невелика: в α – железе растворяется около 0,02% С при эвтектоидной температуре, а при комнатной – порядка 0,008%. В – железе растворяется до 2,14% С при температуре 1147оС, при комнатной температуре -железо не существует (про аустенит при комнатной температуре написано в статье «Как увидеть аустенит?» на этом сайте). Поэтому в структуре стали и чугуна углерод находится в связанном состоянии в виде цементита или в свободном состоянии в виде графита.
Сейчас речь о цементите. Температура плавления цементита – порядка 1250 оС. Цементит имеет твердость порядка 800 HB и очень низкую пластичность. Такие свойства цементита связаны с его сложной кристаллической решеткой (рис. 1).

Рисунок 1. Схема кристаллической решетки цементита (А.П. Гуляев. Металловедение)
Нас интересует в первую очередь то, что цементит – это фаза железоуглеродистых сплавов. Если исходить только из диаграммы состояния железо-углерод, то различают цементит первичный, вторичный и третичный. Положение этих видов цементита показано на диаграмме состояния (рис. 2) различным цветом.

Рисунок 2. Цементит на диаграмме состояния железо-углерод.
Первичный цементит формируется в заэвтектическом чугуне непосредственно при кристаллизации (рис.3). Длинные протяженные кристаллы – это выделения первичного карбида. Область на диаграмме состояния, в которой присутствует только первичный цементит, окрашена в розовый цвет.

Рисунок 3 .Заэвтектический хромистый чугун
Цементит в составе ледебурита тоже относится к первичному цементиту (рис.4, 5). Цементит ледебурита в доэвтектическом чугуне тоже первичный, поскольку ледебурит формируется при кристаллизации расплава.
Рисунок 4. Дендриты первичного цементита (а) и ледебурит в половинчатом чугуне (б)

Рисунок 5. Ледебурит
Вторичный цементит формируется при охлаждении аустенита (зеленая область на диаграмме состояния), поскольку ниже 1147оС концентрация углерода в аустените снижается, а из «освободившегося» углерода формируется цементит. При эвтектоидной температуре аустенит распадается, поэтому ниже 727оС на диаграмме состояния всегда есть вторичный цементит. При комнатной температуре мы видим вторичный цементит в составе перлита, а также по границам зерен в заэвтектоидной стали (рис.6).

Рисунок 6. Вторичный цементит и перлит в заэвтектоидной стали
Третичный цементит формируется при охлаждении феррита (голубой участок на диаграмме состояния). В отличие от других видов цементита, его трудно наблюдать, поскольку он выделяется в небольших количествах, а при повышении концентрации углерода соединяется с цементитом перлита. Обычно третичный цементит выделяется по границам зерен (рис.7). Иногда он сам не виден, но декорирует границу зерна, и ее лучше видно.
Рисунок 7 .Третичный цементит в стали 08Ю (а), углеродистой стали (б,в)
Выделение третичного цементита – это результат старения. Дело в том, что концентрация углерода в феррите изменяется при изменении температуры. Предел насыщения феррита углеродом показывает линия PQ (рис.8). Концентрация углерода в феррите изменяется с изменением температуры – при 723 оС в феррите растворяется около 0,03 %С, а при комнатной температуре – до 0,008 %С. Если сталь нагреть выше линии PQ, а затем быстро охладить (т.е. закалить), то в результате закалки получим пересыщенный твердый раствор углерода в α – железе. Этот раствор не будет неизменным с течением времени. И при комнатной температуре, и при повышенной он будет распадаться – стареть. Упрочняющей фазой, образующейся при таком старении, и является третичный цементит.

Рисунок 8. Область выделения третичного цементита (отмечено голубым) на диаграмме состояния железо-углерод.
Итак:
• первичный цементит кристаллизуется из расплава;
• вторичный цементит формируется при охлаждении аустенита;
• третичный цементит формируется при охлаждении феррита.
В сталях и чугунах цементит может принимать разный вид. Вторичный цементит в сталях может иметь различную морфологию. Обычно цементит имеет форму пластинок в составе перлита (рис. 9 а). Тогда отличить его от феррита можно только при специальном травлении. После определенного отжига перлит трансформируется, а цементит принимает форму округлых включений. Это зернистый перлит (рис. 9 б). Статья о зернистом перлите есть на этом сайте.
В сталях, где есть легирующие элементы, цементит не имеет формулы Fe3C. Цементит может образовать твердые растворы замещения. Атомы углерода могут заменяться другими неметаллами – азотом, кислородом, атомы железа – атомами легирующих элементов – хромом, никелем, вольфрамом и т.д. В этом случае формируется легированный цементит, формулу которого записывают как Me3C. Буква М обозначает атомы металлов, частично замещающие железо. В большинстве сталей цементит легированный. Мы имеем дело с цементитом сталей, в основном, в следующих случаях. После нормализации цементит стали входит в состав перлита (вторичный цементит, рис.6); иногда можно видеть и третичный цементит (рис. 7). После закалки и отпуска в стали присутствуют карбиды; состав их различен; но так или иначе карбиды состава Me3C надо отнести ко вторичному цементиту. На рис. 10 показаны карбиды в стали Р18 после закалки и отпуска. Еще там можно увидеть остатки литой структуры («скелетик» в центре кадра); это карбид, который закристаллизовался из жидкости; можно принять его как первичный цементит. Он не устранился дальнейшей обработкой.Это дефект структуры, который ведет к снижению свойств.
Рисунок 9. Морфология цементита в стали: а – пластинчатый цементит, б – глобулярный.

Рисунок 10 . Первичный цементит и карбиды в стали Р18
В белом чугуне присутствует первичный цементит, аналогичный по структуре тому, который показан на рис.3 и 4. В серых чугунах (после операции графитизации) иногда может остаться незначительное количество цементита (рис.11 а, включение цементита отмечено стрелкой), а также цементит перлита, который не распадается при отжиге (рис. 11 б). На рис.12 белые «скелетики» – это первичный цементит в аустенитном чугуне; белые мелкие включения по полю – тоже выделения цементита (или карбидов, потому что это легированный чугун), который можно назвать вторичным.
Рисунок 11. Структура серого чугуна.

Рисунок 12. Цементит в аустенитном чугуне.
Источник
Все рассмотренные фазовые переходы были изобарическими,
в частности фазовые переходы воды в последних роликах происходили при давлении на уровне моря,
равном одной атмосфере.
В реальности всё по-другому.
В реальном мире нигде не поддерживается постоянное давление в 1 атмосферу.
1 атмосфера – это давление на уровне моря на Земле.
Давление зависит от размера планеты, от толщины атмосферы,
от условий, в которых существуют газы, жидкости и твердые тела.
Итак, перед вами фазовая диаграмма.
Я запишу.
«Фазовая диаграмма».
Есть несколько форм записи диаграммы.
Это – самая популярная из них,
на которой показаны агрегатные состояния и переходы между ними при изменении температуры и давления.
Это диаграмма для воды.
По оси ординат отложена величина давления,
Давайте-ка подпишу.
По оси абсцисс – температура, а области диаграммы соответствуют различным агрегатным состояниям:
твердое тело, жидкость… жидкость и, наконец, газ.
Посмотрим, какому агрегатному состоянию соответствует температура в 0 градусов.
Так вот, температура 0 градусов Цельсия и давление в 1 атмосферу.
На графике им соответствует вот эта точка.
Это граница между твердым телом и жидкостью при давлении в 1 атмосферу.
Давление здесь равно 1 атмосфере.
Это соответствует общеизвестному факту, что лед плавится при 0 градусов.
Что случится, если мы увеличим давление?
Лед станет плавиться при меньшей температуре.
Увеличим давление, например, до 10 атмосфер, что в 10 раз больше,
чем давление на уровне моря.
Температура, при которой твердое тело переходит в жидкое состояние, уменьшится.
Если давление уменьшить, например оказаться в Денвере,
который на милю выше уровня моря,
то температура замерзания увеличится где-то до 1 градуса.
Здесь не совсем верный масштаб, но суть в том, что лед замерзнет быстрее,
то есть при более высокой температуре, в Денвере,
чем на дне Мертвого моря или в Долине смерти, которые расположены ниже уровня моря.
Область справа от фиолетовой линии соответствует газу.
Вернемся к атмосферному давлению.
Это диаграмма для воды.
Мы знаем, как она себя ведет при давлении в 1 атмосферу.
Я проведу линию.
При давлении в 1 атмосферу и температуре 0 градусов твердый лед превращается в жидкую воду.
Двигаясь вдоль этой линии, мы попадаем в область высокой температуры.
В этой точке графика температура равна 100 градусам.
При такой температуре и давлении в 1 атмосферу жидкая вода превращается в водяной пар, то есть вскипает.
Это температура кипения воды.
Что, если снизить давление?
Вновь отправимся в Денвер.
Вот Денвер.
Хотя нет, нужно что-то более наглядное.
Пусть лучше это будет гора Эверест, там давление низкое.
C понижением давления температура замерзания растет, а кипения – снижается,
так что воду проще вскипятить на вершине Эвереста,
чем у ее подножья или в низине Долины смерти.
Представьте себе жидкость. В ней миллионы молекул, которые располагаются очень близко,
но при этом обладают достаточной кинетической энергией,
чтобы двигаться по отношению друг к другу.
Молекулы движутся – жидкость течет.
Молекулы не испаряются, не выпрыгивают наружу, потому что на них сверху давит воздух.
О давлении воздуха я уже рассказывал.
Давление, создаваемое молекулами газа,
зависит от их температуры, а также от кинетической энергии.
Молекулы газа находятся сверху и не позволяют молекулам жидкости выпрыгивать.
Они не дают им отделиться друг от друга и превратиться в газ.
Чем больше давление, тем сложнее молекулам сбежать.
А теперь перенесем жидкость в вакуум,
на поверхность Луны, где нет воздуха, и слегка встряхнем.
Эти молекулы по-прежнему притягиваются друг к другу,
но в отсутствие внешнего давления небольшого толчка хватит им,
чтобы превратиться в газ.
Чем ниже давление, тем легче жидкости, даже твердому телу стать газом.
Даже твердые тела испаряются.
Для этого нужно очень низкое давление.
Посмотрите на левую часть графика.
Это практически вакуум.
Возьмите лед на поверхность Луны,
в область с нужной температурой,
я уверен, что там минус,
но не помню, сколько именно, лед испарится, превращаясь в пар.
В условиях глубокого вакуума молекулам вещества достаточно малейшего толчка,
чтобы начать испаряться.
И такое может произойти не только на Луне.
Чтобы было понятнее, рассмотрим фазовую диаграмму двуокиси углерода.
Вот она, смотрите.
Это углекислый газ.
Мы его выдыхаем, зеленые растения его потребляют.
И это вещество при 1 атмосфере ведет себя иначе, чем вода.
Обратите внимание, масштаб здесь не соблюден.
Расстояния между 1 и 5 атмосферамии между пятью и семидесятью тремя на самом деле не равны между собой.
Здесь тоже не выдержан масштаб.
Если бы это было важно, я бы, наверное, использовал логарифмический масштаб.
Но вернемся к двуокиси углерода.
Вот твердая двуокись углерода, вот газ, а вот жидкое вещество.
При давлении в одну атмосферу, то есть на уровне моря,
например, как в Новом-Орлеане,
если создать температуру -80 градусов Цельсия, двуокись углерода замерзнет.
Вы с этим сталкивались.
Не уверен, что его до сих пор используют в дымогенераторах,
но ведь все слышали про сухой лед.
Это твердая двуокись углерода.
При атмосферном давлении на уровне моря при температуре -78,5 градусов он сублимируется.
Сублимация – это переход из твердого состояния в жидкое.
Запишу это.
Поэтому не существует такого вещества, как жидкая двуокись углерода.
Я такого никогда не видел.
Чтобы сделать двуокись углерода жидкой,
нужно давление в 5 атмосфер, то есть в 5 раз выше, чем давление на уровне моря.
Такое возможно на Юпитере или Сатурне,
где давление огромное из-за гравитации и толщины атмосферы.
Жидкая двуокись углерода встречается в естественных условиях на газовых планетах-гигантах.
А на Земле сухой лед возгоняется.
Это синоним для сублимации.
Из твердого состояния в газообразное,
минуя жидкость.
Есть еще кое-то интересное,
и вы уже могли это заметить.
Эта точка называется тройной,
потому что при пяти атмосферах и минус 56 градусах Цельсия
двуокись углерода находится в состоянии равновесия между льдом, жидкостью и газом.
Понемногу в каждом из них.
Можно подтолкнуть вещество в сторону одного из состояний, изменив условия.
А вот тройная точка для воды.
При давлении ниже, чем атмосферное.
Это 611 паскаль, что где-то в 200 раз меньше, чем одна атмосфера.
При таком давлении и температуре чуть выше 0 расположена тройная точка воды.
Здесь вода находится в равновесии между этими тремя состояниями.
Есть еще одна интересная точка – здесь.
Критическая точка.
Звучит серьезно и важно, не так ли?
Если поднять температуру или давление еще выше,
получится сверхкритическая жидкость.
Звучит круто.
Все, что дальше, – сверхкритическая жидкость.
С высокой температурой и давлением.
Температура делает из нее газ,
но давление превращает в жидкость – это и то, и другое.
Сверхкритическая вода используется как растворитель.
Она ведет себя как жидкая вода, в ней можно растворять вещества,
а еще она может проникать в твердые тела и просачиваться куда угодно,
чтобы убрать какое-то загрязнение или растворить какую-либо соль.
Сверхкритические жидкости очень интересны.
И причина, по которой я показал вам эти диаграммы,
в том, что давление так же может меняться, как и температура вещества.
При температуре 100 градусов Цельсия или даже 110 на уровне моря вода будет газом.
Вот отметка 110 градусов, и это водяной пар.
Теперь увеличим значение давления, например углубимся под землю или на дно океана,
и водяной пар сконденсируется в жидкость.
Если переместиться в область более низких температур,
можно увидеть явление, обратное сублимации.
Вроде бы, я записывал его название.
А, нет.
Его нет.
Оно подобно конденсации, но я забыл его название.
Это переход из газообразного состояния напрямую в твердое, минуя жидкость.
Польза этих диаграмм в том,
что они позволяют предугадать поведение вещества при изменении давления и температуры.
Subtitles by the Amara.org community
Источник
