Какие свойства характерны для ферментов
К ферментам применимы три основных критерия, характерных для неорганических катализаторов:
1) они остаются относительно неизменными после реакции, то есть освобождаются вновь и могут реагировать с новыми молекулами субстрата;
2) ферменты оказывают свое действие в ничтожно малых концентрациях;
Например: 1 молекулареннина (содержится в слизистой оболочке желудка теленка) створаживает около 106 молекул казеиногена молока за 10 минутпри 37 0C;
3) наличие фермента (катализатора) не оказывает влияния как на величину константы равновесия, так и на изменения свободной энергии. Катализаторы лишь повышают скорость реакций (точку равновесия не сдвигают).
1. Термолабильность ферментов.Скорость химической реакции зависит от температуры. Реакции, катализируемые ферментами, так же чувствительны к изменениям температуры. Скорость химической реакции повышается в два раза при повышении температуры на 10 0C. Ускорение реакции идет до 45 0C, затем, в связи с денатурацией белка-фермента, снижается. При 100 0C почти все ферменты полностью утрачивают свою активность.
Оптимальной температурой для ферментов теплокровных является 37-40 0C. При низких температурах (0° и ниже) ферменты не разрушаются, не денатурируют, но активность их снижается до нуля рис. 4.3.).
Рис.4.3. Влияние температуры на скорость катализируемой ферментом реакции.
а – повышение скорости реакции как функция температуры;
б – понижение скорости реакции как функция денатурации белка-фермента; стрелка (→) указывает оптимум температуры.
2. Зависимость активности ферментов от рН среды.
Ферменты обычно активны в узких пределах значений рН, как правило, рН 6,0-8,0. Каждый фермент имеет свой оптимум рН. рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключением является пепсин, рН-оптимум которого – 2,0. Объясняется это функцией пепсина, т.к. в желудочном соке содержится свободная соляная кислота, создающая кислое значение рН.
Влияние изменений рН среды на активность фермента заключается в том, что изменяется степень ионизации кислотных и основных групп (-COOH, -SH, имидазольной, -NH2 и т.д.).
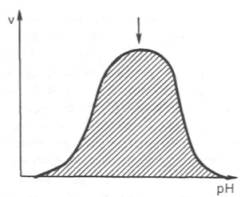
При разных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса (рис.4.4).
Рис.4.4. Влияние рН на скорость катализируемой ферментом реакции (стрелка указывает оптимум рН).
3. Специфичность ферментов.Ферменты обладают высокой специфичностью действия и этим существенно отличаются от неорганических катализаторов. Например: измельченная платина или палладий могут катализировать восстановление десятков соединений различной структуры. А фермент обычно проявляет свою активность только при полном соответствии активного центра и субстрата, только при «узнавании» обычно протекает одна высокоспецифичная реакция среди тысячи других химических реакций, осуществляемых в живой клетке. В зависимости от механизма действия различают ферменты с относительной или групповой и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов характерна относительная специфичность.
Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, аминокислотному составу и физико-химическим свойствам. Однако пепсин не расщепляет жиры и углеводы; пепсин разрывает пептидную связь – СО–NH – между аминокислотами.
Липаза, катализирующая гидролиз жиров на глицерин и жирные кислоты, разрывает сложноэфирные связи. Аналогично групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидролизирующие α-гликозидные связи в полисахаридах. Указанные ферменты пищеварительные, их групповая специфичность имеет биологический смысл.
Абсолютная специфичность – это способность фермента катализировать превращение только единственного субстрата. Например: аргиназа, расщепляющая в организме аргинин; уреаза, катализирующая распад мочевины и др.
Стереохимическая специфичность: оксидазы (аминокислот) действуют только на свой специфический стереоизомер – L- или D-аминокислот. Специфичностью обладают также ферменты, катализирующие синтетические реакции.
Источник
К ферментам
применимы три основных критерия, характерных и для неорганических
катализаторов. В частности, они остаются неизмененными после реакции, т.е.
освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя
нельзя исключить побочных влияний условий среды на активность фермента).
Ферменты способны оказывать действие в ничтожно малых концентрациях (например,
одна молекула фермента реннина, содержащегося в слизистой оболочке желудка
теленка, створаживает около 106молекул казеиногена молока за 10 мин
при температуре 37°С). Наличие либо отсутствие фермента или любого другого
катализатора не оказывает влияния на величину константы равновесия и свободной
энергии (ΔG). Катализаторы лишь повышают скорость, с которой система
приближается к термодинамическому равновесию, не сдвигая точки равновесия.
Химические реакции с высокой константой равновесия и отрицательной величиной
ΔG принято называть экзергоническими. Реакции с низкой константой
равновесия и соответственно положительной величиной ΔG (они обычно не
протекают спонтанно) называются эндерго-ническими. Для начала и завершения этих
реакций необходим приток энергии
извне. В живых системах экзергонические процессы обычно сопряжены с
эндергоническими реакциями, обеспечивая последние необходимым количеством
энергии.
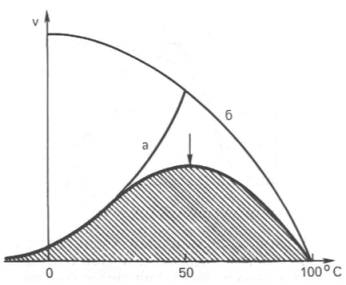
Рис. 4.16. Зависимость скорости катализируемой
ферментом реакции от температуры.
а – повышение
скорости реакции как функция температуры; б – снижение скорости реакции как
функция денатурации белка-фермента; стрелка указывает оптимум температуры.
Ферменты,
являясь белками, обладают рядом характерных для этого класса органических
соединений свойств, отличающихся от свойств неорганических катализаторов.
Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому
катализируемые ферментами реакции также чувствительны к изменениям температуры.
Установлено, что скорость большинства биохимических реакций повышается в 2 раза
при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении
температуры на 10°С. Этот показатель получил название температурного
коэффициента. Однако вследствие белковой природы фермента тепловая денатурация
при повышении температуры будет снижать эффективную концентрацию фермента с
соответствующим снижением скорости реакции. Так, при температуре, не
превышающей 45–50°С, скорость реакции увеличивается согласно теории химической
кинетики. При температуре выше 50°С на скорость реакции большое влияние
начинает оказывать тепловая денатурация белка-фермента, приводящая к полному
прекращению ферментативного процесса (рис. 4.16).
Таким
образом, термолабильность, или чувствительность к повышению температуры,
является одним из характерных свойств ферментов, резко отличающих их от
неорганических катализаторов. В присутствии последних скорость реакции возрастает
экспоненциально при повышении температуры (см. кривую «а» на рис. 4.16). При
температуре 100°С почти все ферменты утрачивают свою активность (исключение
составляет, очевидно, только один фермент мышечной ткани – миокиназа, которая
выдерживает нагревание до 100°С). Оптимальной для действия большинства
ферментов теплокровных животных является температура 40°С; в этих условиях
скорость реакции оказывается максимальной вследствие увеличения кинетической
энергии реагирующих молекул. При низких температурах (0°С и ниже) ферменты, как
правило, не разрушаются, хотя активность их падает почти до нуля. Во всех
случаях имеет значение время воздействия соответствующей температуры. В
настоящее время для пепсина, трипсина и ряда других ферментов доказано
существование прямой зависимости

Рис. 4.17. Зависимость
скорости катализируемой ферментом реакции от рН (стрелка указывает оптимум рН).
между
скоростью инактивации фермента и степенью денатурации белка. Следует отметить,
что на термолабильность ферментов определенное влияние оказывает концентрация
субстрата, рН среды и другие факторы. Зависимость
активности ферментов от рН среды. Ферменты обычно наиболее активны в
пределах узкой зоны концентрации водородных ионов, соответствующей для животных
тканей в основном выработанным в процессе эволюции физиологическим значениям рН
среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы
имеется определенная точка, в которой фермент проявляет максимальную
активность; эту точку называют оптимумом рН среды для действия данного фермента
(рис. 4.17). При определении зависимости активности фермента от концентрации
водородных ионов реакцию проводят при разных значениях рН среды, обычно при
оптимальной температуре и наличии достаточно высоких (насыщающих) концентраций субстрата.
В табл. 4.3 приводятся оптимальные значения рН среды для ряда ферментов.
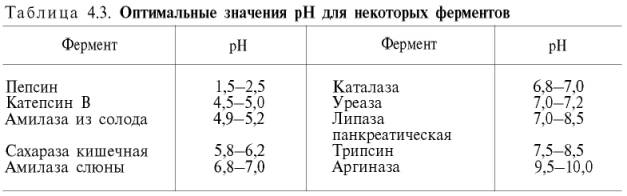
Из данных
табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах
физиологических значений. Исключение составляют пепсин, рН-оптимум которого 2,0
(при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых,
структурной организацией молекулы фермента и, во-вторых, тем, что пепсин
является компонентом желудочного сока, содержащего свободную соляную кислоту,
которая создает оптимальную кислую среду для действия этого фермента. С другой
стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой
среды нет в клетках печени, следовательно, in vivo аргиназа
функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Согласно
современным представлениям, влияние изменений рН среды на молекулу фермента
заключается в воздействии на состояние и степень ионизации
кислотных и основных групп (в частности, СООН-группы дикар-боновых аминокислот,
SH-группы цистеина, имидазольного азота гисти-дина, NH2-группы
лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут
подвергаться конформационным изменениям, приводящим к потере активности
вследствие денатурации или изменения заряда молекулы фермента. При разных
значениях рН среды активный центр может находиться в частично ионизированной
или неионизированной форме, что сказывается на третичной структуре белка и
соответственно на формировании активного фермент-субстратного комплекса. Имеет
значение, кроме того, состояние ионизации субстратов и кофакторов.
Специфичность ферментов. Ферменты обладают высокой специфичностью действия. Это
свойство часто существенно отличает их от неорганических катализаторов. Так,
мелкоизмельченные платина и палладий могут катализировать восстановление (с
участием молекулярного водорода) десятков тысяч химических соединений различной
структуры. Высокая специфичность ферментов обусловлена, как было отмечено,
конфор-мационной и электростатической комплементарностью между молекулами
субстрата и фермента и уникальной структурной организацией активного центра,
обеспечивающими «узнавание», высокое сродство и избирательность протекания
одной какой-либо реакции из тысячи других химических реакций, осуществляющихся
одновременно в живых клетках.
В зависимости
от механизма действия различают ферменты с относительной (или групповой) и
абсолютной специфичностью. Так, для действия некоторых гидролитических
ферментов наибольшее значение имеет тип химической связи в молекуле субстрата.
Например, пепсин в одинаковой степени расщепляет белки животного и
растительного происхождения, несмотря на то что эти белки существенно
отличаются друг от друга как по химическому строению и аминокислотному составу,
так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы,
ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина
является пептидная —СО—NH-связь. Для действия липазы, катализирующей гидролиз
жиров на глицерин и жирные кислоты, подобным местом является сложноэфирная
связь. Аналогичной групповой специфичностью обладают трипсин, химотрипсин,
пептидазы, ферменты, гидроли-зующие α-гликозидные связи (но не
β-гликозидные связи, имеющиеся в целлюлозе) в полисахаридах, и др. Обычно
эти ферменты участвуют в процессе пищеварения, и их групповая специфичность,
вероятнее всего, имеет определенный биологический смысл. Относительной
специфичностью наделены также некоторые внутриклеточные ферменты, например
гексокиназа, катализирующая в присутствии АТФ фосфорилиро-вание почти всех
гексоз, хотя одновременно в клетках имеются и специфические для каждой гексозы
ферменты, выполняющие такое же фос-форилирование (см. главу 10).
Абсолютной
специфичностью действия называют способность фермента катализировать
превращение только единственного субстрата. Любые изменения (модификации) в
структуре субстрата делают его недоступным для действия фермента. Примерами
таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в
организме) аргинин, уреаза, катализирующая распад мочевины, и др.
Имеются
экспериментальные доказательства существования так называемой стереохимической
специфичности, обусловленной существованием оптически изомерных L- и D-форм или
геометрических (цис-и транс-) изомеров
химических веществ. Так,
известны оксидазы L- и
D-аминокислот, хотя в природных белках обнаружены только L-ами-нокислоты.
Каждый из видов оксидаз действует только на свой специфический стереоизомер.


Наглядным
примером стереохимической специфичности является бактериальная
аспартатдекарбоксилаза, катализирующая отщепление СО2 только от
L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-реоспецифичность
проявляют ферменты, катализирующие и синтетические реакции. Так, из аммиака и
α-кетоглутарата во всех живых организмах синтезируется L-изомер
глутаминовой кислоты, входящей в состав природных белков. Если какое-либо
соединение существует в форме цис-и
транс-изомеров с различным
расположением групп атомов вокруг двойной связи, то, как правило, только один
из этих геометрических изомеров может служить в качестве субстрата для действия
фермента. Например, фумараза катализирует превращение только фумаровой кислоты
(трансизомер), но не действует на
малеиновую кислоту (цис-изомер):

Таким
образом, благодаря высокой специфичности действия ферменты обеспечивают
протекание с большой скоростью лишь определенных химических реакций из
огромного разнообразия возможных превращений в микропространстве клеток и
целостном организме, регулируя тем самым интенсивность обмена веществ.
Источник
Тимоха Змановский
30 января 2019 · 1,2 K
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас…
Основные свойства ферментов:
- Каталитические
- Высокая специфичность действия
- Неустойчивость
- Зависимость от температуры
- Зависимость от pH
Что такое ферменты? Чем они отличаются от не органических катализаторов?
Пеку тортики, ищу работу, живу с двумя котами, читаю книги, слушаю и играю…
Ферменты – белковые вещества, изменяющие скорость проекания биохимических процессов в организме.
Вещества, подвергающиеся действию ферментов, называются субстратом.
Ферменты классифицируются на 6 классов, каждый класс еще делится на подклассы, подкласс – на подподклассы, внутри последних идет нумерация ферментов по списку.
Т.е. фермент пепсин 3.4.23.1 относится к классу гидролаз.
Оксидоредуктазы – регулируют окислительно-восстановительные реакции (альдегиддегидрогеназа, алкогольдегидрогеназа).
Трансферазы – регулируют перенос различных функциональных группировок атомов с одной молекулы субстрата на другую.
Гидролазы – ускоряют гидролиз химических связей (амилаза, пепсин)
Лиазы – распад связей без участия гидролиза, обратные реакции.
Изомеразы – образование геометрических, структурных изменений в молекулах субстрата, т.е. изомерных форм.
Лигазы (видел еще название Синтетазы) – отвечают за образование органических химических связей между атомами в субстрате.
Активность ферментов может ускоряться активаторами и замедляться ингибиторами.
Этот параметр является основным фактором саморегуляции обмена веществ в организме. Здесь часто действует обратная связь.
Активаторами могут быть ионы металлов, лекарства, различные соли и пр.
Ингибиторами то же самое, еще разные яды, токсины, отравляющие газы, блокирующие работу фермента частично или полностью, а также обратимо или необратимо.
Неорганические катализаторы – это в основном металлы, соли, а также значения давления и температуры.
Ферменты же – органические вещества, состоящие из “органических” элеметов: углерода, водорода, кислорода, азота, фосфора + опционально ионов металлов, других группировок атомов, модифицирующих их биологическую активность.
Что происходит с пищей под действием ферментов?
Хорошо разбираюсь в биологии, изучаю китайский язык, смотрю китайские…
Под действием ферментов пища и питательные вещества, поступаемые вместе с ней расщепляются на простые, легко усваемые организмом соединения. Пищеварительные ферменты синтезируются пищеварительными железами: слюнными железами, железами слизистой оболочки желудка, поджелудочной железой, железами тонкого кишечника.
Чем различаются витамины и ферменты что общего между ними?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Ферменты (биологические катализаторы) – это белки, в молекуле которых имеется активный центр. В этом центре происходит процесс катализа. Активный центр многих ферментов содержит витамин или получаемое из него вещество. То есть витамин – часть фермента и без витаминов ферменты не работают. По своему биологическому действию витамины близки к ферментам, но ферменты образуются клетками организма, а витамины обычно поступают с пищей.
Чем отличается симбиоз от синтеза?
Новоиспеченный врач-педиатр. Люблю путешествовать, музыку, кино, вкусно поесть…
Это просто разные понятия. Если по простому, симбиоз – взаимовыгодное сосуществование (например, бактерий кишечника человека и организма в целом: бактерии вырабатывают витамин К, необходимый для образования в печени витамин-К зависимых факторов свёртывания, необходимых организму для нормальной работы плазменного звена гемостаза, т.е остановки кровотечения; организм же в свою очередь обеспечивает их питание). А синтез, если в химическом/физическом/биологическом смысле, – это процесс создания более сложных веществ из простых. (например, скушали вы белковый продукт, белки в ЖКТ расщепились до аминокислот, которые из кишечника всосались в кровь. Она доставила эти аминокислоты в клетки органов и тканей, где из них произошел синтез собственных белков организма).
Какие бывают химические реакции?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Типы химической реакций????
✅Реакции соединения
А+В➡️АВ
Мg+Cl2➡️MgCl2
✅Реакции разложения :
АВ➡️А+В
Cu(OH)2➡️CuO+H2O
✅Реакции замещения:
АВ+С➡️СВ+А
CuCl2+2K➡️2KCl+Cu
✅Реакции обмена:
AB+CD➡️AD+СВ
Cu(OH)2+H2SO4➡️CuSO4+2H2O
Прочитать ещё 1 ответ
Источник
