Какие свойства характерны для серы

СЕРА.
Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы) , третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulphur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
~~~~~~~~~~~~~~~~~~~
Физические свойства.
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую) .
Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
~~~~~~~~~~~~~~~~~~~
Химические свойства.
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом. С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором.
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов.
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P2S5. Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием. При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды.
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов. Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору: Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании.
https://ru.wikipedia.org/wiki/Сера
Удачи Вам!
Источник
Сера,
её физические и химические свойства. Биологическое значение серы, её применение
(демеркуризация).СЕРА S
Cера в природе
Самородная сера
Сульфиды
PbS – свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и природном газе)
Белки
Сульфаты
CaSO4 * 2H2O – гипс
MgSO4 * 7H2O – горькая соль (английская)
Na2SO4 *10H2O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С.
Одно из особенных физических свойств серы – флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
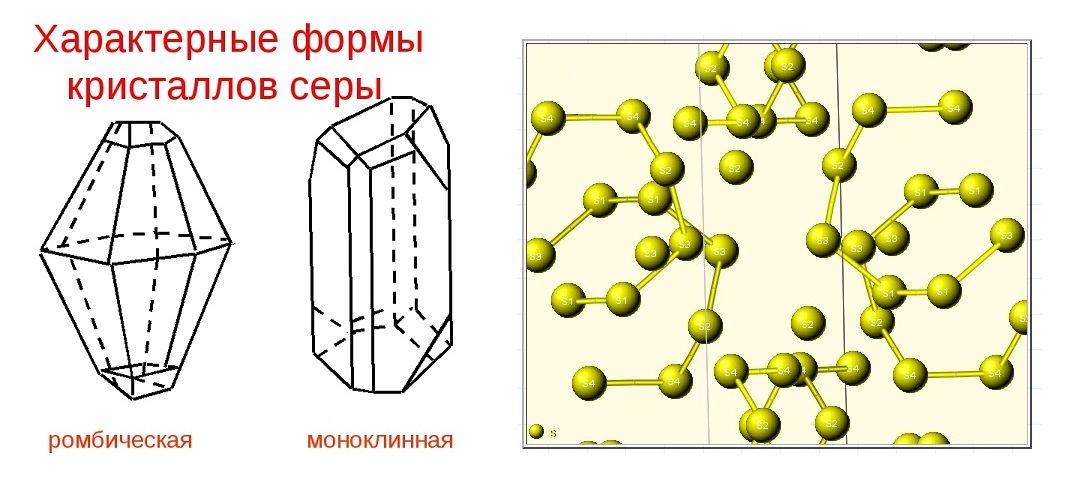
Аллотропия
Для серы характерны несколько аллотропных модификаций, но наиболее известные видоизменения: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая.
Ромбическая (a – сера) – S8
t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Моноклинная (b – сера) – S8
темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение электронов по уровням и подуровням
Основное состояние
1s22s22p63s23p4
Размещение электронов по
орбиталям (последний слой)Степень
окисленияВалентность
-2
В основном состоянии
II
+4
Первое возбуждённое состояние
IV
+6
Второе возбуждённое состояние
VI
Получение серы
1. Промышленный метод – выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства серы
Сера – окислитель S0 + 2ē→ S-2 | Сера – восстановитель: S – 4ē → S+4; S – 6ē →S+6 |
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания: 2Na + S → Na2S ОПЫТ S + Hg = HgS Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество. Этот процесс называется демеркуризацией 2. Взаимодействие серы c остальными металлами (кроме Au,Pt) при повышенной t°: 2Al + 3S t→ Al2S3 Zn + S t°→ ZnS ОПЫТ Cu + S t→ CuS ОПЫТ 3.Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений: H2 + S → H2S 2P + 3S→ P2S3 C + 2S → CS2 | 1. Взаимодействие серы c кислородом: S + O2 t°→ S+4O2 2S + 3O2 t°;pt→ 2S+6O3 2. Взаимодействие серы c галогенами (кроме йода): S + Cl2 → S+2Cl2 **Взаимодействие серы с кислотами – окислителями: S + 2H2SO4(конц) → 3S+4O2 + 2H2O S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O **Реакции диспропорционирования: 4. 3S0 + 6KOH→ K2S+4O3 + 2K2S-2 + 3H2O |
Тренажёр №1 – Характеристика серы по её положению в периодической системе Д. И. Менделеева
Тренажёр №2 – Химические свойства серы
Тренажёр №3 – Взаимодействие серы с металлами
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Дополнительные зхадания
Закончите уравнения реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
- S + O2
- S + Na
- S + H2
№2. Осуществите превращения по схеме:
Это интересно…
- Содержание серы в организме человека массой 70 кг – 140 г.
- В сутки человеку необходимо 1 г серы.
- Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
- Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Знаете ли вы..
- Соединения серы могут служить лекарственными препаратами;
- Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
- Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
- Железный купорос FeSO4×7H2O используют при анемии.
- BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
- Алюмокалиевые квасцы KAI(SO4)2×12H2O – кровоостанавливающее средство при порезах.
- Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р.Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
- Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
- Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник
СЕРА S


Cера в природе
Самородная сера
Украина,
Поволжье, Центральная Азия и др
Сульфиды
PbS – свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и
природном газе)
Белки
Волосы,
кожные покровы, ногти…
Сульфаты
CaSO4 x 2H2O – гипс
MgSO4 x 7H2O – горькая соль (английская)
Na2SO4 x 10H2O – глауберова соль (мирабилит)
Физические
свойства
Твердое
кристаллическое вещество желтого цвета, нерастворима в воде, водой не
смачивается (плавает на поверхности), t°кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:

Ромбическая (a – сера) – S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая | Моноклинная (b – сера) – S8 темно-желтые t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре | Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании |
|
| ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ |
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение
электронов по уровням и подуровням
Основное состояние 1s22s22p63s23p4 | ||
Размещение электронов по | Степень | Валентность |
+2, -2 | В основном состоянии II | |
+4 | Первое возбуждённое состояние IV | |
+6 | Второе возбуждённое состояние VI | |
Получение серы
1.
Промышленный метод – выплавление из руды с помощью водяного пара.
2.
Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2= 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства
серы
Сера – S0 + 2ē -> S-2 | Сера – восстановитель S – 2ē -> S+2; S – 4ē -> S+4; S – 6ē -> S+6 |
1) Сера реагирует со щелочными металлами 2Na + S -> Na2S ОПЫТ c остальными металлами (кроме Au, Pt) – при повышенной t°: 2Al + 3S –t°-> Al2S3 Zn + S –t°-> ZnS ОПЫТ Cu + S –t°-> CuS ОПЫТ 2) H2 + S -> H2S 2P + 3S -> P2S3 C + 2S -> CS2 | 1) S + O2 2S + 3O2 –t°;pt-> 2S+6O3 2) S + Cl2-> S+2Cl2 3) c кислотами – окислителями: S + 2H2SO4(конц) -> 3S+4O2 + 2H2O S + 6HNO3(конц) -> H2S+6O4 + 6NO2 Реакции 4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 + 3H2O |
Тренажёр
№1 – Характеристика серы по её положению в периодической системе Д. И.
Менделеева
Тренажёр №2 – Химические
свойства серы
Тренажёр
№3 – Взаимодействие серы с металлами
Применение
Вулканизация
каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями
сельского хозяйства, для медицинских целей (серные мази для лечения кожных
заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
ЗАДАНИЯ
№1. Закончите уравнения реакций:
S + O2
S + Na
S + H2
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =
Это интересно…
Содержание
серы в организме человека массой 70 кг – 140 г.
В
сутки человеку необходимо 1 г серы.
Серой
богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера
входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в
волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и
костей, выпадение волос.
Следите
за своим здоровьем!
Знаете ли вы…
·
Соединения
серы могут служить лекарственными препаратами
·
Сера
– основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой.
Тиосульфат натрия Na2S2O3 используется
для борьбы с нею
·
Многие
соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O.
Их применяют как антисептические средства для опрыскивания растений и
протравливания зерна в борьбе с вредителями сельского хозяйства
·
Железный
купорос FeSO4×7H2O используют при анемии
·
BaSO4 применяют
при рентгенографическом исследовании желудка и кишечника
·
Алюмокалиевые
квасцы KAI(SO4) 2×12H2O –
кровоостанавливающее средство при порезах
·
Минерал Na2SO4×10H2O носит
название «глауберова соль» в честь открывшего его в VIII веке
немецкого химика Глаубера И.Р. Глаубер во время своего
путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался
принимать пищу. Один из местных жителей направил его к источнику. Как только он
выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту
воду, из нее выкристаллизовалась соль Na2SO4×10H2O.
Сейчас ее применяют как слабительное в медицине, при окраске хлопчато-
бумажных тканей. Соль также находит применение в производстве стекла
·
Тысячелистник
обладает повышенной способностью извлекать из почвы серу и стимулировать
поглощение этого элемента с соседними растениями
·
Чеснок
выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает
раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА

Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.07 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | mmm (2/m 2/m 2/m) — ромбо-дипирамидальный |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10.468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
mineralpro.ru
28.07.2016
Источник


