Какие свойства ионной отличают от ковалентной

Разница Между 2020
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая
Содержание:
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого.
Чтобы создать молекулы или соединения, атомы образуют связи друг с другом. Связь – это химический процесс, возникающий из-за притяжения между двумя или более атомами. На самом деле химическая связь вызвана электростатической силой притяжения между противоположными зарядами, либо между электронами и ядрами, либо в результате дипольного притяжения. Прочность этих химических связей можно слабо классифицировать как «сильные связи» или «слабые связи». Двумя распространенными примерами «сильных связей» являются ионные и ковалентные связи.
Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Следовательно, оба атома становятся ионами, так как у одного атома на один электрон меньше, а у другого – дополнительный. Ион металла, потерявший электрон, имеет положительный заряд. Неметаллический ион, получивший электрон, имеет отрицательный заряд. Когда противоположности притягиваются, эти ионы сильно притягиваются друг к другу настолько сильно, что становятся связанными.
Ионные соединения обычно находятся в форме твердых веществ, то есть солей. Они хорошо растворимы в воде и имеют высокую температуру плавления. Когда они находятся в воде, они также имеют высокую электрическую проводимость.
Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого. Ковалентная связь – это устойчивый баланс сил притяжения и отталкивания между двумя атомами, когда они делят электрон. Ковалентные связи могут быть далее классифицированы на одинарные, двойные и тройные ковалентные связи, в зависимости от того, сколько электронов является общим. Каждый общий электрон образует одну связь.
Ковалентная связь включает в себя множество видов взаимодействия, включая σ-связь, π-связь, связь металл-металл, агостические взаимодействия и трехцентровые двухэлектронные связи. Когда у атома есть электрон во внешней оболочке, а другим атомам требуется, чтобы электрон заполнил его внешнюю оболочку, два атома соединяются, чтобы разделить электрон. Следовательно, оба атома имеют полную внешнюю оболочку и, соответственно, стабильную электронную конфигурацию.
Химические связи сделаны так, что атом может иметь полную внешнюю оболочку, поскольку полная внешняя оболочка означает стабильную электронную конфигурацию. В ионной связи, когда атом металла имеет один электрон в своей внешней оболочке, а неметаллу нужен электрон для завершения своей внешней оболочки, атом металла отдает свой электрон неметаллу. Аналогично, в ковалентной связи они одинаково делят электрон.
Ионная связь | Ковалентная связь | |
Определение | Химическая связь между двумя разнородными атомами, в которой атом отдает электрон другому. | Ковалентная связь представляет собой химическую связь, которая включает в себя обмен электронами между двумя одинаковыми атомами. |
Вхождение | Металл и неметалл | Два неметалла |
полярность | Высоко | Низкий |
Форма молекулы | Нет определенной формы, решетчатые структуры | Определенная форма |
Электрическая проводимость | Высоко | Обычно нет |
Теплопроводность | Высоко | Обычно низкий |
Температура плавления вещества | Зависит, но обычно выше, чем ковалентные соединения | Зависит, но обычно ниже, чем ионные соединения |
Точка кипения вещества | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Растворимость в воде | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Состояние вещества при комнатной температуре | Обычно твердый | Твердый, жидкий, газ |
Источник
Определение 1
При изучении строения молекулы появляется вопрос о природе сил, которые обеспечивают связь между нейтральными атомами, входящими в их состав. Такие связи между атомами в молекуле получили название химической связи.
Классифицируют на два типа:
- ионная связь;
- ковалентная связь.
Деление производится условно. Большинство случаев характеризуется наличием черт обоих типов связей. При помощи детальных и эмпирических исследований можно установить в каждом случае соотношение между степенью «ионности» и «ковалентности» связи.
Опытным путем доказали, что при разъединении молекулы на составные (атомы) необходимо совершить работу. То есть процесс ее образования должен сопровождаться выделением энергии. Если два атома водорода пребывают в свободном состоянии, то имеют большую энергию по сравнению с атомами в двухатомной молекуле H2. Выделяемая при образовании молекулы энергия считается мерой работы сил взаимодействия, связывающих атомы в молекулу.
Опыты доказывают, что появление силы взаимодействия между атомами идет вследствие наличия внешних валентных электронов атомов. Это возможно благодаря резкому изменению оптического спектра атомов, вступающих в химические реакции при сохранении без изменения рентгеновского характеристического спектра атомов, независимо от типа химического соединения.
Линейчатые оптические спектры определены состоянием валентных электронов, а характеристическое рентгеновское излучение определено при помощи внутренних электронов, то есть их состояния. Химические взаимодействия включают в себя участие электронов, требующих небольшую энергию для прохождения их изменений. Этой функцией обладают внешние электроны. Они отличаются меньшим потенциалом ионизации по сравнению с электронами внутренних оболочек.
Ионная связь
Существует предположение о природе химической связи атомов в молекуле, которое говорит о появлении силы взаимодействия электрической природы между внешними электронами. Для выполнения условия устойчивости должны существовать два взаимодействующих атома с электрическими зарядами противоположного знака. Тип химической связи может быть реализован только в части молекул. После взаимодействия атомов происходит превращение в ионы. Когда атом присоединяет один или несколько электронов, тогда становится отрицательным ионом, а другой – положительным ионом.
Ионная связь похожа на силы притяжения между зарядами с противоположными знаками. Если положительно заряженный ион натрия Na+ будет притянут к отрицательному хлору Cl-, то получим молекулу NaCl, которая служит явным примером ионной связи.
Определение 2
Иначе говоря, ионная химическая связь называется гетерополярной (гетеро – разный). Молекулы и ионными типами связи – ионные или гетерополярные молекулы.
Понятие ионной связи не дает возможности разъяснить строения и структуры всех молекул. Необъяснимо, почему может образоваться молекула из двух нейтральных атомов водорода. По причине одинаковой полярности атомов водорода недопустимо считать, что один из ионов водорода с положительным зарядом, другой – с отрицательным. Связь, имеющаяся у атомов водорода (между нейтральными атомами), объясняется только квантовой механикой. Она получила название ковалентной.
Ковалентная связь
Определение 3
Химическая связь, осуществляемая между нейтральными атомами в молекуле, называется ковалентной или гомеополярной (гомео – одинаковый). Образованные на основании таких связей молекулы называют гомеополярными или атомными.
Классическая физика рассматривает только один тип взаимодействия, где возможна ее реализация между двумя телами, – гравитация. Так как гравитационные силы малы, то с их помощью сложно объяснить взаимодействие в гомеополярной молекуле.
Ковалентная связь заключается в пребывании в определенном квантовом состоянии с определенной энергией электрона в поле ядра. Если расстояния между ядрами изменяются, то это отражается на состоянии движения электрона и его энергии. При уменьшении энергии между атомами происходит увеличение энергии взаимодействия между ядрами, объясняемое действием силы отталкивания.
Когда происходит уменьшение энергии электрона при уменьшении расстояния быстрее, чем рост энергии взаимодействия ядер, тогда значение совокупной энергии системы значительно уменьшается. Это объясняется действием сил, стремящихся уменьшить расстояние между ядрами, в системе, составленной из двух отталкивающихся ядер и электрона. Имеющиеся силы притяжения участвуют в порождении ковалентной связи молекулы. Их появление спровоцировано наличием общего электрона, иначе говоря, благодаря электронному обмену между атомами, значит, считаются обменными квантовыми силами.
Ковалентная связь обладает свойством насыщения. Его проявление возможно благодаря определенной валентности атомов. То есть атом водорода связывается с одним атомом водорода, а атом углерода с количеством не более 4 атомов водорода.
Предложенная связь способствует объяснению валентности атомов, которое не получила его в классической физике. То есть свойство насыщения непонятно с точки зрения природы взаимодействия в классической теории.
Присутствие ковалентной связи наблюдается не только в двухатомных молекулах. Она свойственна для большого числа молекул неорганических соединений (окись азота, аммиак и другие).
В 1927 году была создана количественная теория ковалентной связи для молекулы водорода В. Гайтлером и Ф. Лондоном, основываясь на понятиях квантовой механики. Они доказали причину, вызывающую появление молекулы с ковалентной связью, а именно: квантовомеханический эффект, связанный с неразличимостью электронов. Определение основной энергии связи происходит при наличии обменного интеграла. Суммарный спин молекулы водорода равняется 0, в ней отсутствует орбитальный момент, поэтому она диамагнитна. При столкновении двух атомов водорода молекула появляется только при параллельности спинов обоих электронов. Это условие способствует отталкиванию атомов водорода, то есть молекулы не смогут образоваться.
При соединении двух одинаковых атомов ковалентной связью расположение электронного облака в молекуле становится симметричным. Если связь объединяет два разных атома, то электронное облако располагается асимметрично. Молекула с асимметричным распределением электронного облака обладает постоянным дипольным моментом, то есть полярна. Когда вероятность локализации электрона около одного из атомов преобладает над вероятностью нахождения этого электрона около другого атома, происходит переход от ковалентной связи к ионной. Четкой границы между ионной и ковалентной связи нет.
Пример 1
Произвести описание состояния при сближении двух атомов.
Решение
Когда расстояние между двумя атомами уменьшают, то возможно появление нескольких ситуаций:
- Одна пара электронов или более становятся общими для рассматриваемых атомов. Они могут перемещаться между атомами и находятся там дольше, чем в других местах. Это способствует созданию силы притяжения.
- Возникновение ионной связи. Один или более электронов способны переходить к другому. То есть это способствует появлению притягивающихся положительного и отрицательного ионов.
- Отсутствие возникновения связи. Электронные структуры двух атомов перекрываются и составляют единую систему. По принципу Паули такая система является неподходящей только для квантового состояния двух электронов. При переходе на более высокий энергоуровень система получит больше энергии, что приведет к нестабильности. Даже при соответствии принципу Паули без увеличения энергии системы появится электрическая сила отталкивания между разными электронами. По условию оказывается намного меньше влияния на создание связи, чем с принципом Паули.
Пример 2
Энергия ионизации (потенциал ионизации) элемента – это энергия, необходимая для вырывания электрона из одного атома. Ее считают мерой силы связи внешнего электрона или электронов. Объяснить, почему энергия ионизации лития больше, чем натрия, натрия больше, чем калия, калия больше, чем рубидия.
Решение
Все выше перечисленные элементы обладают свойствами щелочных металлов и относятся к первой группе. Любой их атом обладает единственным внешним электроном в s-состоянии. Электроны внутренних оболочек частично экранируют внешний электрон от ядерного заряда +Zqe в качестве следствия эффективного заряда, удерживающего внешний электрон, равняется +qe. Чтобы вырвать из такого атома внешний электрон, следует совершить работу с превращением атомов щелочных металлов в положительные ионы. Чем больше размер атома, тем больше расстояние валентного электрона от ядра, но меньше сила его притягивания. Данная группа характеризуется убыванием энергии ионизации сверху вниз по периодической системе Менделеева. Ее рост в каждом периоде слева направо связан с увеличением заряда и постоянным количеством внутренних экранирующих электронов.
Источник
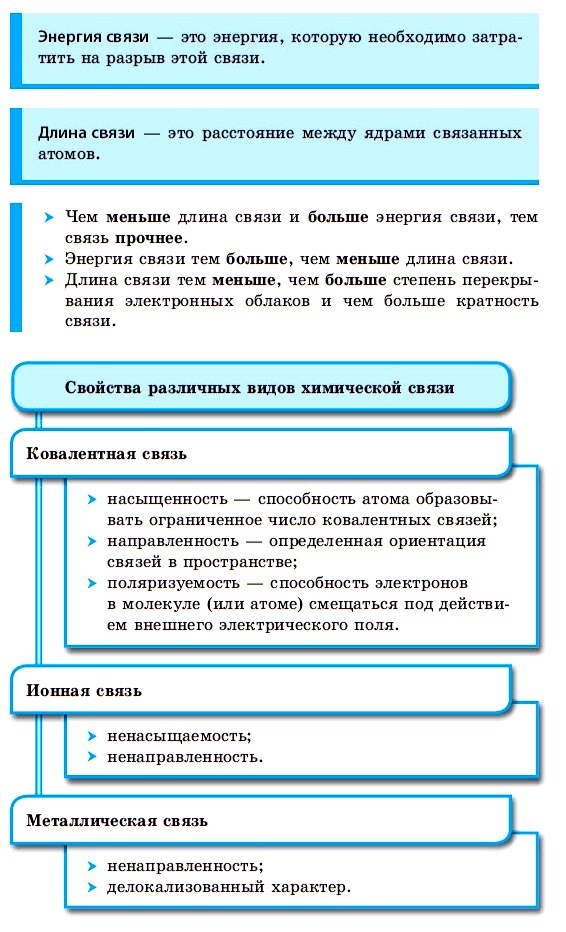
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
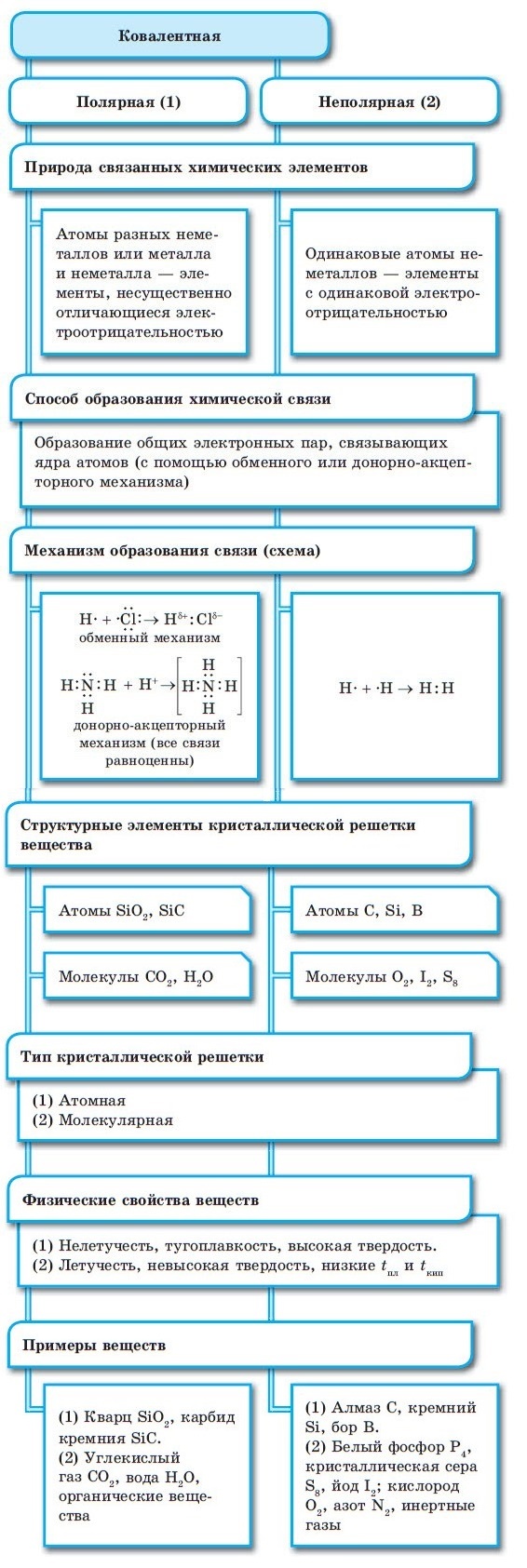
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s1. Ее графический вариант: ![]()
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s22s22p63s23p5. Графическая формула:
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:![]()
Электронная формула атома азота: 1s22s22p3. Графическая формула:

На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:![]()
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10–9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н+0,18 и Cl–0,18; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:![]()
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:![]()
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl– , Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
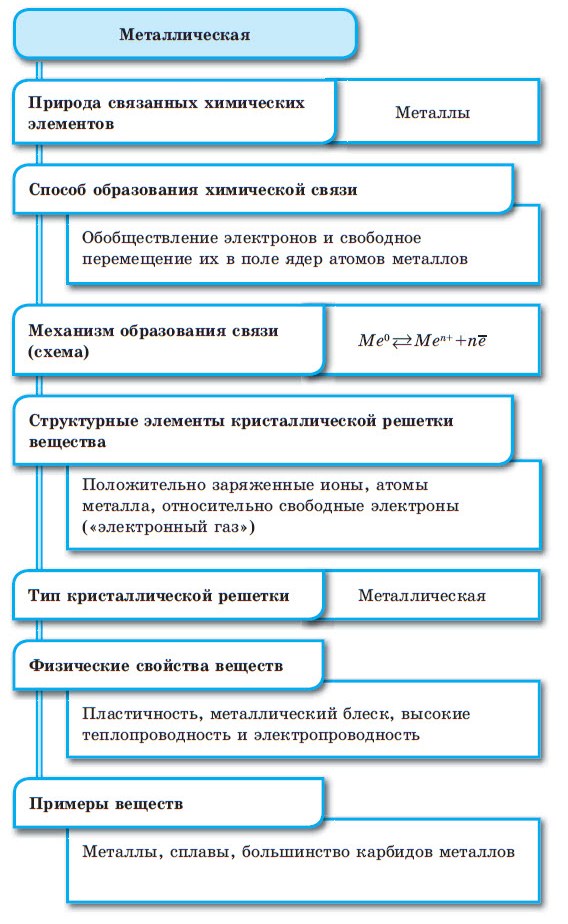
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Следующая тема: «Валентность химических элементов».
Источник
