Какие свойства элементов называют электроотрицательностью

Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна (0,7), а ЭО фтора — (4). ЭО остальных элементов изменяются в пределах от (0,7) до (4).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к (2), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к (3)–(4), у вторых — к (1).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;
— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна (3), а электроотрицательность серы — (2,5). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна (3,5), а электроотрицательность серы — (2,5). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 71с
Жилин Д. М. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Бином. Лаборатория знаний, 2011. — 245с.
Источник
Одно из основополагающих понятий в химии – электроотрицательность.
Электроотрицательность – это свойство атома притягивать к себе общие электронные пары, образующиеся химическую связь.
Можно говорить также, что электроотрицательность – способность атома притягивать к себе электроны других атомов при образовании химической связи. Существуют количественные характеристики электроотрицательности, но в курсе неорганической химии 8 класса они не изучаются. Нам будет достаточно качественного определения этого понятия.
Фото: fineartamerica.com
В первую очередь надо запомнить следующее:
электроотрицательность растёт при движении по периоду таблицы Менделеева слева направо и падает при движении по группе сверху вниз.
Инертные газы (элементы VIII группы) имеют завершённый внешний электронный слой, поэтому понятие электроотрицательности к ним неприменимо, их мы в расчёт брать не будем. А теперь давайте сразу рассмотрим примеры, чтобы наглядно это увидеть. Взгляните на второй период таблицы Менделеева, он выглядит так:
Так вот при движении от лития к фтору электроотрицательность растёт, то есть минимальная электроотрицательноть будет во втором периоде у лития, максимальная – у фтора. Аналогичная ситуация наблюдается во всех периода: в начале стоят элементы с низкой электроотрицательностью, в конце – с высокой.
Теперь взглянем на первую группу:
При движении сверху вниз электроотрицательность падает, то есть теперь у лития будет максимальная электроотрицательность, а у франция – минимальная. Точно так же происходит и в других группах: чем выше элемент, тем выше электроотрицательность.
Таким образом,
элементы с максимальной электроотрицательностью сосредоточены в правом верхнем углу таблицы, с минимальной – в левом нижнем.
Также можно говорить, что неметаллы имеют высокую электроотрицательность, а металлы – низкую.
Зачем нужна электроотрицательность
Этот вопрос логичен, ведь мы уже столько поговорили об этом понятии, но так и не применили его на практике. Согласно определению,
электроотрицательность – это способность атома притягивать электронную пару.
Атомы с высокой электроотрицательностью будут сильно притягивать электронные пары, атомы с низкой электроотрицательностью будут пары отдавать. Чтобы это понять, рассмотрим ещё несколько примеров.
В хлориде натрия NaCl атом хлора будет притягивать электронную пару, а атом натрия отдавать (посмотрите в таблицу Менделеева и убедитесь, что хлор стоит сильно правее натрия). Кроме того, выше говорилось, что атомы металлов отдают электроны, а атомы неметаллов – притягивают их, именно это мы здесь и наблюдаем: натрий – металл, он имеет низкую электроотрицательность и отдаёт электроны, а атом хлор – неметалл, он имеет высокую электроотрицательность и притягивает электроны.
Ещё один пример – оксид азота (II) NO. Здесь два неметалла, но у кислорода электроотрицательность значительно выше (обратитесь к таблице и посмотрите на положение этих элементов). То есть в этом соединении отдавать электроны будет азот, а притягивать их будет кислород.
Понятие электроотрицательности нельзя игнорировать, с ним непременно нужно разобраться, поскольку оно необходимо для понимания образования химической связи.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.

Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.

Рис. 1. Действия окислителя и восстановителя в реакциях.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента | Элемент | Символ | Электроотрицательность |
87 | Франций | Fr | 0,79 |
55 | Цезий | Cs | 0,79 |
19 | Калий | K | 0,82 |
37 | Рубидий | Rb | 0,82 |
56 | Барий | Ba | 0,89 |
88 | Радий | Ra | 0,9 |
11 | Натрий | Na | 0,93 |
38 | Стронций | Sr | 0,95 |
3 | Литий | Li | 0,98 |
20 | Кальций | Ca | 1,0 |
57 | Лантан | La | 1,1 |
89 | Актиний | Ac | 1,1 |
70 | Иттербий | Yb | 1,1 |
58 | Церий | Ce | 1,12 |
59 | Празеодим | Pr | 1,13 |
61 | Прометей | Pm | 1,13 |
95 | Америций | Am | 1,13 |
60 | Неодим | Nd | 1,14 |
62 | Самарий | Sm | 1,17 |
64 | Гадолиний | Gd | 1,2 |
66 | Диспрозий | Dy | 1,22 |
39 | Иттрий | Y | 1,22 |
68 | Эрбий | Er | 1,24 |
69 | Тулий | Tm | 1,25 |
71 | Лютеций | Lu | 1,27 |
96 | Кюрий | Cm | 1,28 |
94 | Плутоний | Pu | 1,28 |
90 | Торий | Th | 1,3 |
97 | Берклий | Bk | 1,3 |
98 | Калифорний | Cf | 1,3 |
99 | Эйнштейний | Es | 1,3 |
100 | Фермий | Fm | 1,3 |
101 | Менделевий | Md | 1,3 |
102 | Нобелий | No | 1,3 |
12 | Магний | Mg | 1,31 |
40 | Цирконий | Zr | 1,33 |
93 | Нептуний | Np | 1,36 |
21 | Скандий | Sc | 1,36 |
92 | Уран | U | 1,38 |
73 | Тантал | Ta | 1,5 |
91 | Протактиний | Pa | 1,5 |
22 | Титан | Ti | 1,54 |
25 | Марганец | Mn | 1,55 |
4 | Бериллий | Be | 1,57 |
41 | Ниобий | Nb | 1,6 |
13 | Алюминий | Al | 1,61 |
81 | Талий | Tl | 1,62 |
30 | Цинк | Zn | 1,65 |
23 | Ванадий | V | 1,63 |
24 | Хром | Cr | 1,66 |
48 | Кадмий | Cd | 1,69 |
49 | Индий | In | 1,78 |
31 | Галлий | Ga | 1,81 |
26 | Железо | Fe | 1,83 |
82 | Свинец | Pb | 1,87 |
27 | Кобальт | Co | 1,88 |
29 | Медь | Cu | 1,9 |
75 | Рений | Re | 1,9 |
14 | Кремний | Si | 1,9 |
43 | Технеций | Tc | 1,9 |
28 | Никель | Ni | 1,91 |
47 | Серебро | Ag | 1,93 |
50 | Олово | Sn | 1,96 |
80 | Ртуть | Hg | 2 |
84 | Полоний | Po | 2 |
83 | Висмут | Bi | 2,02 |
5 | Бор | B | 2,04 |
51 | Сурьма | Sb | 2,05 |
42 | Молибден | Mo | 2,16 |
33 | Мышьяк | As | 2,18 |
15 | Фосфор | P | 2,19 |
1 | Водород | H | 2,2 |
77 | Иридий | Ir | 2,2 |
86 | Радон | Rn | 2,2 |
85 | Астат | At | 2,2 |
44 | Рутений | Ru | 2,2 |
46 | Палладий | Pd | 2,2 |
76 | Осмий | Os | 2,2 |
78 | Платина | Pt | 2,28 |
45 | Родий | Rh | 2,28 |
74 | Вольфрам | W | 2,36 |
79 | Золото | Au | 2,54 |
6 | Углерод | C | 2,55 |
34 | Селен | Se | 2,55 |
16 | Сера | S | 2,58 |
54 | Ксенон | Xe | 2,6 |
53 | Йод | I | 2,66 |
36 | Криптон | Kr | 2,96 |
7 | Азот | N | 3,04 |
17 | Хлор | Cl | 3,16 |
8 | Кислород | O | 3,44 |
9 | Фтор | F | 3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Рис. 2. Ряд электроотрицательности.
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
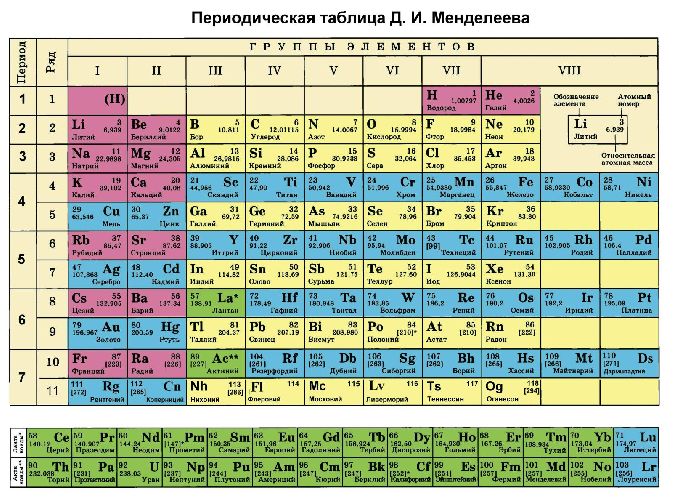
Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 208.
Источник
Электроотрицательность химических элементов. Химическая связь
I. Электроотрицательность
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом.
Значения относительной электроотрицательности элементов представлены в таблице:
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1).
Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо), в каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз).
Элемент фтор F обладает наивысшей, а элемент цезий Cs – наименьшей электроотрицательностью среди элементов 1-6 периодов.
II. Химическая связь
В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом.
Образование химических связей между атомами – естественный, самопроизвольный процесс, так как при этом происходит понижение энергии молекулярной системы, т.е. энергия молекулярной системы меньше суммарной энергии изолированных атомов. Это движущая сила образования химической связи.
Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие.
В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны. Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна.
s, p – элементы | d – элементы |
Валентыми являются электроны внешнего уровня Например, Н +1)1e 1s1 – внешний уровень не завершён – 1 валентный электрон O +8 )2e)6e 1s22s22p4 – внешний уровень не завершён – 6 валентных электронов | Валентыми являются электроны внешнего уровня и d – электроны предвнешнего уровня Например, Cr +24)2e)8e)8e+5e)1e – 6 валентных электронов (5е+1е) |
Химическая связь – это взаимодействие атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень.
III. Классификация химических связей
1. По механизму образования химической связи
а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:
б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь.
Например, образование иона аммония (NH4)+ (заряженная частица):
2. По способу перекрывания электронных орбиталей
а) σ – связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов.
Например,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π – связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов.
3. По способу достижения завершенной электронной оболочки
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько.
Признак сравнения | Ковалентная | Ионная | Металлическая | |
неполярная | полярная | |||
Как достигается завершенная электронная оболочка ? | Обобществление электронов | Обобществление электронов | Полная передача электронов, образование ионов (заряженных частиц). | Обобществление электронов всеми атомами в крист. решетке |
Какие атомы участвуют? | немет – немет ЭО = ЭО | 1) Немет-Немет1 2)Мет–немет ЭО < ЭО | мет +[немет]- ЭО << ЭО | В узлах находятся катионы и атомы металла. Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны. |
∆c= ЭО1 – ЭО2 | < 1,7 | > 1,7 | ||
Примеры | простые вещества – неметаллы. | кислоты, оксиды | соли, щелочи, оксиды щелочных металлов. | простые вещества – металлы. Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. |
IV. Задания для закрепления
Задание №1. Определите виды химических связей в молекулах следующих веществ:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Задание №2. Напишите механизм образования молекул H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2. В случае ковалентной связи определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный)
Тренажер
Тренажер “Электроотрицательность”
Источник
Статьи
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Между атомами в молекуле образуется определенная химическая связь, которую в современном научном мире описывает квантовая механика. Заряженные частицы в атоме взаимодействуют между собой, обеспечивая молекуле определенную устойчивость.
09 августа 2019
В зависимости от расстояния между атомами, полярности и прочности, химическая связь между атомами может быть:
- ковалентная полярная,
- ковалентная неполярная,
- ионная,
- металлическая.
В 1932 году ученый-химик американского происхождения Лайнус Карл Поллинг ввел термин электроотрицательность. С помощью термохимических данных он определил, что энергия гетероядерной связи практически всегда больше, чем энергия гомоядерной связи.
Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.
Купить
Приняв значение электроотрицательности водорода равной 2.1 произвольно и используя известные термодинамические данные, сравнивая электроотрицательность элементов с водородом, Поллинг составил первую шкалу относительных атомных электроотрицательностей.
Необходимо помнить, что электроотрицательность — величина не постоянная, а относительная, и позволяет лишь определить, в сторону какого элемента сдвигается общая электронная пара.
Помимо шкалы Поллинга, что изучают в школьном курсе химии, и которую можно найти на странице 276 учебника «Химия 8 класс» под редакцией В.В.Еремина, в мире существует около двадцати шкал определения электроотрицательности.
Наиболее известные:
- Шкала Малликена. Она учитывает энергию, необходимую для превращения атома в ион или энергию ионизации, и количество энергии, выделяющееся при соединении электрона с атомом, или сродство к электрону.
- Шкала Олреда-Рохова. Построена с учетом силы электростатического взаимодействия, которая действует на электрон на наружном энергетическом уровне.
Таблица электроотрицательности Поллинга — справочный материал, и не всегда есть под рукой. Однако существуют общие закономерности электроотрицательности, и, зная расположение элемента в Периодической системе Д.И.Менделеева, можно косвенно оценить, в сторону какого из элементов в молекуле будет сдвигаться общая электронная пара.
Электроотрицательность химических элементов, расположенных правее, больше, чем у элементов, расположенных левее в одном периоде. Электроотрицательность элементов, расположенных выше, больше, чем у элементов, расположенных ниже в одной группе. Исходя из этих данных, самый высокий показатель у элементов, расположенных в правом верхнем углу, и самый низкий у элементов внизу слева.
По этим данным был составлен ряд электроотрицательности, в котором химические элементы расположены в порядке убывания ее величины: F, O, N, Cl, Br, S, C, P, H, Si, Mg, Li, Na.
Если таблица Поллинга под рукой, с помощью несложных арифметических действий можно определить тип связи в молекуле. Для этого нужно найти относительную электроотрицательность атомов, входящих в молекулу по таблице, и из большего значения вычесть меньшее, а по результату оценить связь.

Химия. 9 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.
Купить
Разность значений равна 0,5 или меньше — сила притяжения у атомов практически равна, электронное облако находится примерно посередине расстояния между атомами веществ, а связь является ковалентной неполярной. Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены.
Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд. Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь. Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения.
Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше. Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0. Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная.
#ADVERTISING_INSERT#
Источник
