Какие свойства металлов обусловлены типом связи
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов – металлическую, ионную и водородную, свойственную кристаллам льда.
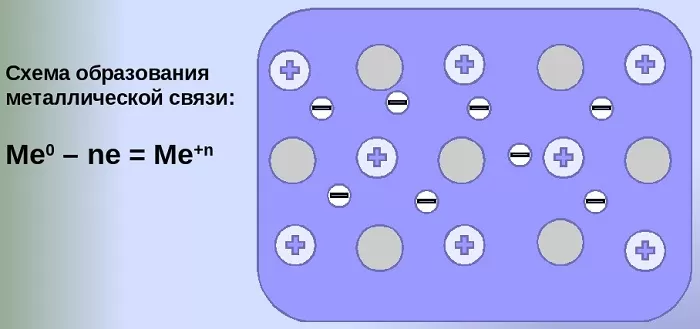
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me – ne⁻ ⇆ Me,
здесь n – число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения – атом металла, отдающий электроны, в правой – образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K – e⁻ ⇆ K;
- Cu – 2e⁻ ⇆ Cu;
- Al – 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки

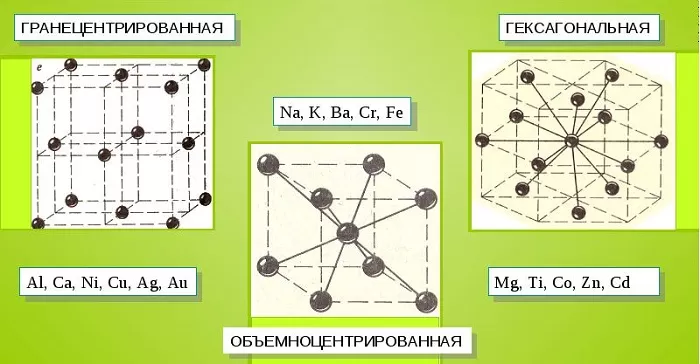
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni – в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность – большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
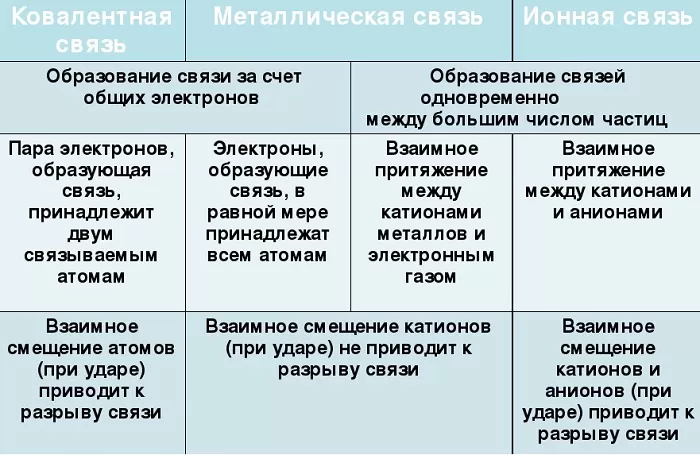
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью – поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Источник
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Источник
Готовлю к ЕГЭ и ОГЭ по химии с душой и на результат
Мой инстаграм @chemyblog
В металлах связь металлическая ???? атомы металлов образуют кристаллическую решетку, между атомами постоянно перемещаются свободные электроны. Благодаря этому металлы проводят электрический ток. Ток – направленное движение заряженных частиц. Подключаем металл к электрической цепи – электроны начинают двигаться направленно – идёт ток. Плюс металлы… Читать далее
Что применяется для получения металлов?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Так как металлы в земной коре встречаются преимущественно в виде соединений в различных минералах (как правило: оксидов, гидроксидов, солей и т.д..), а в самородном состоянии могут находиться лишь неактивные металлы (такие как: медь, золото, серебро, платиновые металлы, ртуть). Поэтому металлы в основном получают из руд с помощью металлургических процессов. Любой металлургический процесс – это процесс восстановления металла с помощью различных восстановителей. Он состоит из трех основных этапов: обогащение руды, восстановление металлов из их соединений, очистка технических металлов.
Восстановительные процессы способов получения металлов делятся на следующие:
Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, алюминия, магния и др.
Гидрометаллургия – восстановление металлов из солей в растворе.
Электрометаллургия – восстановление металлов в процессе электролиза растворов и расплавов солей.
Какие металлы принято называть активными?
Увлекаюсь всем на свете: от моды до путешествий. Работаю помощником главного…
Активные металлы отличаются мягкостью, легкостью и невысокой температурой плавления. Как правило, у активных металлов 1-2 валентных электрона, находящихся на достаточном удалении от ядра. Наиболее активными считаются литий, натрий, калий, цезий, рубидий.
Степень активности металла можно посмотреть в электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен.
Какие есть простые вещества в металлах?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Не верно поставлен вопрос. Металл – это и есть конкретное вещество (например Fe (железо); Cu (медь); Al (алюминий) и т.д.. Возможно Вы имели в виду стали? Если да, то сталь состоит из железа, углерода и легирующих элементов (никеля, марганца, меди и т.д.), также в сталях есть в небольшом количестве различные примеси, ухудшающие их качество: сера и фосфор. А металлы не состоят из веществ, металлы, как и другие вещества состоят из атомов.
Могут ли или существуют ли вещества во Вселенной, которых нет в таблице Менделеева?
ALBA synchrotron, postdoc
Безусловно. Потому что в таблице Менделеева вообще нет веществ, там только элементы.
Могут ли быть элементы, которых нет в таблице Менделеева? Тоже да. Можно делать атомы не только из протонов, нейтронов и электронов. Есть позитроний, есть мюоний, есть мюонные атомы. Для них в принципе нет места в таблице, но их умеют делать и даже заставлять вступать в реакции.
Далее, по сути, любая нейтронная звезда – это огромное атомное ядро, при желании можно прикинуть количество оставшихся в живых после коллапса протонов и выдать получившемуся атому полагающееся ему место в периодической системе.
Прочитать ещё 2 ответа
Источник
Атомы в молекуле удерживаются посредством химической связи. Если молекула состоит из разных атомов (KF, Na2S, CO2, H2O), то речь идёт о ковалентной полярной (случай, когда в молекулу входят атомы неметаллов) или ионной связи (случай, когда молекула состоит из атома металла и атома неметалла). Если мы имеем дело с молекулой, состоящей из атомов неметалла одного вида (О2, N2, Br2), то в этом случае имеет место ковалентная неполярная связь. А как же связаны атомы в металлах, например, в натрии Na, кальции Са или алюминии Al?
Фото: livemaster.ru
Металлическая связь
Составляющие металл атомы удерживаются в единой структуре посредством химической связи. Не будь её, не существовало бы кристаллов. И эта связь носит название металлическая.
Металлическая связь – это связь, возникающая в результате обобществления электронов, находящихся на внешних электронных слоях атомов.
Чтобы понять это довольно сложно определение, посмотрим пример. Но для начала вспомним, как построены атомы металлов. В таблице Менделеева элементы-металлы располагаются в левом нижнем углу (мы говорим о главных подгруппах). У атомов металлов на внешнем электронном слое мало электронов. Кроме того, чем ниже мы опускаемся по группе в периодической таблице, тем больше становится радиус атома. Это означает, что на внешний слой всё дальше от ядра (напомню, что ядро атома имеет положительный заряд). Из-за этого электроны на внешнем уровне все меньше притягиваются к ядру. Малое число электронов и их удалённость от ядра позволяют им с лёгкостью отрываться от атома. При этом, как вы помните, атом превращается в ион, в данном случае в катион:
Me – 1e- → Me+1
Здесь Me – произвольный металл, с одним электроном на внешнем электронном уровне. В случае, если на внешнем электронном уровне несколько электронов, схема выглядит так:
Me – ne- → Me+n
Здесь n – число валентных электронов. Например, для кальция, стоящего во второй группе таблицы Менделеева и имеющего 2 электрона не внешнем уровне, схема такова:
Са – 2e- → Са+2
Для алюминия, стоящего в третьей и группе и имеющего 3 электрона на внешнем уровне, мы можем записать такую схему:
Al – 3e- → Al+3
Тут уместно задаться вопросом, а куда же деваются эти самые оторвавшиеся от атомов электроны? Они никуда не исчезают, а просто перемещаются от одного атома к другому. «Найдя» катион, электрон просто временно присоединяется к нему, чтобы тут же оторваться и отправиться в новое путешествие между атомами в поисках нового катиона. Фактически образуется эдакая динамическая система, в которой есть атомы и катионы металлов и курсирующие между ними электроны, которые то и дело присоединяются и отрываются, превращая катионы в атомы и атомы в катионы:
Me – ne- ⇄ Me+n
За счёт чего удерживается эта структура? За счёт электростатического взаимодействия, то есть притяжения отрицательно и положительно заряженных частиц.
Чтобы представить себе это более чётко, вообразите структуру из катионов, которая погружена в своеобразный «газ» из электронов. Это и есть металлическая связь. Подобным образом построены все металлы и их сплавы, когда они находятся в твёрдом или расплавленном состоянии.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Цель: Опираясь на ранее полученные знания, подвести обучающихся к
пониманию представлений о металлах как химических элементах и простых веществах.
Образовательные задачи:
1) Познакомить обучающихся со строением и общими свойствами металлов, исходя
из их положения в периодической системе и строения атомов.
2) Дать понятие о металлической связи и металлической кристаллической решетке.
Добавить, обобщить и углубить знания о физических
свойствах металлов.
Воспитательные задачи:
1) Расширить и углубить знания учащихся о роли металлов в организме, значении
в жизнедеятельности человека, показать разнообразие их свойств.
2) Продолжить формирование мировоззренческих взглядов (умения устанавливать
причинно-следственные связи между строением и
свойствами металлов, доказывать переход количественных изменений в
качественные).
3) Акцентировать внимание обучающихся на возможности интеграции курсов химии,
литературы и истории, развивать представления о познаваемости мира.
4) Прививать навыки самостоятельной работы, учить четко и грамотно выражать свои
мысли. Уметь слушать своего товарища.
Развивающие задачи:
1) Научить работать с дополнительной литературой и другими источниками
информации, готовить доклады,
2) Выступать перед аудиторией,
3) Формировать критическое мышление, умение анализировать, выделять главное,
обобщать и делать выводы.
Тип урока: Урок усвоения новых знаний с мультимедийным сопровождением.
Оборудование. Компьютер, проектор, экран; учебная презентация по данной
теме, выполненная на компьютере в программе Power Point, созданная учителем,
коллекции “Металлы и сплавы”; шаростержневые модели кристаллической решетки
металлов железа, магния, меди; таблицы: “Изменение атомного радиуса в периоде,
группе”, “Строение металлической кристаллической решетки”, учебник химии 9 класс
автор О.С. Габриелян 2010 год.
Ход урока
I. Ориентировочно-мотивационный этап.
Учитель: – Здравствуйте, ребята. Я рада вас видеть на своем уроке здоровыми и
бодрыми. Я думаю, что и у вас прекрасное настроение как у ромашки на
слайде презентации. Слайд 1.
А сейчас обратите внимание на лотки, что стоят на ваших столах. В них образцы
веществ. Причем, предложенные вашему вниманию вещества, против обыкновения, не
подписаны. Ваша задача состоит в том, чтобы распределить эти вещества по
каким-то признакам, то есть как-то их проклассифицировать. Признаки выберите
сами.
Учитель: – Какие признаки? (Твердость, металлический блеск.)
Учитель: – На какие группы распределились вещества? (Металлы и
неметаллы.)
Учитель: – Каких веществ больше?
В настоящее время известно более 80 металлов, точно сосчитаете дома. Чем они
отличаются друг от друга?
Учитель: – Они отличаются друг от друга свойствами: цветом, блеском,
твердостью.
Учитель: Как вы думаете, что мы сегодня будем изучать? Металлы. Да, мы
начинаем изучение большой темы “Металлы” (на экране проецируем тему урока)
Слайд 2.
Презентацию можно получить у автора статьи.
Записываем дату и тему урока в тетради.
Эпиграф нашего урока. “Мощь и сила науки – во множестве фактов, цель – в
обобщении этого множества”. Д.И.Менделеев. Слайд 3
“Внимательно осмотритесь вокруг. Где бы вы ни были: дома или в школе, на
улице или в транспорте – вы увидите, какое множество металлов трудится вокруг
нас и для нас.Слайд 4.
Учитель: Основываясь на собственный опыт, знания из курса физики, биологии,
литературы давайте вспомним, что мы знаем о металлах?Поделитесь своими
знаниями. (Беседа с классом.)
Учитель: Что мы должны узнать?
Цели:(Слайд 5.)
Учитель: Чтобы ответить на эти вопросы мы должны с вами выполнить
большую работу по изучению нового материала и приобретению знаний.
“Свойства веществ зависят от строения”. Сегодня эту зависимость мы
рассматриваем применительно к металлам. Давайте проследим
причинно-следственную связь между строением атома, химической связью и
физическими свойствами.
Строение атома – металлическая связь – металлическая кристаллическая решетка
– физические свойства – практическое применение
Учитель: – Ответьте на следующие вопросы:
1) Где расположены элементы– металлы? Слайд 6.
2) Какое место занимают металлы в периодической системе химических элементов
Д.И.Менделеева?
В периодической системе химических элементов каждый период, кроме первого,
начинается с активного металла. Эти элементы образуют главную подгруппу I группы
и называются щелочными металлами. Свое название они получили от названия
соответствующих им гидроксидов, хорошо растворимых в воде, – щелочей.
Следующие за щелочными металлами элементы, составляющие главную подгруппу II
группы, также являются металлами. Из этих металлов кальций, стронций, барий и
радий называют щелочноземельными металлами. Такое название они получили потому,
что их оксиды, которые алхимики называли “землями”, при растворении в воде
образуют щелочи.
Далее к металлам относят элементы главных подгрупп: III группы, исключая бор;
IV группы – германий, олово, свинец; V группы – сурьму и висмут; VI группы –
полоний.
Что касается элементов побочных подгрупп, то все они – металлы. Таким
образом, если в периодической системе провести диагональ от В к Астату через
элементы главных подгрупп, то по диагонали и над ней будут располагаться
неметаллы, а под ней – металлы. В периодах: в малых – металлы расположены в
начале, в больших – в четных рядах и начале нечетных. Слайд 7.
Из положения металлов в периодической системе можно определить и особенности
строения их атомов. Слайд 8.
1) На внешнем энергетическом уровне – 1–3 электрона.
2) У металлов сравнительно большой радиус атома
3) В периоде восстановительные свойства уменьшаются, т.к. увеличивается заряд
ядра, число электронов на внешнем слое.
4) В группе в главной подгруппе восстановительные свойства увеличиваются, т.к.
возрастает радиус атома.
Учитель: Давайте распишем электронное строение атомов металлов Na,
Ca, Al (3 обучающихся возле доски.) Вместе проверяем даем оценку.
Загадочная пауза Слайд 9. (Загадки про металлы.)
Учитель: Атомы – металлы образуют простые вещества, соединяясь
посредством химической связи. Какой? Слайд 10.
Учитель: Что такое металлическая связь? Связь в металлах и сплавах
между атом – ионами посредством обобществленных электронов называется
металлической. Веществам с металлической связью присущи металлические
кристаллические решетки. Свойства металлов обусловлены строением их кристаллов.
В узлах металлических кристаллических решеток располагаются атомы и ионы
металлов, связанные посредством обобществленных электронов, электронов, которые
оторвались от конкретных атомов и стали принадлежать всему кристаллу. Эти
электроны компенсируют силы электростатического отталкивания между
положительными ионами, связывают их, обеспечивают устойчивость металлической
решетки. Такой тип связи называется металлической. Она обусловливает все
важнейшие физические свойства металлов. Слайд 11.
Учитель: У меня на столе представлены кристаллические решетки металлов
магния, меди и железа дайте вместе рассмотрим строение кристаллических решеток
этих металлов. (Три обучающихся возле доски рассказывают о строении предложенных
решеток металлов.)
Физкультминутка.
Учитель: Какими физическими свойствами обладают металлы? Слайд 11
Учитель подчеркивает, что физические свойства металлов определяются их
строением.
Индивидуальные задания обучающимся. По материалу параграфа 6 заполнить
таблицу
| Физическое свойство металлов | Чем оно обусловлено | Примеры |
| Пластичность | ||
| Электрическая проводимость | ||
| Металлический блеск |
Остальные обучающиеся, для изучения физических свойств металлов по материалу
параграфа 6 (страница 30–32)делятся на 3 группы по свойствам, готовятся,
пишут свою часть схемы, выходят к доске приклеивают свои листочки и отвечают.
Класс может задавать вопросы. Обучающиеся 4 группы готовят и задают вопросы
остальным обучающимся групп.
Заполнение схемы по ходу изучения нового материала (по выступлениям
обучающихся от каждой группы).
После заполнения схемы возвращаемся к образцам металлов в лотках на столах
обучающихся и выполняем Лабораторный опыт “Ознакомление с образцами металлов”
на карточках подписаны названия металлов (железо, цинк, олово, алюминий,
свинец, серебро).
Физические свойства металлов.
Пластичность. Слайд 13. Металлы обладают пластичностью, ковкостью
и прочностью. Благодаря свободному перемещению электронов по всему кристаллу
разрыв связей не происходит, т. к. отдельные слои в кристалле могут смещаться
относительно друг друга. Это придает металлам пластичность-
способность изменять свою форму без разрыва химических связей. Металлы,
обладающие высокой пластичностью- золото, серебро,
медь, олово, железо, алюминий.
Просмотр фрагмента “Кузнечное дело” с диска “Неорганическая химия”.
Электропроводность.Лучшие проводники электричества – серебро и
медь, худшие – марганец, свинец и ртуть. Металлы обладают электрической
проводимостью благодаря наличию свободных электронов или электронного “газа”.
Хаотически движущиеся в металле электроны под воздействием приложенного
электрического напряжения приобретают направленное движение, в результате чего
возникает электрический ток.
Теплопроводность.
Теплопроводность металлов, как правило, соответствует электропроводности.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь
с колеблющими ионами и атомами, обмениваются с ними энергией. Поэтому происходит
быстрое выравнивание температуры по всему куску металла. Лучшая проводимость у
серебра, меди, худшая – у висмута, ртути.
Металлический блеск.
Для всех металлов характерен металлический блеск: серый цвет или
непрозразрачность. Свободные электроны, заполняющие межатомное пространство в
решетке, отражают световые лучи, поэтому металлы имеют металлический блеск
(серебристо-белый и серый). Только золото и медь в большей степени поглощают
короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового
спектра, поэтому имеют желтый и оранжевый цвет. Самые блестящие металлы-
ртуть, серебро.
Плотность.Слайд 14.Все металлы делятся на легкие
(с плотностью до 5г/см3) и тяжелые (с плотностью больше 5г/см3).
Легкие: Li, Na, K, Mg, Al Тяжелые: Zn, Cu, Sn, Ag, Au
Температура плавления. Слайд 15, 16.
Металлы делятся на легкоплавкие и тугоплавкие.
Твердость. Все металлы, кроме ртути, твердые. Но это свойство различно у
каждого металла. Слайд 17.
Самые мягкие металлы- натрий, калий, индий, их
можно резать ножом самый твердый металл – хром,
царапает стекло. Рассмотреть образцы щелочных и щелочноземельных металлов.
С представителями некоторых металлов мы сейчас познакомимся
Вступление к сообщениям обучающихся “Заморочки из бочки”
– Алхимики старались его получить используя философский камень для того,
чтобы править миром и вечно жить;
– Из-за этого металла пролилось много крови;
– Его используют в ювелирной промышленности) Это – Золото. (Сообщение про
золото. Слайд 18–27.)
Вступление к сообщению обучающегося о меди “МАСКА, Я ТЕБЯ ЗНАЮ!” Звон
колокольчика под тканью.
Следующий металл, о котором мы поговорим, – медь. Медь называют
музыкальным металлом. Почему, сейчас мы узнаем. Слайд 28.Когда на
Русь нападали полчища врагов, когда нужно было собрать народ на важные собрания,
ударяли в колокола. Давайте послушаем запись звонов ростовских колоколов. В
народе говорят, что колокольный звон делает человека добрее, справедливее. Все
злое, нехорошее от него уходит. Искусство колокольных дел мастеров осталось
составной частью национальной культуры. И поныне остается загадкой, как удалось
нашим предкам без измерительных приборов и точного анализа сплавов создать
“стозвонные” колокола – каждый со своим звоном (прослушивание звона
колоколов). После Слайда 31.
Сегодня медь широко используется в электротехнике и приборостроении. Но
давайте рассмотрим, как и где применяли раньше медь и ее значение сегодня.
Слайд 32–36.
Вступление к сообщению про железо (загадка – стихотворение).
Важнейший, древний элемент.
В тяжелой индустрии главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металлургии –
Он нужен всей стране родной.
Сообщение про железо. Слайд 37–42
А теперь, внимание! Знакомимся с самыми, самыми металлами. Слайд
43.
Проверка знаний по результатам изучения нового материала (тест на компьютере)
обмениваемся работами и проверяем с выставлением оценок по ключу
Подведение итогов. “Свойства веществ зависят от строения”. Сегодня эту
зависимость мы рассмотрели применительно к металлам. Проследили
причинно-следственную связь между строением атома, химической связью и
физическими свойствами.
Выставление оценок за урок.
Проведение рефлексии по результатам урока. Слайд 44.
Рефлексия. Чтобы осмыслить все увиденное, услышанное и выполненное на нашем
уроке мы предлагаем вам рефлексивный тест, направленный на оценку своих
собственных действий. Рефлексивный тест. Я узнал (а) много нового. Мне это
пригодится в жизни. На уроке было над чем, подумать. На все возникшие у меня в
ходе урока вопросы я получил (а) ответы. На уроке я поработал (а) добросовестно
и цели урока достиг(ла).
Учитель:
Сейчас прозвенит долгожданный звонок,
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и, пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы,
В журнал выставляю
Отметки все ваши, надеюсь привычно,
Что будут они хорошо и отлично.
Большое спасибо я вам говорю,
Мы цели достигли, благодарю.
Домашнее задание: параграф 5, 6 составить ребусы или загадки про
металлы, подготовить сообщения про сплавы меди и сплавы железа, составить
презентацию по теме “Сплавы”
Источник
