Какие свойства метанола и этанола лежать в основе их применения

Инфоурок
›
Химия
›Презентации›Презентация по химии на тему “Свойства метанола и этанола. Получение спиртов. Применение. Физиологическое действие спиртов на организм человека”.

Описание презентации по отдельным слайдам:
1 слайд

Описание слайда:
Свойства метанола и этанола. Получение спиртов. Применение. Физиологическое действие спиртов на организм человека. Учитель химии МБОУ «СОШ № 1» г. Красноперекопска Республика Крым Салидинова Замира Аметовна
2 слайд

Описание слайда:
Цели урока: Изучить химические свойства спиртов; Рассмотреть способы получения спиртов; Выяснить области применения и физиологическое действие на организм человека.
3 слайд

Описание слайда:
Получение спиртов 1) Из синтез-газа СО + 2Н2 СН3ОН 2) Гидратация этилена С2Н4 + Н2О СН3-СН2-ОН 3) Сбраживание сахаристых веществ С6Н12О6 2С2Н5ОН + 2СО2
4 слайд

Описание слайда:
Химические свойства спиртов 1) Водные растворы не действуют на индикаторы. 2) Реакция горения (полное окисление) С2Н5ОН + 3О2 2СO2 + ЗН2О 3) Окисление спиртов СН3СН2ОН + CuO CH3CHO + Cu + H2O
5 слайд

Описание слайда:
Химические свойства спиртов 4) Взаимодействие спиртов со щелочными металлами 2С2Н5ОН + 2Na 2C2H5ONa + H2↑ 5) Взаимодействие спиртов с галогеноводородами C2H5ОН + НCl С2Н5Сl + Н2O
6 слайд

Описание слайда:
Дегидратация – отщепление воды Внутримолекулярная дегидратация CH3-CH2 –OH CH2=CH2 + H2O Межмолекулярная дегидратация СН3–СН2–OH + НО–СН2–СН3 → СН3–СН2–O–СН2–СН3 + Н2О диэтиловый эфир
7 слайд

Описание слайда:
Применение спиртов
8 слайд

Описание слайда:
Физиологическое действие спиртов «Человечество могло бы достигнуть невероятных успехов, если бы оно было более трезвым» Гёте
9 слайд

Описание слайда:
С2Н5ОН – этиловый или винный спирт– является основным компонентом всех алкогольных напитков и относится к веществам, которые могут вызывать привыкание и болезненное пристрастие – алкоголизм. CH3OH – метиловый спирт. По своему физиологическому действию метанол – нервно-сосудистый яд. Попадание в организм 5–10 мл метанола уже вызывает отравление, которое может привести к потере зрения, а доза метанола в 50 мл является смертельной.
10 слайд

Описание слайда:
Срок жизни укорачивается на 10-15 лет. Несчастные случаи в 35 раз чаще: 50% ДТП; 65% тонущих в воде; 83% пожаров. Ежегодно погибает 6 млн. человек. С пьянством связано: 50% преступлений; 75 % детской преступности; 45% детской беспризорности; 96% убийств. Статистические данные
11 слайд

12 слайд

Описание слайда:
Домашнее задание Читать § 20; выполнить № 5 стр. 98

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии

Курс профессиональной переподготовки
Учитель химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Номер материала:
ДБ-082566
Вам будут интересны эти курсы:
Оставьте свой комментарий
Источник
Ключевое различие между Этанолом и Метанолом состоит в том, что Этанол менее токсичен, поэтому его используют в алкогольных напитках для пищевого применения, производится он путем ферментации пищевых культур, тогда как Метанол токсичен и является ядовитым химическим веществом получаемым в результате синтетических процессов.
Этанол и Метанол являются спиртовыми соединениями, поскольку они имеют группу -ОН. Группа ОН этих соединений присоединяется с sp3 гибридизированным углеродом. Кроме того, оба эти спиртовые соединения являются полярными жидкостями и обладают способностью образовывать водородные связи. Следовательно, оба они имеют несколько схожие физические и химические свойства. Однако, из-за их различий в токсичности, ошибочное употребление внутрь Метанола, может привести к несчастному случаю со смертельным исходом.
Содержание
- Обзор и основные отличия
- Что такое Этанол
- Что такое Метанол
- В чем разница между Этанолом и Метанолом
- Заключение
Что такое Этанол?
Этанол — относится к простейшим спиртам и имеет молекулярную формулу C2H5OH. Это прозрачная бесцветная жидкость с характерным запахом. Этанол является легковоспламеняющейся жидкостью. Температура плавления этого спирта составляет -114,1 oC, температура кипения составляет 78,5 oC. Этанол является полярным соединением. Кроме того, он может образовывать водородные связи из-за присутствия группы -ОН.
 Химическая структура Этанола
Химическая структура Этанола
Наиболее известное применение Этанола это в алкогольных напитках. В зависимости от процентного содержания этанола, существуют различные типы напитков, такие как вино, пиво, виски, бренди и д.р.
Этанол получают двумя путями — микробиологическим и синтетическим. Микробиологическим путем этанол получают из ржи, пшеницы, кукурузы, сахарного тростника с помощью ферментации сахара при использовании дрожжевого фермента брожения. Этот фермент присутствует в дрожжах, таким образом, при анаэробном дыхании (бескислородное дыхание) дрожжи могут продуцировать этанол. Синтетическим путём Этанол получают с помощью гидратации этилена.
 Алкогольные напитки, содержащие Этанол
Алкогольные напитки, содержащие ЭтанолПомимо использования Этанола в напитках, в медицине он применяется в качестве антисептика для очистки поверхностей от микроорганизмов, в транспортных средствах он применяется в качестве топлива и присадок к нему. Кроме того, этанол смешивается с водой и служит хорошим растворителем.
Несмотря на то, что у людей при метаболизме глюкозы выделяется Этанол, на человеческий организм он влияет как депрессант, а также угнетает нервную систему. Этанол токсичен для организма и превращается в ацетальдегид в печени, который также токсичен.
Что такое Метанол?
Метанол — относится к простейшим спиртам. Он имеет молекулярную формулу CH3OH. Имеет характерный запах этилового спирта и жгучий вкус. Температура плавления метанола составляет -98 oC, температура кипения составляет 65 oC.
 Химическая структура Метанола
Химическая структура МетанолаМетанол — чрезвычайно легкая, легковоспламеняющаяся, летучая и бесцветная жидкость. Что еще более важно, он очень токсичен.
 Метанол — ядовитое вещество
Метанол — ядовитое вещество
Метанол реагирует с газообразным кислородом с образованием углекислого газа и воды. Метанол выделяется при анаэробном дыхании некоторых разновидностей бактерий. Его промышленно производят из ископаемого топлива, такого как природный газ или уголь. Метанол широко используется в качестве растворителя в лабораториях для растворения полярных растворов. Кроме того, он применяется в качестве топлива для транспортных средств, антифриза в автомобильных радиаторах и в качестве денатурирующего средства. Ещё, Метанол используют как предшественник во многих процессах синтеза.
В чем разница и сходства между Этанолом и Метанолом?
Этанол и Метанол являются простейшими спиртовыми соединениями. Ключевое различие между Этанолом и Метанолом состоит в том, что Этанол менее токсичен, поэтому его используют в алкогольных напитках для пищевого применения, производится он путем ферментации пищевых культур, тогда как Метанол токсичен и является ядовитым химическим веществом, получаемым в результате синтетических процессов.
Химическая структура Этанола имеет два атома углерода, а Метанол содержит в своей химической структуре только один атом углерода. Следовательно, молекулярная масса Этанола выше, чем у Метанола. Метанол имеет более низкую температуру кипения, чем Этанол, основываясь на этом свойстве можно разделить раствор Этанола и Метанола с помощью метода дистилляции.
Ещё одно отличие в том, что Этанол является возобновляемым, поскольку он производится из ржи, пшеницы, кукурузы, сахарного тростника и других сельскохозяйственных культур, тогда как Метанол является не возобновляемым, поскольку в природе он встречается достаточно редко, например в эфирных маслах и производится в основном из ископаемого топлива.
Основная информация — Этанол против Метанола
Этанол и Метанол являются простейшими спиртовыми соединениями. Ключевое различие между Этанолом и Метанолом состоит в том, что Этанол менее токсичен, поэтому его используют в алкогольных напитках для пищевого применения, производится он путем ферментации пищевых культур, тогда как Метанол токсичен и является ядовитым химическим веществом, получаемым в результате синтетических процессов.
| Этанол | Метанол |
| Этанол — тип спирта, который состоит из этильной группы в его углеродном соединении | Метанол состоит из метильной группы в его углеродной связи |
| С точки зрения кислотности Этанол является слабой кислотой по сравнению с водой | Метанол имеет уровень кислотности выше, чем вода |
| Этанол обладает сильным жгучим запахом и выделяет ярко-синее пламя | Метанол летуч и обладает характерным запахом. Выдает ярко-белое пламя при горении |
| Обычно Этанол производят путем ферментации пищевых культур | Метанол в основном производится с помощью синтетических процессов |
| Этанол является основным ингредиентом в алкогольных напитках | Поскольку Метанол высокотоксичен, он совсем не подходит для потребления. Обычно он используется в производстве химических веществ, таких как формальдегид |
Источник
Îñíîâíûå ñâîéñòâà ìåòàíîëà è ýòàíîëà, îñîáåííîñòè èõ ôèçèîëîãè÷åñêîãî âîçäåéñòâèÿ íà îðãàíèçì ÷åëîâåêà. Õàðàêòåðèñòèêà ñïîñîáîâ ïîëó÷åíèÿ ìåòàíîëà è ýòàíîëà. Èñïîëüçîâàíèå ýòèëîâîãî ñïèðòà â ìåäèöèíå, åãî íàðêîòè÷åñêîå, íàðêîçíîå è òîêñè÷åñêîå äåéñòâèå.
| Ðóáðèêà | Õèìèÿ |
| Âèä | ðåôåðàò |
| ßçûê | ðóññêèé |
| Äàòà äîáàâëåíèÿ | 29.12.2014 |
| Ðàçìåð ôàéëà | 57,6 K |
Îòïðàâèòü ñâîþ õîðîøóþ ðàáîòó â áàçó çíàíèé ïðîñòî. Èñïîëüçóéòå ôîðìó, ðàñïîëîæåííóþ íèæå
Ñòóäåíòû, àñïèðàíòû, ìîëîäûå ó÷åíûå, èñïîëüçóþùèå áàçó çíàíèé â ñâîåé ó÷åáå è ðàáîòå, áóäóò âàì î÷åíü áëàãîäàðíû.
Ðàçìåùåíî íà https://www.allbest.ru/
Çàïàäíî-Êàçàõñòàíñêèé Ãîñóäàðñòâåííûé Óíèâåðñèòåò èì.Ì. Óòåìèñîâà
Êàôåäðà Õèìèè
Ðåôåðàò
Ýòàíîë. Ìåòàíîë.Ôèçèîëîãè÷åñêàÿàêòèâíîñòü
Âûïîëíèë: ñòóäåíò 2 êóðñà ãðóïïû 01214á
Ñïåöèàëüíîñòè 5Â072000 Êåíæåãàðèíà Ãóëüíóð
Ïðîâåðèë: ïðîôåññîð ÇÊÃÓ ×åðåâàòîâà Í.Ê.
Óðàëüñê – 2013 ãîä
Ñîäåðæàíèå
- I. Ââåäåíèå
- II. Îñíîâíîå ñîäåðæàíèå
- 1.1 Ìåòàíîë
- 1.1.1 Ïîëó÷åíèå è ñâîéñòâà
- 1.1.2 Ôèçèîëîãè÷åñêàÿ àêòèâíîñòü
- 1.2 Ýòàíîë
- 1.2.1 Ïîëó÷åíèå è ñâîéñòâà
- 1.3 Õèìè÷åñêàÿ ïðîìûøëåííîñòü
- 1.3 Ìåäèöèíà
- 1.3.1 Òîêñèêîëîãèÿ ýòàíîëà
- 1.3.2 Âèäû è ìàðêè ýòàíîëà
- 1.3.3 Ôèçèîëîãè÷åñêàÿ àêòèâíîñòü
- II. Âûâîä
- III. Ñïèñîê èñïîëüçîâàííîé ëèòåðàòóðû
- Äîïîëíèòåëüíàÿ èíôîðìàöèÿ
ýòàíîë ìåòàíîë òîêñè÷åñêèé ìåäèöèíà
Ïèâà
1. https://restorewiki.ruBB
2. https://festival.1september.ru/articles/589701/
3. https://xreferat.ru/108/858-1-proizvodstvo-metanola.html
4. Ãàáðèåëÿí Î.Ñ. Õèìèÿ. Ïîñîáèå äëÿ øêîëüíèêîâ ñòàðøèõ êëàññîâ è ïîñòóïàþùèõ â âóçû / Î.Ñ. Ãàáðèåëÿí, È.Ã. Îñòðîóìîâ. – Ì.: Äðîôà, 2005.
5. Ãëèíêà Í.Ë. Îáùàÿ õèìèÿ/ Ïîä ðåä.Â.À. Ðàáèíîâè÷à. – Ë.: Õèìèÿ, 1986. – 704ñ
6. Èçáðàííûå ãëàâû îðãàíè÷åñêîé õèìèè Àâòîð. À.Å. Àãðîíîâ.
Ðàçìåùåíî íà Allbest.ru
…
Ïîäîáíûå äîêóìåíòû
Ýòàíîë êàê ìíîãîòîííàæíûé ïðîäóêò îðãàíè÷åñêîãî ñèíòåçà, îãíåîïàñíûé ðàñòâîðèòåëü. Îáùàÿ õàðàêòåðèñòèêà îñíîâíûõ ìåòîäîâ è ñïîñîáîâ ïîëó÷åíèÿ ñèíòåòè÷åñêîãî ýòàíîëà. Çíàêîìñòâî ñ òåõíîëîãè÷åñêèìè îñîáåííîñòÿìè ïðîöåññà ïðîèçâîäñòâà ýòèëîâîãî ñïèðòà.
ðåôåðàò [901,0 K], äîáàâëåí 02.04.2019
Ñèíòåç ìåòàíîëà èç îêñèäà óãëåðîäà è âîäîðîäà. Òåõíîëîãè÷åñêèå ñâîéñòâà ìåòàíîëà (ìåòèëîâûé ñïèðò). Ïðèìåíåíèå ìåòàíîëà è ïåðñïåêòèâû ðàçâèòèÿ ïðîèçâîäñòâà. Ñûðüåâûå èñòî÷íèêè ïîëó÷åíèÿ ìåòàíîëà: î÷èñòêà ñèíòåç-ãàçà, ñèíòåç, ðåêòèôèêàöèÿ ìåòàíîëà-ñûðöà.
êîíòðîëüíàÿ ðàáîòà [291,5 K], äîáàâëåí 30.03.2008
Òîâàðíûå è îïðåäåëÿþùèå òåõíîëîãèþ ñâîéñòâà ìåòàíîëà, îáëàñòè ïðèìåíåíèÿ â õèìè÷åñêîé òåõíîëîãèè. Ñûðüåâûå èñòî÷íèêè ïîëó÷åíèÿ ìåòàíîëà. Ïåðñïåêòèâû èñïîëüçîâàíèÿ ðàçëè÷íûõ âèäîâ ñûðüÿ. Ïðîìûøëåííûé ñèíòåç ìåòèëîâîãî ñïèðòà è åãî îñíîâíûå ñòàäèè.
êîíòðîëüíàÿ ðàáîòà [42,6 K], äîáàâëåí 10.09.2008
Ïðåäñòàâëåíèå îá îäíîàòîìíûõ íàñûùåííûõ ñïèðòàõ íà ïðèìåðå ýòàíîëà. Õèìè÷åñêèå ñâîéñòâà, òåïëîòâîðíàÿ ñïîñîáíîñòü; ïðîèçâîäñòâî è ïðèìåíåíèå ñïèðòà. Óðàâíåíèÿ õèìè÷åñêîé ðåàêöèè ýòàíîëà ñ ìåòàëëàìè. Ïðîäóêòû çàìåùåíèÿ àòîìà âîäîðîäà ãèäðîêñèëüíîé ãðóïïû.
ðàçðàáîòêà óðîêà [28,8 K], äîáàâëåí 19.03.2015
Ôèçèêî-õèìè÷åñêèå ñâîéñòâà ìåòàíîëà, îáëàñòè ïðèìåíåíèÿ, òåêóùåå ñîñòîÿíèå ðûíêà äàííîãî ïðîäóêòà. Ïðîèçâîäñòâî, ïåðåðàáîòêà ìåòàíîëà â Ðîññèè è ïåðñïåêòèâû åãî èñïîëüçîâàíèÿ. Ìåòàíîë êàê àëüòåðíàòèâíûé ýíåðãîíîñèòåëü. Íîâîå òîïëèâî èç ïðèðîäíîãî ãàçà.
êóðñîâàÿ ðàáîòà [2,1 M], äîáàâëåí 05.10.2011
- ãëàâíàÿ
- ðóáðèêè
- ïî àëôàâèòó
- âåðíóòüñÿ â íà÷àëî ñòðàíèöû
- âåðíóòüñÿ ê íà÷àëó òåêñòà
- âåðíóòüñÿ ê ïîäîáíûì ðàáîòàì
Источник
Этанол – что это за вещество? Каково его применение и как оно производится? Этанол более известен всем под иным названием – спирт. Конечно, это не совсем правильное обозначение. Но между тем, именно под словом «спирт» мы и подразумеваем «этанол». Еще наши предки знали о его существовании. Они получали его путем процесса брожения. В ход шли различные продукты от злаков до ягод. Но в полученной браге, именно так называли в старину спиртные напитки, количество этанола не превышало 15 процентов. Чистый спирт смогли выделить только после того, как изучили процессы дистилляции.
Этанол – что это?
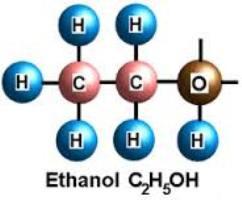
Этанол – это одноатомный спирт. При нормальных условиях он представляет собой летучую, бесцветную, легковоспламеняющуюся жидкость, обладающую специфическим запахом и вкусом. Этанол нашел широкое применение в промышленности, медицине и быту. Он является прекрасным дезинфицирующим средством. Спирт используется как топливо и в качестве растворителя. Но больше всего формула этанола С2Н5ОН известна любителям алкогольных напитков. Именно в этой сфере это вещество нашло широкое применение. Но не стоит забывать и о том, что спирт как действующий компонент алкогольных напитков является сильным депрессантом. Это психоактивное вещество способно угнетать центральную нервную систему и вызывать сильную зависимость.
В наше время сложно найти отрасль промышленности, где не использовался бы этанол. Трудно перечислить все, чем так полезен спирт. Но более всего его свойства оценили в фармацевтике. Этанол – главный компонент практически всех лекарственных настоек. Многие «бабушкины рецепты» для лечения людских недугов основываются на этом веществе. Оно вытягивает из растений все полезные вещества, накапливая их. Это свойство спирта нашло применение и при изготовлении домашних травяных и ягодных настоек. И хотя это и алкогольные напитки, но в умеренных количествах они приносят пользу здоровью.
Польза этанола

Формула этанола известна всем еще со школьных уроков по химии. Но вот в чем польза этого химического вещества, так сразу ответит не каждый. В действительности сложно представить отрасль промышленности, где не использовался бы спирт. Прежде всего, этанол применяют в медицине как мощнейшее дезинфицирующее средство. Им обрабатывают операционную поверхность и раны. Спирт губительно действует практически на все группы микроорганизмов. Но применяется этанол не только в хирургии. Он незаменим для изготовления лекарственных экстрактов и настоек.
В малых дозах спирт полезен для организма человека. Он способствует разжижению крови, улучшению кровообращения и расширению сосудов. Он даже применяется для профилактики сердечно-сосудистых заболеваний. Этанол способствует налаживанию работы желудочно-кишечного тракта. Но только в действительно малых дозах.
В особых случаях психотропное действие спирта может заглушить самые сильные боли. Этанол нашел применение и в косметологии. Благодаря своим ярко выраженным антисептическим свойствам он включен в состав практически всех очищающих лосьонов для проблемной и жирной кожи.
Вред этанола
Этанол – спирт, получаемый путем брожения. При чрезмерном употреблении он способен вызывать сильнейшие токсикологические отравления и даже кому. Это вещество входит в состав алкогольных напитков. Спирт вызывает сильнейшую психологическую и физическую зависимость. Алкоголизм принято считать болезнью. Вред этанола сразу ассоциируют со сценами безудержного пьянства. Неумеренное употребление напитков, содержащих спирт, приводит не только к пищевым отравлениям. Все гораздо сложнее. При частом распитии алкоголя поражаются практически все системы органов. От кислородного голодания, которое вызывает этанол, погибают в большом количестве клетки головного мозга. Происходит деградация личности. На первых стадиях ослабевает память. Затем у человека развиваются заболевания почек, печени, кишечника, желудка, сосудов и сердца. У мужчин наблюдается потеря потенции. На последних стадиях у алкоголика выявляется деформация психики.
История спирта

Этанол – что это за вещество и как его получили? Далеко не все знают, что его использовали еще с доисторических времен. Он входил в состав алкогольных напитков. Правда, концентрация его была небольшой. Но между тем, следы алкоголя были найдены в Китае на 9000-летней керамике. Это однозначно говорит о том, что люди еще в эпоху неолита выпивали содержащие алкоголь напитки.
Первый случай получения спирта был зарегистрирован в 12 веке в Салерно. Правда, это была водно-спиртовая смесь. Чистый же этанол выделил Иоганн Тобиас Ловиц в 1796 году. Он использовал метод фильтрации через активированный уголь. Получение этанола этим способом долго оставалось единственным методом. Формулу спирта вычислил Николо-Теодор де Соссюра, а описал его как углеродное соединение Антуан Лавуазье. В 19-20 веках многие ученые занимались изучением этанола. Были изучены все его свойства. В настоящее время он получил широкое распространение и применяется практически во всех сферах человеческой деятельности.
Получение этанола путем спиртового брожения
Пожалуй, самый известный способ получения этанола – это спиртовое брожение. Оно возможно только при использовании органических продуктов, которые содержат большое количество углеводов, например винограда, яблок, ягод. Еще один важный компонент, чтобы брожение протекало активно – это наличие дрожжей, ферментов и бактерий. Так же выглядит переработка картофеля, кукурузы, риса. Для получения топливного спирта используют сахар-сырец, который вырабатывают из тростника. Реакция довольно сложна. В результате брожения получается раствор, который содержит не более 16% этанола. Более высокую концентрацию получить не удается. Это объясняется тем, что в более насыщенных растворах дрожжи выжить не способны. Таким образом, полученный этанол необходимо подвергнуть процессам очистки и концентрирования. Обычно используют процессы дистилляции.
Чтобы получить этанол, используют вид дрожжей Saccharomyces cerevisiae различных штаммов. В принципе, все они способны активизировать данный процесс. В качестве питательного субстрата можно применять древесные опилки или как альтернативу – раствор, полученный из них.
Топливо

Многие знают о свойствах, которыми обладает этанол. Что это алкоголь или дезинфицирующее вещество, тоже широко известно. Но спирт еще является и топливом. Его используют в ракетных двигателях. Известный факт – во время Первой мировой войны 70% водный этанол применяли как топливо для первой в мире немецкой баллистической ракеты – «Фау-2».
В настоящее время спирт получил большее распространение. В качестве топлива он применяется в двигателях внутреннего сгорания, для нагревательных приборов. В лабораториях его заливают в спиртовки. Каталитическое окисление этанола используют для производства грелок, как военных, так и туристических. Спирт с ограничением применяют в смеси с жидким нефтяным топливом в силу его гигроскопичности.
Этанол в химической промышленности
Широко применение этанола в химической промышленности. Он служит сырьем для производства таких веществ, как диэтиловый эфир, уксусная кислота, хлороформ, этилен, ацетальдегид, тетраэтилсвинец, этилацетат. В лакокрасочной промышленности этанол широко используют как растворитель. Спирт является основным компонентом стеклоомывателей и антифризов. Применяется спирт и в бытовой химии. Он входит в состав моющих и чистящих средств. Особенно часто он встречается в качестве компонента в жидкостях для ухода за сантехникой и стеклом.
Этиловый спирт в медицине

Этиловый спирт можно отнести к антисептикам. Он губительно воздействует практически на все группы микроорганизмов. Он разрушает клетки бактерий и микроскопических грибов. Применение этанола в медицине носит практически повсеместный характер. Это прекрасное подсушивающее и обеззараживающее средство. Благодаря дубящим свойствам спирт (96%) используют для обработки операционных столов и рук хирурга.
Этанол – растворитель лекарственных препаратов. Он широко применяется для изготовления настоек и экстрактов из лекарственных трав и прочего растительного сырья. Минимальная концентрация спирта в подобных веществах не превышает 18 процентов. Часто этанол используют в качестве консерванта.
Этиловый спирт прекрасно применяется и для растираний. Во время лихорадки он производит охлаждающий эффект. Очень часто спирт используют для согревающих компрессов. При этом он абсолютно безопасен, на коже не остается покраснений и ожогов. Кроме того, этанол применяется как пеногаситель при подаче искусственным путем кислорода во время вентиляции легких. Также спирт является компонентом общей анестезии, которую могут применять в случае дефицита медикаментов.
Как ни странно, но этанол медицинский используется в качестве противоядия при отравлении токсичными спиртами, например метанолом или этиленгликолем. Обусловлено его действие тем, что при наличии нескольких субстратов фермент алкогольдегидрогеназа осуществляет только конкурентное окисление. Именно благодаря этому после незамедлительного приема этанола вслед за токсичным метанолом или этиленгликолем наблюдается уменьшение текущей концентрации отравляющих организм метаболитов. Для метанола это муравьиная кислота и формальдегид, а для этиленгликоля – щавелевая кислота.
Пищевая промышленность
Итак, как получить этанол, было известно еще нашим предкам. Но наиболее широкое применение он получил только в 19-20 веках. Наряду с водой, этанол является основой практически всех спиртных напитков, в первую очередь водки, джина, рома, коньяка, виски, пива. В небольших количествах спирт обнаруживается и в напитках, которые получают путем брожения, например в кефире, кумысе, квасе. Но к алкоголю их не причисляют, так как концентрация спирта в них очень мала. Так, содержание в свежем кефире этанола не превышает 0,12%. Но если он отстоится, то концентрация может повыситься до 1%. В квасе этилового спирта чуть более (до 1,2%). Больше всего алкоголя содержится в кумысе. В свежем молочном продукте его концентрация – от 1 до 3%, а в отстоявшемся доходит до 4,5%.
Этиловый спирт – хороший растворитель. Это свойство позволяет использовать его в пищевой промышленности. Этанол является растворителем для ароматизаторов. Кроме того, он может использоваться в качестве консерванта для хлебобулочных изделий. Он зарегистрирован как пищевая добавка Е1510. Этанол имеет энергетическую ценность 7,1 ккал/гр.
Действие этанола на организм человека

Во всем мире налажено производство этанола. Это ценное вещество используется во многих сферах жизни человека. Настойки на спирту являются лекарством. Пропитанные этим веществом салфетки используют как дезинфицирующее средство. Но вот какое влияние этанол оказывает на наш организм при попадании внутрь? Полезен ли он или вреден? Эти вопросы требуют детального изучения. Всем известно, что человечество потребляло алкогольные напитки веками. Но только в прошлом столетии проблема алкоголизма приобрела масштабные размеры. Наши предки употребляли брагу, медовуху и даже ныне столь популярное пиво, но все эти напитки содержали слабый процент этанола. Поэтому нанести существенный вред здоровью они не могли. Но после того как Дмитрий Иванович Менделеев разбавил спирт с водой в определенных пропорциях, все изменилось.
В настоящее время алкоголизм – это проблема практически всех стран мира. Попадая в организм, спирт оказывает патологическое воздействие практически на все органы без исключения. В зависимости от концентрации, дозы, пути попадания и длительности воздействия этанол может проявить токсическое и наркотическое действие. Он способен нарушать работу сердечно-сосудистой системы, способствует возникновению заболеваний пищеварительного тракта, в том числе и язвы желудка и 12-типерстной кишки. Под наркотическим действием подразумевается способность спирта вызывать ступор, нечувствительность к болевым ощущениям и угнетение функций центральной нервной системы. Кроме того, у человека возникает алкогольное возбуждение, очень быстро он становится зависимым. В отдельных случаях чрезмерное употребление этанола может вызвать кому.
Что же происходит в нашем организме, когда мы пьем алкогольные напитки? Молекула этанола способна поражать ЦНС. Под действием спирта происходит выделение гормона эндорфина в прилежащем ядре, а у людей с явно выраженным алкоголизмом и в орбитофронтальной коре. Но, тем не менее, несмотря на это, этанол не признан наркотическим веществом, хотя он и проявляет все соответствующие действия. Этиловый спирт не был внесен в международный список контролируемых веществ. И это спорный вопрос, потому как в определенных дозах, а именно 12 грамм вещества на 1 килограмм массы тела, этанол приводит сначала к острому отравлению, а затем и смерти.
Какие заболевания вызывает этанол?

Сам раствор этанола не является канцерогеном. Но вот его основной метаболит – ацетальдегид – токсичное и мутагенное вещество. Помимо этого, он еще и обладает канцерогенными свойствами и провоцирует развитие онкологических заболеваний. Его качества исследовались в лабораторных условиях на подопытных животных. Эти научные работы привели к весьма интересным, но в то же время настораживающим результатам. Оказывается, ацетальдегид – не просто канцероген, он способен повреждать ДНК.
Длительное употребление алкогольных напитков может вызывать у человека такие заболевания, как гастрит, цирроз печени, язва 12-типерстной кишки, рак желудка, пищевода, тонкой и прямой кишки, сердечно-сосудистые заболевания. Регулярное попадание этанола в организм может спровоцировать оксидативное повреждение нейронов мозга. Вследствие повреждения гематоэнцефалического барьера они погибают. Злоупотребление напитками, содержащими спирт, приводит к алкоголизму и клинической смерти. У людей, регулярно распивающих алкоголь, риск развития инфаркта и инсульта повышается в разы.
Но это еще не все свойства этанола. Это вещество является естественным метаболитом. В малых количествах оно может синтезироваться в тканях человеческого организма. Его называют истинным эндогенным алкоголем. Также оно продуцируется в результате расщепления углеводной пищи в желудочно-кишечном тракте. Такой этанол называют «условно эндогенным алкоголем». Может ли обычный алкотестер определить спирт, который синтезировался в организме? Теоретически это возможно. Его количество редко превышает 0,18 промилле. Это значение находится на нижней границе самых современных измерительных приборов.
Источник
