Какие свойства основные или кислотные проявляет оксида магния
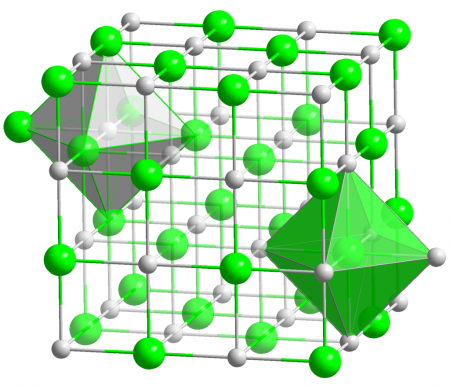
| Оксид магния | |
|---|---|
 | |
| Систематическое наименование | Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES | O=[Mg] |
| InChI | 1S/Mg.O CPLXHLVBOLITMK-UHFFFAOYSA-N |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
MgO + 2HCl → MgCl2 + H2O MgO + H2O → Mg(OH)2
Получение
Оксид магния получают обжигом минералов магнезита и доломита.
CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2 MgCO3 → MgO + CO2
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Соединения магния | |
|---|---|
| |
Источник
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2

4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Источник
Магния оксид – вещество, используемое в спорте, медицине и пищевой промышленности. Атлеты и скалолазы обрабатывают им руки, чтобы предотвратить скольжение. Доктора и косметологи ценят оксид магния за противовоспалительное и антибактерицидное действие. Присутствует он и в некоторых наших продуктах в качестве пищевой добавки Е530. Не опасно ли это?
Описание вещества
Официально принятое название добавки – Magnesium Oxide (оксид магния), также известен под индексом европейской кодификации Е530. Химическая формула – MgO. Помимо этого в составе различных товаров определить это вещество можно под именем: жженая магнезия или окись магния. Получают его в лабораторных условиях путем обжига доломита и магнезита, которые содержат и оксид магния. Также он встречается в естественных условиях в минерале периклаз – прозрачных кристаллов с серовато-зеленым оттенком.
Бывает две формы этого вещества: тяжелая и легкая окись магния. Тяжелая похожа на грубый порошок с крупными кристаллами, ее применяют в строительстве, спорте, тяжелой промышленности. Легкая окись магния используется в качестве эмульгатора и стабилизатора в производстве продуктов питания, а также в медицине, представляет собой рыхлый белый порошок без запаха со слабо землистым вкусом. Цвет этого вещества считается «эталонным» белым, такое свойство обусловлено абсолютной отражательной способностью.
Кристаллы жженной магнезии не растворяются в воде и спирте, хорошо поглощают жиры и другие жидкости. Относится к пожаробезопасным, плавится при температуре от 28000 С, а закипает при 36000 С. Благодаря этим свойствам жженую магнезию используют в качестве огнеупорного материала в нефтеперерабатывающей промышленности и других отраслях. Образует соли при соединении с кислотами, поэтому в химической промышленности тоже широко применяется.
Применение MgO в промышленности
Благодаря высокой температуре плавления, магний оксид используется в строительстве. В этом случае высоко ценится так называемый «каустический магнезит», который получают путем обжига природного магнезита. Особенно широкое применение он получил при создании строительных материалов таких, как ксилит, цемент, бетон. Химическое вещество повышает их огнеупорность, поэтому такие материалы часто применяют при строительстве производственных помещений, жилых и общественных.
Также вещество MgO используют для создания вяжущих веществ. Однако его свойство впитывать влагу позволяет применять такие материалы и смеси только для строительства помещений с преимущественно сухим режимом эксплуатации. В автомобильной промышленности это химическое соединение вводят в резиновые смеси, а также для вулканизации в качестве активатора других ускорителей.
Легкая окись магния обладает абразивными свойствами, поэтому ее часто используют в электронной промышленности для очистки «чувствительных» поверхностей. Помимо этого жженая магнезия нашла свое применение в таких случаях:
- входит в состав защитного слоя в жидкокристаллических экранах;
- применяется в производстве бумаги;
- включается в состав нагревательных элементов в системах отопления;
- некоторые виды нефтепродуктов очищаются с помощью этого химического соединения.
Еще одно важное свойство соединения MgO состоит в том, что с его помощью можно контролировать процесс растворяемости радионуклидов. Это качество очень полезно на заводах, перерабатывающих отходы, применение жженной магнезии в этом случае для сохранения экологического равновесия.
Перспективным сегментом потребления оксида магния сегодня считается сельское хозяйство. Здесь с его помощью предотвращают слеживание удобрений и применяют как самостоятельную добавку для обогащения почвы магнием. Недостаток магния на сельхозугодьях отражается на производимой продукции, поэтому применение такого удобрения очень важно для урожая. Правда чаще всего еще используют сульфат магния, так как последний немного дешевле жженной магнезии.
Также свое применение это вещество нашло в животноводстве. Дефицит магния сказывается на здоровье скота и продуктах, получаемых от них. Обычно питание животных на фермах содержит достаточно всех необходимых минералов и витаминов. Но на пастбищах, удобренных калием и азотом иногда бывает недостаток Mg. Жженую магнезию применяют для профилактики и устранения магниевого дефицита, вводя подкормки.
Косметические товары с оксидом магния
В косметической отрасли магния оксид используют в качестве стабилизатора, буферного вещества, абсорбента. Но главным свойством, которое ценят косметологи и дерматологи это его текстура. Рыхлость, легкость и рассыпчатость позволяет успешно применять жженую магнезию в производстве пудр, тальков, румян и т.д. Присутствие этого компонента в рецептуре косметического продукта позволяет избежать образования комков даже при условии долгого периода эксплуатации.
Оксид магния встречается в таких продуктах:
- декоративная косметика;
- солнцезащитные средства для тела;
- маски для волос и лица;
- лосьоны против черных точек;
- детские тальки;
- дезодоранты и антиперспиранты;
- шампуни.
Если в составе продукта значится Е530 или Magnesium Oxide, это нисколько не умаляет качество самого товара. При наружном применении эта добавка считается абсолютно безопасной, обладает противовоспалительным и абсорбирующим эффектом на коже. Более того в сочетании с другими химическими элементами его возможности значительно возрастают. Чаще всего жженую магнезию сочетают с цинком, что решает очень распространенную проблему – сужает поры. Также полезные свойства оксида магния включают в себя отбеливание кожи и себорегуляцию (подсушивание жирной кожи).
Оксид магния как пищевая добавка
В продуктах питания этот компонент обычно встречается под индексом Е530. В качестве пищевой добавки MgO разрешен законом в странах ЕС, Украине и России (относительно других стран данные не представляются). По степени влияния на организм это вещество относят к безопасным. В пищевой промышленности оксид магния ценят главным образом как эмульгатор и стабилизатор.
Чаще всего Е530 встречается в таких продуктах:
- сухое молоко (в кол-ве 10 г/кг);
- сухие сливки (1000 мг/кг);
- продукция из шоколада и какао (70 г/кг);
- пищевые масла;
- маргарин, спред, масло сливочное.
В пищевые продукты компонент Е530 добавляется для предотвращения комкования и слеживания. В производстве кулинарных жиров и масел эта добавка ускоряет гидрогенизацию. Ее наличие в составе продуктов не говорит о их плохом качестве, так как компонент признан безопасным.
Влияние Е530 на организм: польза и вред
Основным потребителем оксида магния остается фармацевтика. Это химическое соединение добавляют в лекарства, используют при самостоятельном или комплексном лечении. В медицине ценятся такие фармакологические свойства Е530: антацидное, противоязвенное, противовоспалительное. Также окись магния улучшает мускулатуру кишечника.
Попадая в пищеварительный тракт, жженая магнезия вступает в реакцию с водой и образует гидроксид. Это вещество снижает действие пищеварительных ферментов, в частности нейтрализует соляную кислоту. Благодаря этому добавка Е530 применяется при повышенной кислотности, против изжоги, для лечения и профилактики язвы. Также в желудке это вещество образует магния хлорид – соединение, которое улучшает перистальтику кишечника и обеспечивает слабительный эффект.
Препараты с мagnesium оxide применяют для профилактики появления оксидных камней. Для этого вещество комбинируют с пиридоксином. Добавка не вызывает повышения щелочности крови и тканей организма, также не способна проникнуть через стенки ЖКТ в кровоток. Любое влияние на организм возможно только при установленной врачом дозировке. То есть то количество Е530, которое есть в продуктах питания на организм не влияет.
Окись магния помогает при таких болезнях:
- острый и хронический гастрит;
- обострение язвы 12-перстной кишки и желудка;
- диспепсия;
- панкреатит;
- при отравлении кислотами для нейтрализации их действия;
- для устранения запоров.
Также эта добавка эффективна для профилактики дефицита магния или пополнения запасов этого минерала. Этот компонент обеспечивает нормальную работу нервной системы, укрепляет структуру костей и сердечную мышцу. В этих целях прописывают витаминные комплексы, в состав которых входит MgO: Витрум, Компливит Актив, Мультимакс, Мульти-табс, Олиговит и др.
Принимать лекарства и витамины с оксидом магния для самолечения небезопасно, так как помимо полезных качеств наблюдаются побочные эффекты и противопоказания.
В первую очередь препараты с MgO не прописывают людям с индивидуальной чувствительностью к данному веществу. Также применять их опасно при гипермагниемии – повышенной концентрации магния в сыворотке крови. Переизбыток Mg в организме угнетает деятельность нервной и сердечно-сосудистой системы.
Особенно осторожно такие препараты нужно использовать людям с болезнями почек, так как нарушение их деятельности приводит к той самой гипермагниемии. По предписанию доктора лекарства с содержанием оксида магния часто сочетают с антацидами алюминия, которые снижают риск побочных эффектов со стороны ЖКТ и продлевают полезное действие препаратов.
Случаи передозировки жженой магнезией отсутствуют, как и отзывы от потребителей. Ее используют для взрослых, некоторые лекарственные формы применяются в детской педиатрии, в период кормления грудью и беременности, что говорит о его относительной безопасности и пользе для организма.
Вред Е530 может нанести только в случае неправильного самолечения, превышенном употреблении вещества или совмещении с азитромицином (такая комбинация не рекомендуется). Передозировка препаратом случается крайне редко, только в случаях нарушенной деятельности пищеварения или работы других систем. В здоровом организме из полученной жженной магнезии усваивается нужное количество магния, а остальное утилизируется без последствий для здоровья.
В заключение: где купить оксид магния
Окись магния используется во многих отраслях: строительстве, спорте, пищевой промышленности, сельском хозяйстве. Вещество не несет вреда для человеческого организма при правильном использовании или употреблении продуктов с ним. Купить оксид магния можно оптом по интернету или в точках сбыта с заводов. В розницу это вещество продают в аптеках в виде саше с порошком, в таблетках, в составе витаминно-минерального комплекса. Цена за такие препараты зависят от производителя и узнаваемости бренда, средняя цена за упаковку таблеток (60 штук) составляет от 10 долларов. Принимать препарат внутрь без консультации врача не рекомендуется.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Источник
