Какие свойства относятся к сложным
В школьном курсе изучаются четыре основных класса сложных веществ: оксиды, основания, кислоты, соли.
– это сложные вещества, состоящие из двух элементов, один из которых кислород.
Оксиды делятся на:
несолеобразующие – не
взаимодействуют ни с кислотами, ни с щелочами и не образуют солей. Это оксид азота (I) N2O, оксид азота (II) NO, оксид углерода (II) CO и некоторые другие.
солеобразующие – при
взаимодействии с кислотами или основаниями образуют соль и воду.
В свою очередь они делятся на:
основные – им
соответствуют основания. К ним относятся оксиды металлов с небольшими степенями окисления (+1, +2). Все они представляют собой твердые вещества)
кислотные – им
соответствуют кислоты. К ним относятся оксиды неметаллов и оксиды металлов с большими степенями окисления. Например оксид хрома (VI) CrO3, оксид марганца (VII)
Mn2O7.
амфотерные – в
зависимости от условий проявляют основные или кислотные свойства, т.е. обладают двойственными свойствами. Это оксид цинка ZnO, оксид алюминия Al2O3, оксид железа
(III) Fe2O3, оксид хрома (III) Cr2O3.
Типичные реакции основных оксидов
1. Основный оксид + вода = щелочь ( ! Реакция протекает, если образуется растворимое основание! )
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Основный оксид + кислотный оксид = соль
CaO + N2O5 = Ca(NO3)2
MgO + SiO2 = MgSiO3
3. Основный оксид + кислота = соль + вода
FeO + H2SO4 = FeSO4 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Типичные реакции кислотных оксидов
1. Кислотный оксид + вода = кислота (кроме оксида кремния SiO2)
SO2 + H2O = H2SO3
CrO3 + H2O = H2CrO4
2. Кислотный оксид + основный оксид = соль
SO3 + K2O = K2SO4
CO2 + CaO = CaCO3
3. Кислотный оксид + основание = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
N2O5 + Ca(OH)2 = Ca(NO3)2 +
H2O
Типичные реакции амфотерных оксидов
1. Амфотерный оксид + кислота = соль + вода
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2. Амфотерный оксид + щелочь = соль + вода
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Cr2O3 + 2NaOH + 7H2O =
2Na[Cr(OH)4(H2O)2]
При сплавлении
ZnO + 2KOH = K2ZnO2 + H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
– это сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими
гидроксогруппами.
Основания делятся на:
растворимые в воде (щелочи) –
образованы элементами I группы главной подгруппы LiOH, NaOH, KOH, RbOH, CsOH и элементами II группы главной подгруппы (кроме магния и бериллия) Ca(OH)2, Sr(OH)2,
Ba(OH)2.
нерастворимые в воде – все
остальные.
Реакции, характерные для всех оснований
1. Основание + кислота = соль + вода
2KOH + H2SO4 = K2SO4 +2H2O
Cu(OH)2 + 2HCl = CuCl2 + H2O
Типичные реакции щелочей
1. Водные растворы изменяют окраску индикаторов (лакмус – синий, метилоранж – желтый, фенолфталеин – малиновый)
KOH = K+ + OH- (ионы OH- обуславливают щелочную реакцию среды)
Ca(OH)2 = Ca2+ + 2OH-
2. Щелочь + кислотный оксид = соль + вода
Ca(OH)2 + N2O5 = Ca(NO3)2 +
H2O
2KOH + CO2 = K2CO3 + H2O
3. Щелочь + соль = соль + основание (если продукт реакции нерастворимое соединение или малодиссоциирующее вещество NH4OH)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2
(нераств.)
Ca(OH)2 + Na2SiO3 = CaSiO3 (нераств.) + 2NaOH
NaOH + NH4Cl = NaCl + NH4OH
4. Реагируют с жирами с образованием мыла
Типичные реакции нерастворимых оснований
1. Разлагаются при нагревании
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Среди нерастворимых оснований есть амфотерные. Например, Be(OH)2, Zn(OH)2,
Ge(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3, Sn(OH)4 и др.
Они взаимодействуют с щелочами в водном растворе
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Fe(OH)3 + NaOH = Na[Fe(OH)4]
или при сплавлении
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
– это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
Реакции, характерные для всех кислот
1. Кислота + основание = соль + вода
2HNO3 + Cu(OH)2 = Cu(NO3)2 +2H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
2. Кислота + основной оксид = соль + вода
CuO + H2SO4 = CuSO4 + 2H2O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
– это сложные вещества, в состав которых входят атомы металла и кислотного остатка.
Соли делятся на:
средние – в своем составе содержат в качестве катионов только атомы металла и в качестве анионов только
кислотный остаток. Их можно рассматривать как продукты полного замещения атомов водорода в составе кислоты на атомы металла или продукты полного замещения гидроксогрупп в молекуле основного
гидроксида кислотными остатками.
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3H2SO4 + 2Fe(OH) 3 = Fe2(SO4)3 + 6H2O
кислые – в качестве катионов содержат не только атомы металла, но и водорода. Их можно рассматривать
как продукты неполного замещения атомов водорода в составе кислоты. Образуются только многоосновными кислотами. Получаются при недостаточном количестве основания для образования средней
соли.
H2SO4 + NaOH = NaHSO4 + H2O
основные – в качестве анионов содержат не только кислотный остаток, но и гидроксогруппу. Их можно
рассматривать как продукты неполного замещения гидроксогрупп в составе многокислотного основания на кислотный остаток. Образуются только многокислотными основаниями. Получаются при недостаточном
количестве кислоты для образования средней соли.
H2SO4 + Fe(OH) 3 = FeOHSO4 + 2H2O
Типичные реакции средних солей
1. Соль + кислота = другая соль + другая кислота ( Реакция протекает, если образуется нерастворимое
соединение, выделяется газ – углекислый СО2, сернистый SO2, сероводород H2S – или образуется малодиссоциирующее вещество, например, уксусная кислота
CH3COOH ! )
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
(CH3COO)2Ca + 2HNO3 = Ca(NO3)2 + 2CH3COOH
В результате этой реакции можно получить летучие кислоты: азотную и соляную, если взять твердую соль и сильную концентрированную кислоту (лучше
серную)
2NaCl + H2SO4 = Na2SO4 + 2HCl
2KNO3 + H2SO4 = K2SO4 + 2HNO3
2. Соль + щелочь = другая соль + другое основание( Реакция протекает, если образуется нерастворимое
соединение или образуется малодиссоциирующее вещество, например, гидроксид аммония NH4OH ! )
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2↓
NH4Cl + NaOH = NaCl + NH4OH
3. Соль(1) + соль(2) = соль(3) + соль(4) ( Реакция протекает, если образуется нерастворимое соединение
! )
NaCl + AgNO3 = NaNO3 + AgCl↓
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
4. Соль + металл = другая соль + другой металл ( Металл вытесняет из растворов солей все другие
металлы, стоящие в ряду напряжений металлов правее него. Реакция протекает, если обе соли растворимы, а сам металл не взаимодействует с водой ! )
CuCl2 + Fe = FeCl2 + Cu
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
5. Реакции разложения:
а) карбонатов. Разлагаются в основном при нагревании нерастворимые карбонаты двухвалентных металлов на оксид и углекислый газ. Из щелочных металлов реакция
характерна для карбоната лития в инертной среде.
б) гидрокарбонаты разлагаются на карбонаты, углекислый газ и воду.
в) нитратов: по схеме – до магния включительно по ряду напряжений металлов разлагаются на нитрит и кислород; от магния до меди включительно на оксид металла
(часто металл меняет степень окисления на более высокую), оксид азота (IV) и кислород; после меди на металл, оксид азота (IV) и кислород.
Типичные реакции кислых солей
1. Кислая соль + щелочь = средняя соль + вода
NaHSO4 + NaOH = Na2SO4 + H2O
Типичные реакции основных солей
1. Основная соль + щелочь = средняя соль + вода
(CuOH) 2CO3 + H2CO3 = CuCO3↓ + 2H2O
Источник
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Н + Н = Н2
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
- «Атом» – конкретное понятие, так как атомы существуют реально.
- «Химический элемент» – это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
| Характеристики химического элемента | Характеристики простого вещества |
|
|
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества
- Простые вещества – вещества, в состав которых входят атомы одного вида
- Простые вещества делят на металлы и неметаллы
- Сложные вещества – вещества, в состав которых входят атомы различных видов
- Сложные вещества делят на органические и неорганические
- Существуют вещества атомного, молекулярного и ионного строения, их свойства различны
- Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Источник

Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
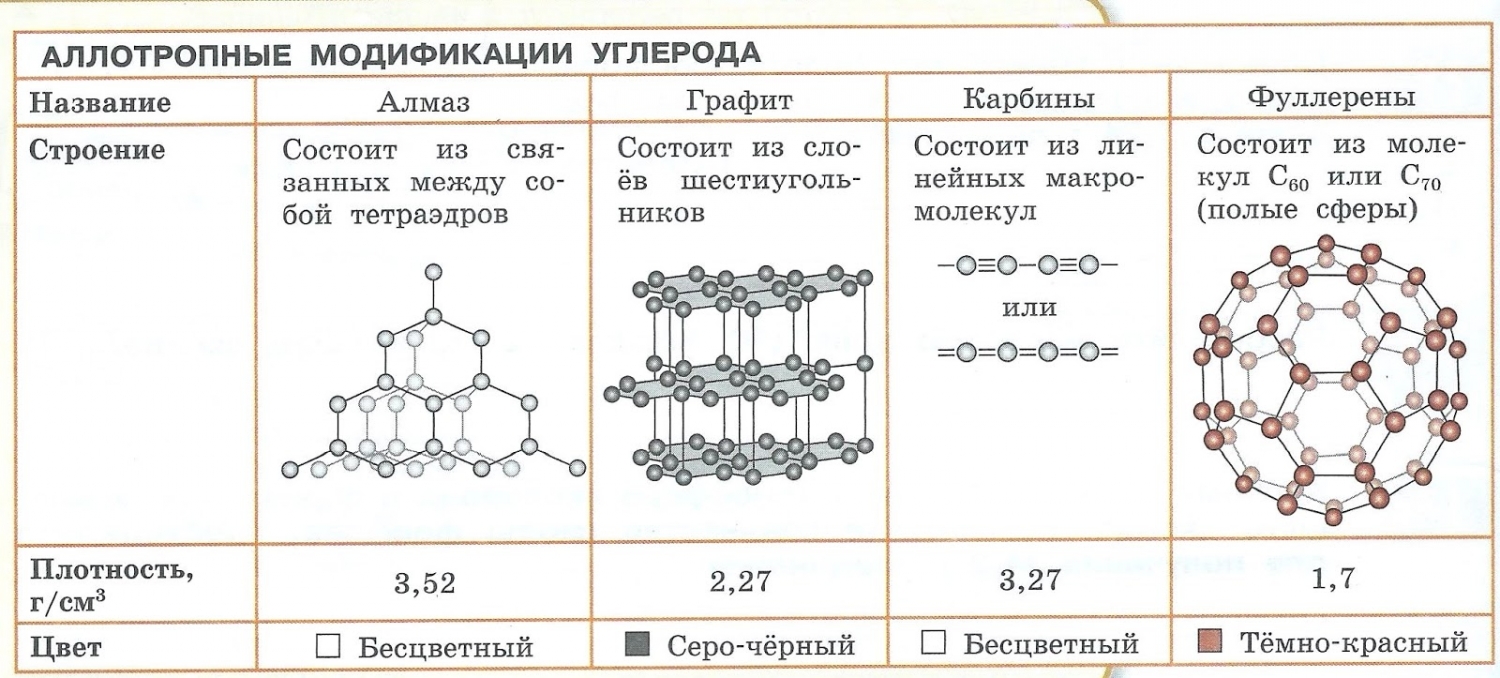
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
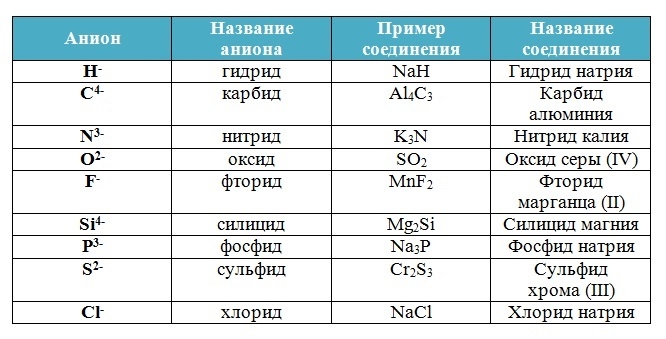
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Источник
