Какие свойства присущи воздуху растворимость в воде

Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде – снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = ma/ mw
где
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
mw = масса воды (кг)
Закон Генри.
Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: “При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).” – В символьном виде закон может быть записан как:
c = k H pg
где
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример – Расчет количества воздуха, растворенного в воде.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25oC (77oF)
* Кислород – O2 : 756.7 атм/(моль/л)
* Азот – N2 : 1600 атм/(моль/л)
Молярные веса
* Кислород – O2 : 31.9988 г/моль
* Азот – N2 : 28.0134 г/моль
Относительное содержание (по объему) в воздухе:
* Кислород – O2 : ~ 0.21
* Азот – N2 : ~ 0.79
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
= 0.0089 г/л
~ 0.0089 г/кг
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
= 0.0138 г/л
~ 0.0138 г/кг
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
= 0.0227 г/л
~ 0.023 г/кг
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
Абсолютное давление (атм) | 1 | 2 | 3 | 4 | 5 | 6 |
| Объем растворенного в воде воздуха при 250C (г/кг) | 0,023 | 0,045 | 0,068 | 0,091 | 0,114 | 0,136 |
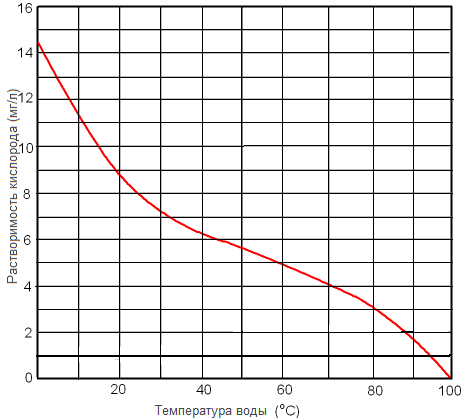
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 2120F (1000C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
Источник
Воздух – это смесь газов. Окружает планету, образует атмосферу и содержится во всём, что существует. Он есть в воде, земле, растениях, животных, горах, камнях и необходим для жизни живых организмов. Физические, химические и гигиенические свойства формируют климат в регионах частей Земли, влияют на жизнедеятельность растений и животных.
Основные свойства воздуха
- Прозрачен.
- Не имеет цвета и запаха.
- Не имеет формы, занимает всё пространство.
- Упругость.
- Проводит звук и солнечные лучи.
- Сохраняет тепло.
- При нагревании расширяется, при охлаждении сжимается.
- Подвижен.
Физические свойства
- Температурные. Регулирует теплообмен.
- Влажность. Определяет насыщение газов кислородом, содержание водяного пара.
- Атмосферное давление. Масса атмосферного столба, который давит на поверхность планеты и на всё, что расположено внутри воздушного океана.
- Подвижность. Формирует ветра и обновление газового состава.
- Солнечная радиация. Определяет процент радиоактивных веществ и газов, содержащихся в атмосфере. Основной показатель формирования климата планеты.
- Электрическая активность. Количество электрических зарядов, содержащихся в воздушном пространстве.
Химический состав воздуха
Воздушная оболочка Земли формируется из смеси газов:
- Азот. Основной компонент атмосферы. Не участвует в дыхании, не поддерживает горение. Обеспечивает жизнедеятельность водорослей и некоторых растений.
- Кислород. Жизненно необходимый элемент. Является необходимым в формировании биологических процессов организмов животных, растений. Служит окислителем и основным компонентом горения веществ.
- Углекислый газ. Поглощается деревьями и преобразуется в кислород.
 В небольших количествах атмосфера содержит озон, водород, неон, другие газы. По количеству содержания вредных примесей определяют чистоту воздуха. Подробнее – в статье о составе воздуха.
В небольших количествах атмосфера содержит озон, водород, неон, другие газы. По количеству содержания вредных примесей определяют чистоту воздуха. Подробнее – в статье о составе воздуха.
Теплопроводность воздуха
Окружающий воздух практически не проводит тепло. Особенность задерживать тепловой заряд широко используется человеком и животными. Ограничивая подвижность потока, воздушная прослойка задерживает теплообмен организмов, создаёт комфортный микроклимат.
При нагревании с воздухом происходит расширение и он поднимается, становится разреженным. Изменяется его химический состав и влажность. Водяной пар распадается на отдельные газы, становится более летучим.
При охлаждении воздух сжимается и он опускается. Незначительное содержание твёрдых частиц в газах окисляется и насыщается водяными парами. Воздух становится тяжелее и плотнее.
Применение и использование свойств воздуха
Воздушную оболочку планеты активно используют животные и птицы. Способность задерживать тепло помогает животным выживать и регулировать тепловые процессы организма. Шерсть, обитателей северных широт, имеет полую структуру.
Особое строение пера и движение воздушных масс птицы используют для полётов и планирования над землёй.
 Наполненный атмосферой пузырь, удерживает рыб в толще воды и способствует перемещению из глубин водоёмов к поверхности.
Наполненный атмосферой пузырь, удерживает рыб в толще воды и способствует перемещению из глубин водоёмов к поверхности.
Подвижность используется растениями для опыления и распространения семян на большие площади.
Человек использует свойства атмосферы в широких спектрах своей жизнедеятельности:
- Теплопроводность обеспечивает обогрев и терморегуляцию организма.
- Способность тёплых воздушных потоков подниматься используют в полётах.
- Упругость и сжатие применяют во всех промышленных системах. Его закачивают в автомобильные шины. Нагнетая воздушное давление, работают пневматические инструменты, оружие.
- Кислород участвует в процессах горения. Все двигатели внутреннего сгорания потребляют большие объёмы кислорода и его соединений.
Более подробная информация об использовании и значении воздуха живыми организмами здесь.
Сравнение свойств воды и воздуха
Основную роль воздушный океан играет в дыхании всех живых существ Земли. Содержание его в воде используется всеми подводными животными и растениями.
Вода и воздух имеют похожие параметры. Она так же прозрачна и безвкусна, так же реагирует на нагрев и охлаждение. Основным отличием воды является способность растворять вещества и её большая плотность. Вода имеет большую массу и теплопроводность, проводит заряды электричества. Способность извлекать необходимые компоненты из воды, без применения специального оборудования, человеку и млекопитающим не под силу.
Оценка статьи:
Загрузка…
Источник
Основным источником обогащения воды кислородом является кислород, содержащийся в воздухе. Растворимость в воде кислорода, как и всякого другого газа, зависит от температуры воды и парциального давления кислорода над ней. [c.6]
Физические свойства. Азот — газ без цвета, запаха и вкуса, легче воздуха. Растворимость в воде меньше, чем у кислорода при 20 °С в 1 л воды растворяется 15,4. мл азота (кислорода 31 мл). Поэтому относительное содержание кислорода по отношению к азоту в воздухе, растворенном в воде, будет большим, чем в атмосферном. [c.104]
Сульфид лития гигроскопичен, расплывается во влажном воздухе. Растворимость в воде высокая (растворяется и в спирте). При растворении сильно гидролизуется, образуя гидросульфид LiHS [10] [c.22]
Физические свойства. Азот — газ без цвета, запаха и вкуса, легче воздуха. Растворимость в воде меньше, чем у кислорода при 20°С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота. [c.188]
Описание вещества начинается с краткой словесной характеристики, включающей цвет, (обычно для агрегатного состояния при комнатной температуре), некоторые качественные физические свойства (твердость, хрупкость, термическая устойчивость, фазовые переходы), особенности строения, устойчивость на воздухе, растворимость в воде, наличие или отсутствие взаимодействия с распространенными простыми и сложными веществами, указание на способы получения в лаборатории и в промышленно- [c.4]
Описание вещества начинается с краткой словесной характеристики, включающей цвет (обычно для агрегатного состояния при комнатной температуре), некоторые качественные физические свойства (твердость, хрупкость, термическая устойчивость, фазовые переходы), особенности строения, устойчивость на воздухе, растворимость в воде, наличие или отсутствие взаимодействия с [c.5]
Свойства, /возг 371 °С /пл 419,7 °С d 4,74. Кристаллы расплываются на> воздухе. Растворимость в воде при 22°С 84,64% 0 2,84), в абсолютном спирте при 24 °С 74,02% ( 2,21). [c.939]
Свойства. Серо-голубые кристаллы, расплывающиеся на воздухе. Растворимы в воде (сине-фиолетовый раствор) хорошо растворимы в спирте нерастворимы в ацетоне. Кристаллическая структура тригональная, пр. гр. R3 (а=11,90 А с=11,97 А). [c.1587]
Наряду с оценкой силы запаха и токсичности, весьма существенное значение в решении вопроса о возможности применения того или иного продукта в качестве одоранта имеют фракционный состав, давление насыщенных паров, температуры замерзания и вспышки, пределы взрываемости в смеси с воздухо , растворимость в воде, коррозионные свойства и др. [c.157]
Свойства. Бесцветные прозрачные кристаллы, легко выветриваются на воздухе, растворимы в воде (1 3), нерастворимы в спирте. При 32,4″ кристаллы соли плавятся в своей кристаллизационной воде. Соль окрашивает бесцветное пламя в желтый цвет. При прибавлении к раствору соли раствора хлорида бария выпадает белый осадок, нерастворимый в кислотах. [c.197]
Физические и химические свойства. Бесцветная прозрачная вязкая жидкость с сильным, едким, неприятным запахом. Т, самовоспл. 490 °С, т. воспл. 34 °С. Концентрационные пределы воспламенения паров в смеси с воздухом 1,1—6,1 % (по объему). Быстро полимеризуется при комнатной температуре в присутствии кислорода, окисляется на свету и на воздухе. Растворимость в воде значительно возрастает в присутствии эмульгаторов по отношению к воде является поверхностно-активным веществом, [c.189]
Чувствительно к воздуху, растворимо в воде с образованием катионов Растворимо в воде, в простых и сложных эфирах, спиртах и т. д. [c.549]
Определенные грани монокристалла нередко можно получить путем раскалывания. Этот метод пригоден для кристаллов с преимущественной спайностью, например, для щелочных и редкоземельных галогенидов, некоторых металлов (5Ь, В1, 2п, С(1) и материалов со слоистыми структурами (графит, слюда). Эти грани обычно покрыты ступеньками скола элементарной и микроскопической высоты, однако они содержат также более или менее протяженные атомно-гладкие зоны. При раскалывании на воздухе растворимых в воде кристаллов, например, большинства щелочных галогенидов, следует учитывать, что содержащиеся в воздухе пары НгО способствуют растворению поверхности кристалла. Поэтому некоторые поверхностные структуры получают этим методом только в том случае, когда раскалывание происходит в вакууме или в осушенной атмосфере. [c.345]
Примечание. Препарат представляет собой бесцветные кристаллы, выветривающиеся на воздухе, растворимые в воде, подкисленной азотной кислотой. [c.144]
Дэви дважды докладывал о своем открытии на заседании Королевского общества Дублина и Британской ассоциации содействия науке [49, 50]. Примечательно, что Дэви пытался выделить карбид калия- в чистом виде и даже определил форму его кристаллов. Описание же свойств углеводорода у Дэви вполне согласуется с современными представлениями об ацетилене. Дэви отмечал легкую воспламеняемость газа, более яркое, чем у этилена, пламя и образование копоти при недостаточном доступе воздуха, растворимость в воде, способность соединяться с хлором (на свету со взрывом и выделением копоти) и вступать в реакции с кислородом и серной кислотой. Статья заканчивалась рассуждениями о> возможном применении газа для искусственного освещения, если удастся добывать его удобно и дешево [50, стр. 63]. По-видимому, Дэви еще неоднократно возвращался к изучению ацетилена, па крайней мере, известно, что он пытался выяснить действие на ацетилен электрических разрядов [51]. В 1839 г. вышла самая большая (и последняя) статья Дэви об ацетилене [52], после чего интересы химика сосредоточились на других проблемах. [c.30]
Угольный ангидрид, или углекислый газ, СОг представляет собою бесцветный газ в 1,5 раза тяжелее воздуха, растворимый в воде. Под давлением в 60 ат углекислый газ переходит в жидкость и хранится в стальных баллонах. При испарении жидкого угольного ангидрида происходит сильное понижение температуры, и он переходит в твердое состояние. [c.259]
Название Плотность, Г/СМЗ Показатель преломления ” кипения пла- вления вспыш- ки самовоспламенения паров в воздухе Растворимость в воде при 20 °С, % Летучесть (по диэтиловому эфиру) Давление паров при 20 С, мм рт. ст. Вязкость при 25 С, сП [c.458]
Нитрат трехвалентного индия, Ih(N03)3-ЗНгО, выделяется в виде бесцветных призматических игольчатых кристаллов, расплывающихся на воздухе, растворимых в воде и спирте. Их получают упариванием раствора металлического индия или гидроокиси трехвалентного индия в избытке азотной кислоты. [c.341]
H4[W( N)g]-бНгО, образующаяся в виде желтого кристаллического порошка, является относительно сильной кислотой. Она устойчива в сухом воздухе, растворима в воде и абсолютном спирте, плохо растворима в эфире и бензо.те, дегидратируется при 60° и разлагается при нагревании до более высокой температуры. [c.358]
Физические свойства. Азот — газ без цвета, запаха и вкуса, легче воздуха. Растворимость в воде меньше, чем у кислорода при 20 в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по [c.185]
Нитрат стронция (8г(>Юз)2). Получают при действии оксида стронция или сульфида стронция на азотную кислоту в виде безводной соли при повышенных температурах или в виде гидратированной соли (с четырьмя молекулами воды) при пониженных температурах. Бесцветный кристаллический порошок, расплывающийся на воздухе, растворимый в воде, разлагающийся при нагревании. Используется в пиротехнике для получения красных огней а также при изготовлении спичек. [c.93]
Ароматические сульфокислоты представляют собой кристаллические, но очень гигроскопичные и расплывающиеся на воздухе растворимые в воде вещества. Они обладают сильно кисяой реакцией и образуют устойчивые, в большинстве случаев хорошо кристаллизующиеся соли. Щелочные соли сульфокислот легко растворимы в воде. [c.533]
В плане первичной информации о веществе представляются сведения о способе производства и областях применения уровне загрязнения воздуха, описываются условия поступления вещества в воздух и агрегатное состояние. Необходимо иметь структурную формулу вещества, данные о молекулярной массе, плотности, точке кипения (плавления), упругости паров при 20°С, стойкости (гидролиз, окисление и т. д.) и возможных продуктах превращения в воздухе, растворимости в воде, жирах и других средах. Желательно привести коэффициент растворимости паров в воде, показатель преломления, поверхностного натяжения, энергию разрыва связи и др. Обязательно наличие метода количественного определения вещества в воздухе, отвечающего ГОСТу 12.1.005-76 ССБТ. Воздух рабочей зоны. Общие санитарно-гигиенические требования . [c.112]
Свойства. Крупные синие кристаллы, в сухом состоянии совершенно устойчивые иа воздухе. Растворы rS04 моментально окисляются при доступе кислорода воздуха. Растворимость в воде при 0°С 21 г/100 г HjO, Кристаллическая структура триклинная, изотипна с uS04-5H20. [c.1612]
Никель двухлористый №С12-6Н20. ГОСТ 4038 —79, ч. Кристаллы светло-зеленого цвета, слегка выветривающиеся на сухом и расплывающиеся на влажном воздухе. Растворимость в воде — до 400 г/л. Упаковка—стеклянные или полиэтиленовые пакеты или мешки вместимостью до 35 кг [c.161]
ZnS04-7H20. ГОСТ 4174—77, ч. Белый кристаллический порошок или кристаллы, выветривающиеся на сухом воздухе, растворимый в воде и нерастворимый в спирте, раздражающе действует на кожные покровы и слизистые оболочки. Тара — стеклянные, полиэтиленовые нли пропиленовые баики вместимостью до 5 кг Эмаль АС-588. ТУ 6-10-936—77, черная электропроводная, наносится пневмораспылителем или кистью. Время высыхания эмали до III степени прн 20 2 °С — не более 1 ч. Адгезия покрытия [c.166]
Технический продукт — вещество с точкой плавления 32° С, точка кипения 163—165° С при 14 мм рт. ст., упругость паров 3.5 10″ мм рт. ст. при 20° С,. летучесть при 20° С, — 4 мг/м воздуха, растворимость в воде при 20° С — 0,25 г на 1 л. В нейтральной п щелочной среде гидролизуется с образованием -формил-хлортолуидина и [c.167]
Калий углекислый (поташ) К2СО3 — белый мелкокристаллический порошок, гигроскопичный на воздухе, растворимый в воде с образованием раствора со щелочной реакцией. [c.345]
Са(Н2Р04)2-HzO бесцветные триклинные кристаллы с плотностью 2,22 г см . Устойчивы на воздухе, растворимы в воде, образуют с аммиаком аддукты Са(Н2Р04)г wH20-NH3 in = 1, 2, 4), а при нагревании разлагаются [c.215]
Соли типа MeJfWs lgl (где Ме —щелочной металл) кристаллизуются в гексагональной системе (изоморфны друг другу), окрашены в зеленовато-желтый цвет, диамагнитны, медленно окисляются на воздухе, растворимы в воде, если катионами являются Na” , К” , Rb” , s” , а также в случае комплексных катионов. [c.354]
Сульфат магния. В эту товарную позицию включаются искусственный сульфат магния (MgS04.7H20) (горькая соль, соли Зайдлица) получают при очистке кизерита или действием серной кислоты на доломит. Бесцветные кристаллы, слегка выветривающиеся на воздухе, растворимые в воде. Используется как наполнитель в текстильной промышленности, при дублении, для приготовления огнестойких составов, как слабительное. [c.88]
Гексацианоферрат тетранатрия (Ка4ре(СМ)б).10Н20). Желтые кристаллы, не изменяющиеся на воздухе, растворимые в воде, особенно в горячей. Используется для получения цианида водорода и прусского голубого, тиоиндиго и т.д. для химико-термического упрочнения поверхности стали, в фотографии при крашении (как протрава и для придания голубого оггенка) в печатном деле (как окислитель в черно-белой анилиновой печати) и как фунгицид. [c.103]
Краткий справочник по химии (1965) — [
c.459
]
Лекционные опыты по общей химии (1950) — [
c.47
]
Справочник сернокислотчика Издание 2 1971 (1971) — [
c.13
]
Краткий справочник химика Издание 4 (1955) — [
c.273
]
Краткий справочник химика Издание 7 (1964) — [
c.328
]
Практикум по общей химии Издание 2 1954 (1954) — [
c.95
]
Практикум по общей химии Издание 3 (1957) — [
c.96
]
Практикум по общей химии Издание 4 (1960) — [
c.96
]
Практикум по общей химии Издание 5 (1964) — [
c.105
]
Справочник химика Том 5 Издание 2 (1966) — [
c.25
]
Справочник химика Изд.2 Том 5 (1966) — [
c.25
]
Источник
