Какие свойства проявляет бензол

Наверно каждый человек помнит о таком веществе, как бензол, еще с курса органической химии. Данное углеводородное соединение было открыто химиком Фарадеем в 1825 г., однако название «бензол» оно приобрело еще в далеком XVII веке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола – C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
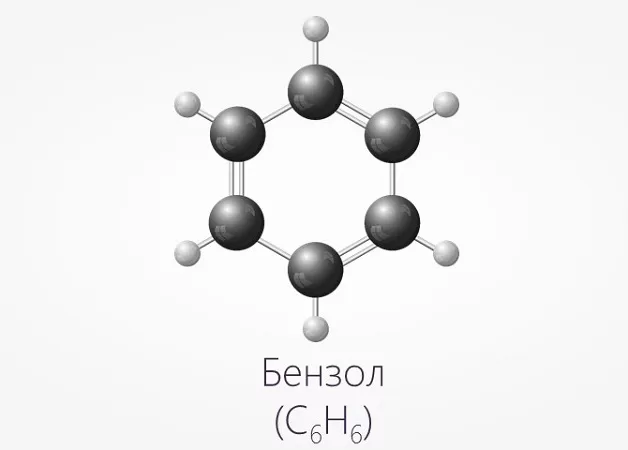
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
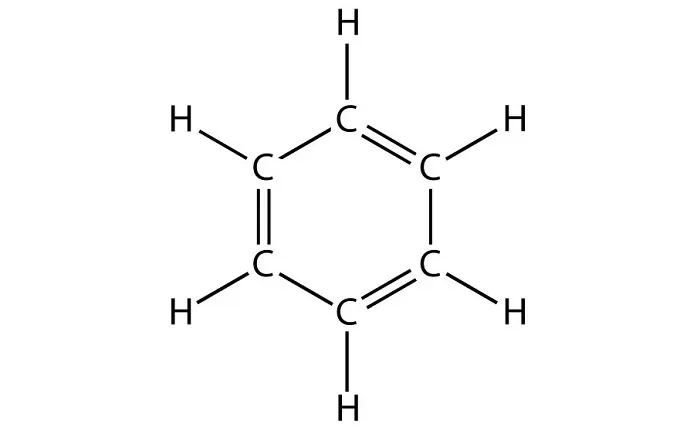
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,50C;
температура кипения — 800C;
общая плотность вещества — 0,879 г/см3;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 250C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
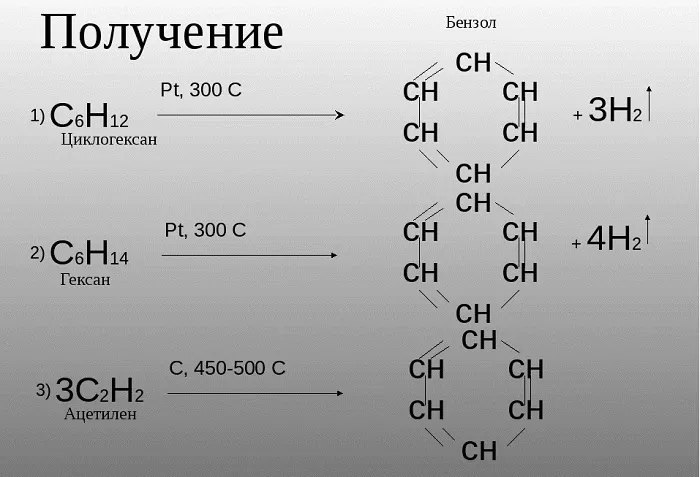
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
3HС ≡ CH (Cакт., 550C) → C6H6
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
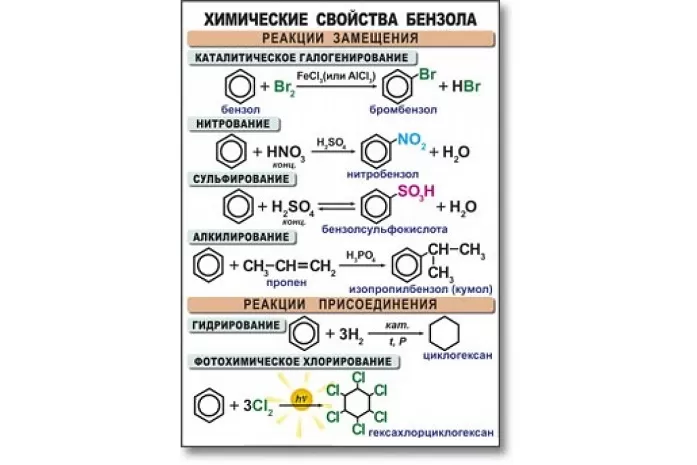
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
С6H6 + 3Cl2 → C6H5Cl + Hcl2;
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
C6H6 + C2H5Br → C6H5C2H5 + HBr3;
- нитрование и сульфирование бензола:
C6H6 + H2SO4 → C6H5SO3H + H2O,
C6H6 + HNO3 → C6H5NO2 + H2O;
- галогенирование бензола:
С6H5 – CH3 + Br = C6H5 – CH2Br + HBr;
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
C6H5CH3 + [O] → C6H5COOH.
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
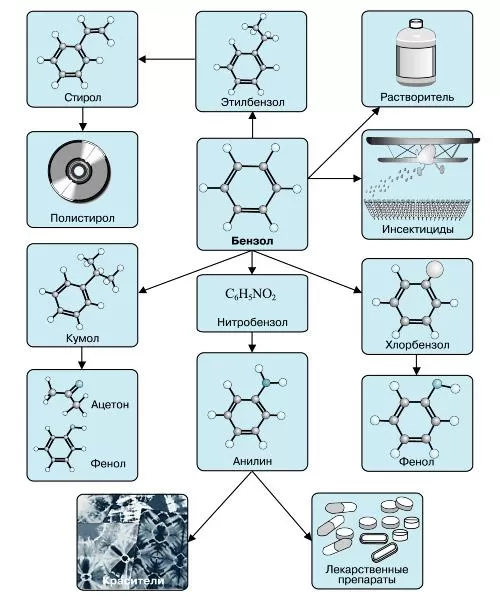
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
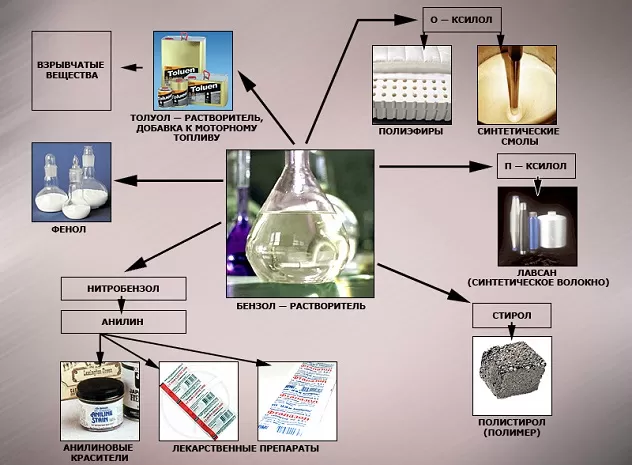
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Источник
Что такое бензол?
Бензол – это органическое вещество, при обычных условиях представляет собой бесцветную жидкость со специфическим сладковатым запахом. Является простейшим ароматическим углеводородом. Входит в состав сырой нефти. Не растворим в воде, сильно токсичен. Химическая формула C6H6. Первый раз был получен Майклом Фарадеем, который выделил его из конденсата светильного газа (смесь водорода 50 %, метана 34 %, угарного газа 8 %).
Физические и химические свойства
Молярная масса равна 78,11 г/моль. При температуре 80,1 °C начинает кипеть, при -5 °С — плавиться. Плотность равна 0.879 г/см³. Вступает в реакции замещения:
· галогенирования, при котором атом водорода заменяется хлором или бромом, такие реакции проходят при нагревании с обязательным участием катализатора;
· нитрования (введение нитрогруппы в бензольное кольцо), итогом которой становится тяжёлая желтоватая жидкость с запахом горького миндаля – нитробензол, такая реакция может использоваться как качественная на определение;
· алкилирование галогеналканами (реакция Фриделя-Крафтса), эта реакция позволяет ввести углеводородный радикал в бензольное кольцо, и считается одним из методов получения гомологов бензола;
· алкилирование алкенами.
Бензол может вступать в реакцию горения, в результате которой образуются вода и углекислый газ.
Получение
Сейчас существует несколько методов получения бензола:
· добыча методом коксования каменного угля – активно применялась почти до середины ХХ века, бензол, полученный таким способом, не подходит для некоторых технологических процессов в современном производстве;
· методика аромаизинга бензиновых фракций нефти используется в США (в РФ и странах Европы этим методом получают половину всего бензола);
· термическое разложение тяжелых и лёгких фракций нефти – во время процесса попутно образуются толуол и ксилолы, обычно их сразу отправляют на процесс деалкилирования, и тоже получают бензол;
· тримеризация ацетилена – газ пропускают при высокой температуре над средой из активированного угля, при этом образуется бензол, плюс еще несколько ароматических углеводородов.
Важно: мировой спрос на бензол сейчас составляет более 42 млн. т, по прогнозам экспертов, к концу 2020 года эта цифра составит более 57 млн. т. Ежегодно даже рынку США не хватает ~600 тысяч тонн этого вещества.
Применение
Почему бензола требуется так много? Он необходим в производстве синтетического каучука (резина для автомобильных шин), пластмассы, синтетического волокна, красителей, ПАВ и пр. Бензол может использоваться как растворитель и экстрагент в промышленном производстве красок, его добавляют в бензин для повышения октанового числа (не более 1% по современным нормам).
Опасен ли бензол?
Влияние на человека
Это вещество является самым распространённым ксенобиотиком антропогенного происхождения (чужеродное для живых организмов вещество, не участвующее в естественном биотическом круговороте). Внимание! Бензол сильно ядовит – минимальная смертельная доза при приеме внутрь составляет всего 15 миллилитров. Он относится к веществам третьего класса опасности для человека по мировому стандарту NFPA 704 (как хлор и серная кислота). Его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Сильный канцероген.
Горючесть
Быстро испаряется при нормальном атмосферном давлении и температуре, легко рассеивается в воздухе и легко возгорается. Температура вспышки ниже 23 °C. Поэтому по стандарту NFPA 704 это вещество имеет четвёртый класс, то есть является максимально огнеопасным.
Меры предосторожности
Работа с бензолом строго регламентируется. Во время лабораторных экспериментов его рекомендуется использовать в малом количестве (не более 50 мл). Все действия должны проводиться в защитных перчатках из фторкаучука, так же обязательна защита глаз и органов дыхания. Запрещается работать в закрытом, невентилируемом помещении, с температурой воздуха больше 30°С.
Купить бензол вы можете в магазине Химик24. Реализация оптом и в розницу.
Источник
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120о. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:

Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; toпл= 5,5оС; toкип. = 80оС; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование

2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование

4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:

Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):

II. Реакции присоединения
1.Гидрирование

2.Присоединение хлора

III. Реакции окисления
1. Горение
2С6Н6 + 15О2 → 12СО2 + 6Н2О
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
В промышленности:
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:

4) тримеризация ацетилена:

В лаборатории:
Сплавление солей бензойной кислоты со щелочами:

Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:

а) галогенирование

При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:

б) нитрование

в) сульфирование

г) алкилирование

2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:

При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

II. Реакции присоединения
Гидрирование

III.Реакции окисления
1.Горение
C6H5CH3 + 9O2 → 7CO2 + 4H2O
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:

В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):

Источник
(Слайд 2).
Цель и задачи урока:
– систематизировать знания учащихся о
строении молекулы бензола, о способах его
получения;
– сформировать представление о физических и
химических свойствах бензола, научить
составлять уравнения химических реакций,
характерных для бензола;
– продолжить формирование умений учащихся
работать с видеоматериалами и мультимедийными
презентациями.
Формы работы: фронтальная, индивидуальная.
Оборудование: компьютер, мультимедийный
проектор, таблицы “Бензол”
Ход урока
I. Организационный момент.
Учитель: Тема, цели, и задачи урока.
II. Активизация знаний учащихся.
- Фронтальный опрос
. (Слайд 3).
- Ароматические углеводороды – АРЕНЫ
- Дайте определение ароматическим углеводородам.
- Почему их называют ароматическими?
- Типичным представителем ароматических
углеводородов является …? - С чьими именами связано происхождение бензола?
- Какова молекулярная формула бензола?
- Сколько структурных формул бензола?
- Тип гибридизации?
- Какие связи в молекуле бензола и скольких?
- Важнейшие источники получения ароматических
углеводородов? - Другие методы получения?
- Назовите гамологов бензола.
- Строение молекулы бензола
- Самостоятельная работа учащихся
(сообщение
ученика). (Слайд 4).
(на 5-7
минут). (Слайд 5).
- заполните пропуски в определении ароматических
углеводородов; - напишите формулы заданных веществ;
- закончите урванения реакций получения
ароматических углеводородов.
III. Изучение нового материала.
1. Физические свойства бензола. (Слайд 6).
Бензол – бесцветная, летучая,
огнеопасная жидкость с неприятным запахом. Он
легче воды ( =0,88 г/см3) и с ней не смешивается, но
растворим в органических растворителях, и сам
хорошо растворяет многие вещества. Бензол кипит
при 80,1 С, при охлаждении легко застывает в белую
кристаллическую массу. Бензол и его пары
ядовиты. Систематическое вдыхание его паров
вызывает анемию и лейкемию.
– Видеоматериал (физические свойства бензола).
2. Химические свойства бензола.
1) Химические свойства бензола определяется
строением его молекулы.
2) Ароматическая -система обладает повышенной
устойчивостью.
3) Поэтому хотя бензол является непредельным
углеводородом, он проявляет свойства,
характерные для предельных (склонность к
реакциям замещения, устойчивость к действию
окислителей).
Реакции замещения.
Реакции присоединения (Слайд 9).
При определенных условиях бензол
может вступать и в реакции присоединения. В этих
реакциях разрушается ароматическая система,
поэтому для их протекания требуется жесткие
условия.
Реакции окисления. (Слайд 10).
а) отношение бензола к бромной воде и к
перманганату калия (видеоматериал)
б) горение бензола
2C6H6 + 15O2 –> 2CO2 + 6H2O
IV. Закрепление.
(Слайд 11).
- Бензол реагирует с каждым веществом набора:
а) Br2, O2, KMnO4
б) H2O, HNO3, CI2
в) CI2, O2, HNO3
г) HCI, Br2, H2
Напишите уравнения реакций бензола с
веществами этого набора, укажите условия их
протекания.
V. Домашнее задание.
Определите вещества Х, Y, Z в схеме
превращений:
Литература:
- Рудзитис Г.Е., Фельдман Ф.Г. Органическая химия:
Учебник для 10 классов общеобразовательных
учреждений. – 8-е изд. – М.: Просвещение, 2002. - Новошинский И.И., Новошинская Н.С. Органическая
химия. 11 кл.: Учебник для общеобразовательных
учреждений. – М.: Издательство “Образование”,
2005.
Презентация
Источник
