Какие свойства проявляет фенол при взаимодействии со щелочами
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: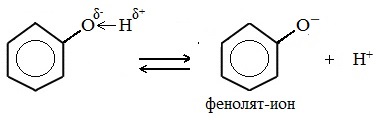
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: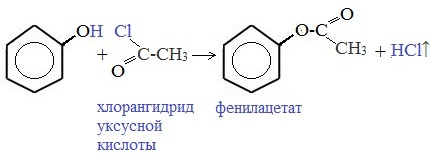
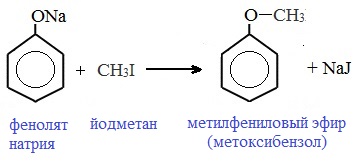
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
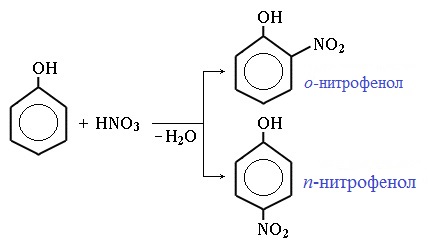
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):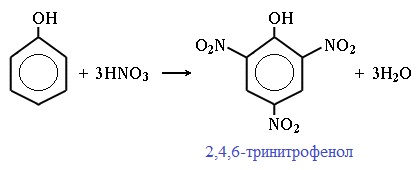
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

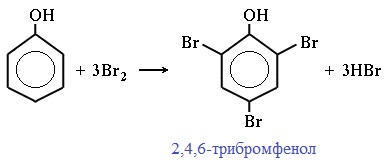
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: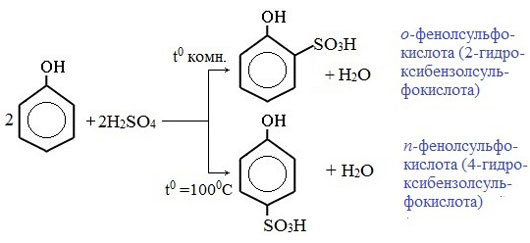 Реакции присоединения
Реакции присоединения
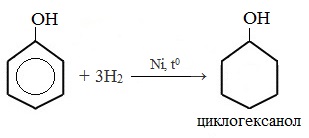
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
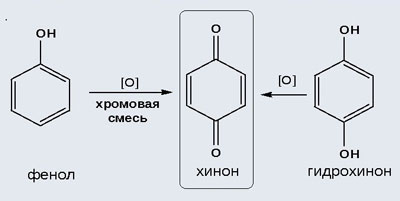
IV. Качественная реакция! – обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

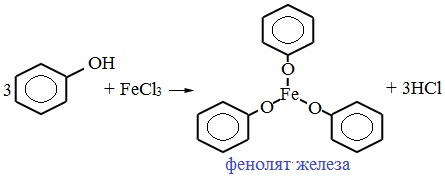
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
1. Фенолы – производные
ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН)
непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные
фенолы в зависимости от количества ОН-групп в молекуле:

В соответствии с количеством
конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро –
производные бензола), нафтолы (2 конденсированных ядра – производные
нафталина), антранолы (3 конденсированных ядра – производные антрацена) и
фенантролы:

3. Изомерия и номенклатура фенолов
Возможны
2 типа изомерии:
- изомерия
положения заместителей в бензольном кольце
- изомерия
боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют
тривиальные названия, сложившиеся исторически. В названиях замещенных
моноядерных фенолов используются также приставки орто-, мета- и
пара -, употребляемые в номенклатуре ароматических соединений. Для более
сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с
помощью цифровых индексов указывают положение заместителей
4. Строение молекулы
Фенильная группа C6H5 –
и гидроксил –ОН взаимно влияют друг на друга
- неподеленная электронная пара атома кислорода притягивается 6-ти
электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее
поляризуется. Фенол – более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака,
электронная плотность повышается в положении 2, 4, 6. Это делает более
реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного
кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных
условиях представляют собой бесцветные кристаллические вещества с невысокой температурой
плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо
растворяются в органических растворителях, токсичны, при хранении на воздухе
постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая
кислота) — бесцветное
кристаллическое вещество на воздухе окисляется и становится розовым, при
обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с
водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги
кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций
нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки
глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается
даже через неповрежденные участки кожи и уже через несколько минут начинает
воздействовать на ткани головного мозга. Сначала возникает кратковременное
возбуждение, а потом и паралич дыхательного центра. Даже при воздействии
минимальных доз фенола наблюдается чихание, кашель, головная боль,
головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления
характеризуются бессознательным состоянием, синюхой, затруднением дыхания,
нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом,
нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1.
Производство синтетических
смол, пластмасс, полиамидов
2.
Лекарственных препаратов
3.
Красителей
4.
Поверхностно-активных веществ
5.
Антиоксидантов
6.
Антисептиков
7.
Взрывчатых веществ
8. Получение фенола в
промышленности
1). Кумольный
способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества
метода: безотходная технология (выход полезных продуктов > 99%) и
экономичность. В настоящее время кумольный способ используется как основной в
мировом производстве фенола.
2).
Из каменноугольной смолы(как побочный
продукт – выход мал):
C6H5ONa + H2SO4(разб) → С6H5 – OH + NaHSO4
фенолят натрия
(продукт обработки смолы едким натром)
3).
Из галогенбензолов:
С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
4).
Сплавлением солей ароматических сульфокислот с твёрдыми щелочами:
C6H5-SO3Na + NaOH t→ Na2SO3 + С6H5 – OH
натриевая соль
бензолсульфокислоты
9. Химические свойства фенола (карболовой кислоты)
I.Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов
не меняют):
- С активными
металлами–
2C6H5-OH + 2Na → 2C6H5-ONa
+ H2
фенолят натрия
- Со щелочами –
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты,
разлагаются угольной кислотой –
C6H5-ONa
+ H2O + СO2 → C6H5-OH + NaHCO3
По
кислотным свойствам фенол превосходит этанол в 106 раз. При этом во
столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол
не может вытеснить угольную кислоту из её солей
C6H5–OH + NaHCO3 =реакция не идёт – прекрасно
растворяясь в водных растворах щелочей, он фактически не растворяется в водном
растворе гидрокарбоната натрия.
Кислотные
свойства фенола усиливаются под влиянием связанных с бензольным кольцом
электроноакцепторных групп (NO2–, Br–)
C6H5–OH< п-нитрофенол <
2,4,6-тринитрофенол
2,4,6-тринитрофенол или пикриновая кислота сильнее
угольной
II. Свойства бензольного кольца
1).
Взаимное
влияние атомов в молекуле фенола проявляется не только в особенностях поведения
гидроксигруппы (см. выше), но и в большей реакционной способности
бензольного ядра. Гидроксильная группа повышает электронную плотность в
бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект
ОН-группы):
Поэтому фенол
значительно активнее бензола вступает в реакции электрофильного замещения в
ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3
фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3
образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной
температуре взаимодействует с бромной водой с образованием белого осадка
2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с
альдегидами.
Например:
Фенолформальдегидные смолы
2).
Гидрирование фенола
C6H5-OH + 3H2Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная
реакция – обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5–OH)3](C6H5O)3 + 3HCl
FeCl3 – светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 – фиолетовый раствор
Видео-опыты:
Изучение физических свойств фенола
Взаимодействие фенола сметаллическим натрием
Взаимодействие фенола с раствором щелочи
Качественная реакция на фенол
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ:
Качественные реакции спиртов и фенола
Источник
Ôåíîëû – ïðîèçâîäíûå àðîìàòè÷åñêèõ óãëåâîäîðîäîâ, â ñîñòàâ êîòîðûõ ìîãóò âõîäèòü îäíà èëè íåñêîëüêî ãèäðîêñèëüíûõ ãðóïï, ñîåäèíåííûõ ñ áåíçîëüíûì êîëüöîì.
Êàê íàçûâàòü ôåíîëû?
Ïî ïðàâèëàì ÈÞÏÀÊ ñîõðàíÿåòñÿ íàçâàíèå «ôåíîë». Íóìåðàöèÿ àòîìîâ èäåò îò àòîìà, êîòîðûé íåïîñðåäñòâåííî ñâÿçàí ñ ãèäðîêñè-ãðóïïîé (åñëè îíà – ñòàðøàÿ) è íóìåðóþò òàê, ÷òîáû çàìåñòèòåëè ïîëó÷èëè íàèìåíüøèé íîìåð.
Ïðåäñòàâèòåëü – ôåíîë – Ñ6Í5ÎÍ:
Ñòðîåíèå ôåíîëà.
Ó àòîìà êèñëîðîäà íà âíåøíåì óðîâíå íàõîäèòñÿ íåïîäåëåííàÿ ýëåêòðîííàÿ ïàðà, êîòîðàÿ «âòÿãèâàåòñÿ» â ñèñòåìó êîëüöà (+Ì-ýôôåêò ÎÍ-ãðóïïû). Â ðåçóëüòàòå ìîãóò âîçíèêíóòü 2 ýôôåêòà:
1) ïîâûøåíèå ýëåêòðîííîé ïëîòíîñòè áåíçîëüíîãî êîëüöà â ïîëîæåíèÿ îðòî- è ïàðà-. Â îñíîâíîì, òàêîé ýôôåêò ïðîÿâëÿåòñÿ â ðåàêöèÿõ ýëåêòðîôèëüíîãî çàìåùåíèÿ.
2) óìåíüøàåòñÿ ïëîòíîñòü íà àòîìå êèñëîðîäà, âñëåäñòâèå ÷åãî ñâÿçü Î-Í îñëàáëÿåòñÿ è ìîæåò ðâàòüñÿ. Ýôôåêò ñâÿçàí ñ ïîâûøåííîé êèñëîòíîñòè ôåíîëà ïî ñðàâíåíèþ ñ ïðåäåëüíûìè ñïèðòàìè.
Ìîíîçàìåùåííûå ïðîèçâîäíûå ôåíîëà (êðåçîë) ìîãóò áûòü â 3õ ñòðóêòóðíûõ èçîìåðàõ:

Ôèçè÷åñêèå ñâîéñòâà ôåíîëîâ.
Ôåíîëû – êðèñòàëëè÷åñêèå âåùåñòâà ïðè êîìíàòîé òåìïåðàòóðå. Ïëîõî ðàñòâîðèìû â õîëîäíîé âîäå, íî õîðîøî – â ãîðÿ÷åé è â âîäíûõ ðàñòâîðàõ ùåëî÷åé. Îáëàäàþò õàðàêòåðíûì çàïàõîì. Âñëåäñòâèå îáðàçîâàíèÿ âîäîðîäíûõ ñâÿçåé, îáëàäàþò âûñîêîé òåìïåðàòóðîé êèïåíèÿ è ïëàâëåíèÿ.
Ïîëó÷åíèå ôåíîëîâ.
1. Èç ãàëîãåíáåíçîëîâ. Ïðè íàãðåâàíèè õëîðáåíçîëà è ãèäðîêñèäà íàòðèÿ ïîä äàâëåíèåì ïîëó÷àþò ôåíîëÿò íàòðèÿ, êîòîðûé ïîñëå âçàèìîäåéñòâèÿ ñ êèñëîòîé, ïðåâðàùàåòñÿ â ôåíîë:
2. Ïðîìûøëåííûé ñïîñîá: ïðè êàòàëèòè÷åñêîì îêèñëåíèè êóìîëà íà âîçäóõå ïîëó÷àåòñÿ ôåíîë è àöåòîí:

3. Èç àðîìàòè÷åñêèõ ñóëüôîêèñëîò ñ ïîìîùüþ ñïëàâëåíèÿ ñ ùåëî÷àìè. ×àùå ïðîâîäÿò ðåàêöèþ äëÿ ïîëó÷åíèÿ ìíîãîàòîìíûõ ôåíîëîâ:

Õèìè÷åñêèå ñâîéñòâà ôåíîëîâ.
ð-îðáèòàëü àòîìà êèñëîðîäà îáðàçóåò ñ àðîìàòè÷åñêèì êîëüöîì åäèíóþ ñèñòåìó. Ïîýòîìó ýëåêòðîííàÿ ïëîòíîñòü íà àòîìå êèñëîðîäå óìåíüøàåòñÿ, â áåíçîëüíîì êîëüöå – óâåëè÷èâàåòñÿ. Ïîëÿðíîñòü ñâÿçè Î-Í ïîâûøàåòñÿ, è âîäîðîä ãèäðîêñèëüíîé ãðóïïû ñòàíîâèòñÿ áîëåå ðåàêöèîíîñïîñîáíûì è ëåãêî ìîæåò áûòü çàìåùåí àòîìîì ìåòàëëà äàæå ïðè äåéñòâèè ùåëî÷åé.
Êèñëîòíîñòü ôåíîëîâ âûøå, ÷åì ó ñïèðòîâ, ïîýòîìó ìîæíî ïðîâîäèòü ðåàêöèè:
Íî ôåíîë – ñëàáàÿ êèñëîòà. Åñëè ÷åðåç åãî ñîëè ïðîïóñêàòü óãëåêèñëûé èëè ñåðíèñòûé ãàç, òî âûäåëÿåòñÿ ôåíîë, ÷òî äîêàçûâàåò, ÷òî óãîëüíàÿ è ñåðíèñòàÿ êèñëîòà ÿâëÿþòñÿ áîëåå ñèëüíûìè êèñëîòàìè:
Êèñëîòíûå ñâîéñòâà ôåíîëîâ îñëàáëÿþòñÿ ïðè ââåäåíèè â êîëüöî çàìåñòèòåëåé I ðîäà è óñèëèâàþòñÿ – ïðè ââåäåíèè II.
2) Îáðàçîâàíèå ñëîæíûõ ýôèðîâ. Ïðîöåññ ïðîòåêàåò ïðè âîçäåéñòâèå õëîðàíãèäðèäîâ:
3) Ðåàêöèÿ ýëåêòðîôèëüíîãî çàìåùåíèÿ. Ò.ê. ÎÍ-ãðóïïà ÿâëÿåòñÿ çàìåñòèòåëåì ïåðâîãî ðîäà, òî ðåàêöèîííàÿ ñïîñîáíîñòü áåíçîëüíîãî êîëüöà â îðòî- è ïàðà- ïîëîæåíèÿõ ïîâûøàåòñÿ. Ïðè äåéñòâèè íà ôåíîë áðîìíîé âîäû íàáëþäàåòñÿ âûäåëåíèå îñàäêà – ýòî êà÷åñòâåííàÿ ðåàêöèÿ íà ôåíîë:

4) Íèòðîâàíèå ôåíîëîâ. Ðåàêöèþ ïðîâîäÿò íèòðèðóþùåé ñìåñüþ, â ðåçóëüòàòå ÷åãî îáðàçóåòñÿ ïèêðèíîâàÿ êèñëîòà:

5) Ïîëèêîíäåíñàöèÿ ôåíîëîâ. Ðåàêöèÿ ïðîòåêàåò ïîä âîçäåéñòâèè êàòàëèçàòîðîâ:

6) Îêèñëåíèå ôåíîëîâ. Ôåíîëû ëåãêî îêèñëÿþòñÿ êèñëîðîäîì âîçäóõà:

7) Êà÷åñòâåííîé ðåàêöèåé íà ôåíîë ÿâëÿåòñÿ âîçäåéñòâèå ðàñòâîðà õëîðèäà æåëåçà è îáðàçîâàíèå êîìïëåêñà ôèîëåòîâîãî öâåòà.
Ïðèìåíåíèå ôåíîëîâ.
Ôåíîëû èñïîëüçóþò ïðè ïîëó÷åíèè ôåíîëôîðìàëüäåãèäíûõ ñìîë, ñèíòåòè÷åñêèõ âîëîêîí, êðàñèòåëåé è ëåêàðñòâåííûõ ñðåäñòâ, äåçèíôèöèðóþùèõ âåùåñòâ. Ïèêðèíîâàÿ êèñëîòà èñïîëüçóåòñÿ â êà÷åñòâå âçðûâ÷àòûõ âåùåñòâ.
Источник
