Какие свойства проявляет фосфин кислотные или основные почему
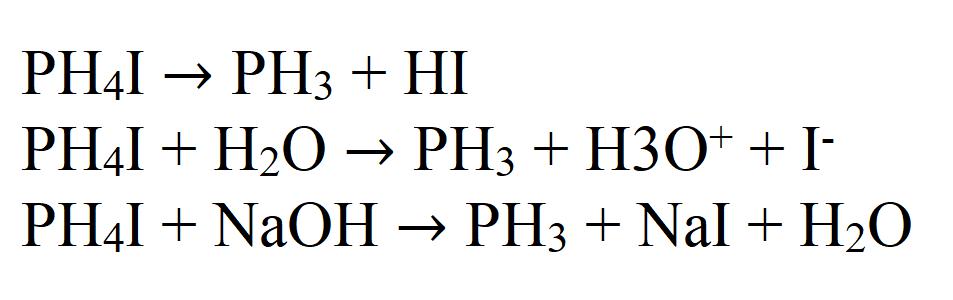
Фосфор
Следующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
 Красный фосфор
Красный фосфор
Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + P2↑
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 оС. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 оС) и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи. Несколько отличен от них «фиолетовый фосфор», который состоит из группировок Р8 и Р9, уложенных в длинные трубчатые структуры с пятиугольным сечением.
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.
 Аллотропные модификации фосфора
Аллотропные модификации фосфора
Химические свойства
Наиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
2P + 3Ca = Ca3P2
P + 3Na = Na3P
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
4Р + 3О2 = 2Р2О3
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
4Р + 5О2 = 2Р2О5
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
2Р + 5Cl2(изб.) = 2PCl5
2P + 3Cl2(недост.) = 2PCl3
2P + 5S(изб.) = P2S5
2P + 3S(недост.) = P2S3
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с разбавленной азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
— с концентрированной азотной кислотой:
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
— с концентрированной серной кислотой:
2P + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O
С другими кислотами фосфор не взаимодействует.
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
4P + 3KOH + 3H2O = PH3↑ + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2)2
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Применение фосфора
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
Фосфин
Наиболее известным водородным соединением фосфора является фосфин РН3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Zn3P2 + 6HCl = 2PH3↑ + 3ZnCl2
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
PH3 + H2O ⇄ PH3∙H2O ⇄ PH4+ + OH—
Соли фосфония образуются только с сильными кислотами:
PH3 + HCl = PH4Cl
PH3 + HClO4 = PH4ClO4
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 оС самовоспламеняется на воздухе:
2PH3 + 4O2 = P2O5 + 3H2O
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
PH3 + 8AgNO3 + 4H2O = H3PO4 + 8Ag + 8HNO3
Скачать:
Скачать бесплатно реферат на тему: «Фосфор»
Фосфор.doc (114 Загрузок)
а также на тему: «Фосфор и его соединения»
Фосфор-и-его-соединения.doc (122 Загрузки)
Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Источник
Формула фосфина ……………………………………………………………..РН3
Молекулярная масса …………………………………………………………34,04
Цвет и вид……………………………………………….Бесцветный газ.
Температура плавления…………………………………….. – 133,5°С.
Температура кипения……………………………………………. -87,7°С.
Давление при испарении……………40 мм рт. ст. при – 129,4°С.
Растворимость в воде……………………26% от объема при 17°С.
Плотность……………………..1,18 (0°С, 760 мм рт. ст.) (Воздух-1).
Температура вспышки……………………………………………..100°С.
Нижний предел взрываемости……….. 1,79-1,89% от объема;
Появление запаха при……………………………………………..1,3 – 2,6 ррт.
При сравнительно высоких концентрациях фосфин взрывоопасен.
Нижний концентрационный предел воспламеняемости (НКПВ) – 1,79-1,89%
по объему или ………………………………..26,15-27,60 г/м3, или 17000-18900 мл/м3.
Скрытая теплота испарения фосфина равна …………………………………102,6 кал/г.
Растворимость в воде составляет 0,52 г/л при температуре 200С и давлении 34,2 кгс/см2.
Фосфин – высокотоксичный ,бесцветный газ который тяжелее воздуха в 1,5 раза, поэтому при применении легко проникает во все щели и труднодоступные места в помещениях и эффективно уничтожает яйца, личинки, куколки и взрослых насекомых.
Плохо растворяется в воде, не реагирует с ней. Растворим в бензоле, диэтиловом эфире, сероуглероде. Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу.
Применение фосфина. При проведении фумигации фосфином используются неорганические препараты на основе фосфидов алюминия и магния. Объекты и технология применения препаратов на основе фосфида магния идентичны с препаратами на основе фосфида алюминия. Допуск людей и загрузку складов разрешают после полного проветривания и при содержании фосфина в воздухе рабочей зоны не выше ПДК (0,1 мг/ м³). Реализацию продукции осуществляют при остатке фосфина не выше МДУ (0,1 мг/кг для зерна, 0,01 мг/кг – для продуктов переработки зерна).
Газ Фосфин является сильным ядом для человека и других теплокровных животных. Острое отравление фосфином происходит при концентрации его в воздухе – 568 мг/м3. Газ фосфин обладает высокой токсичностью в отношении насекомых – вредителей хлебных запасов. При работе с ним желательно иметь представление о способе и механизме действия на вредные организмы. Предельно допустимая концентрация (ПДК) фосфина в воздухе рабочей зоны сотавляет 0,1 мг/м3. Однако запах газа начинает ощущаться при меньших концентрациях (около 0,03 мг/м3). Максимально допустимый уровень (МДУ) фосфина в зерне – 0,01 мг/кг, в зернопродуктах остатки фосфина не допускаются. Зерно и продукты его переработки могут быть использованы для пищевых целей только при условии, если остаточные количества фосфина в них не будут превышать МДУ.
Газ Фосфин слабо сорбируется зерном и зернопродуктами, поэтому легко дегазируется. В рекомендуемых для дезинсекции нормах расхода он не изменяет качества зерна и не ухудшает его семенных достоинств. Впервые он был применен в 1934 г. для фумигации зерновой продукции. В настоящее время, ввиду запрета на применение бромистого метила в целях фумигации, фосфин является основным фумигантом, предназначенным для борьбы с вредными насекомыми.
Источник
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
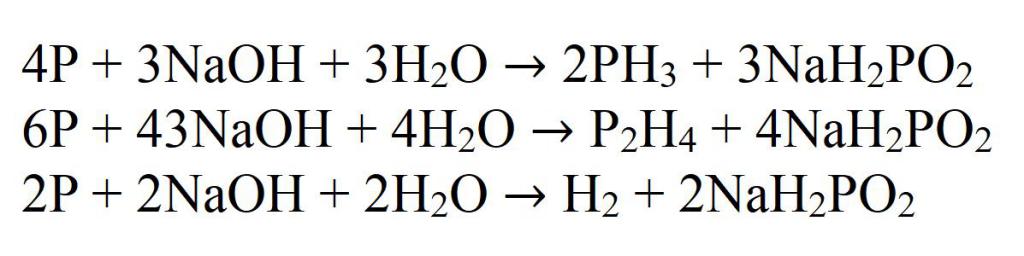
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
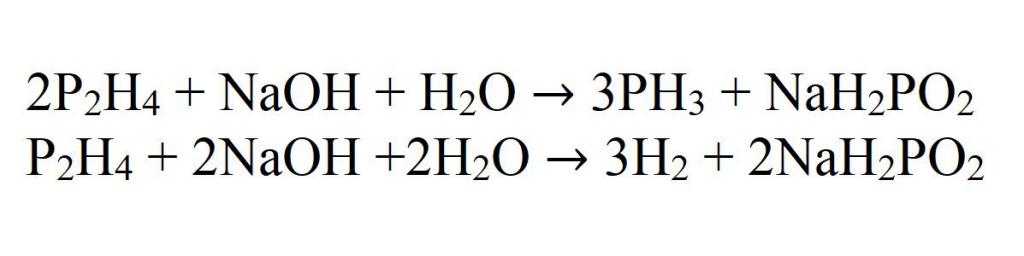
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
NaH2PO2 + 2NaOH = 2H2 + Na3PO4
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
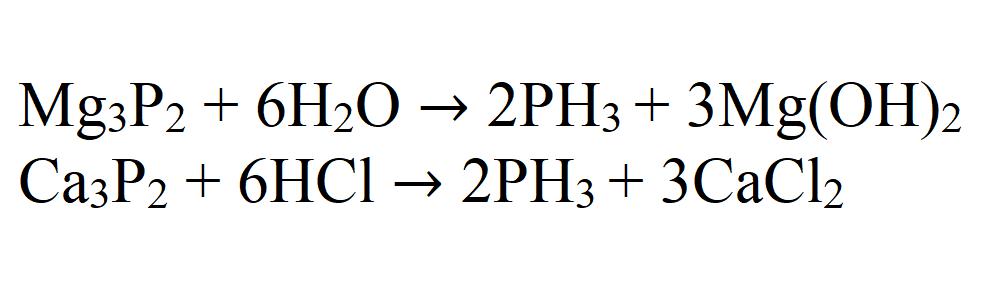
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
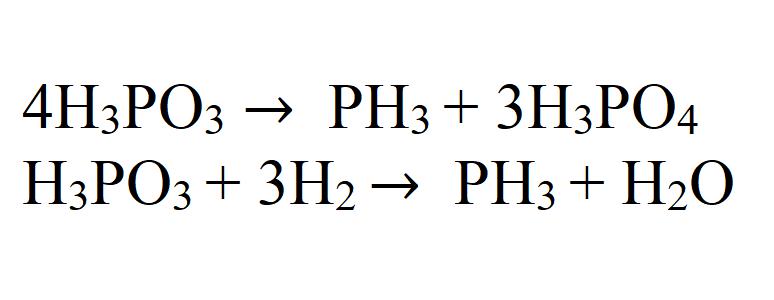
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
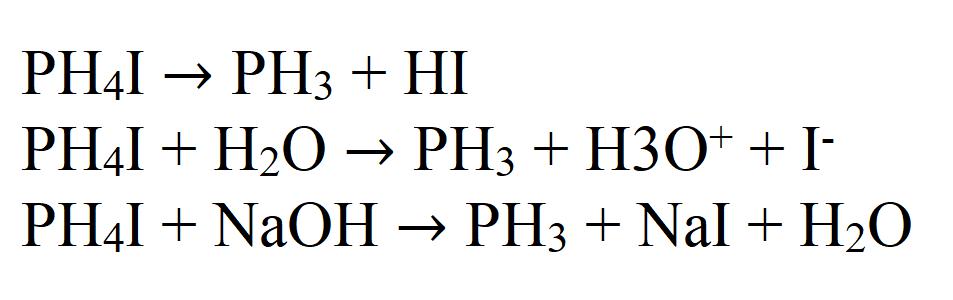
Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см3.
Химические свойства
Как уже было сказано, химическая формула фосфина – PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
2PH3 → 2P + 3H2
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
PH3 + 2O2 → H3PO4
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
2PH3 + 4O2 → P2O5 + 3H2O
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
PH3 + HI→ PH4I
PH3 + HCl→ PH4Cl
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
PH3 + 2I2+ 2H2O → H3PO2 + 4HI
PH3 + 8HNO3→ H3PO4 + 8NO2 + 4H2O
Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м3. Концентрация 10 мг/м3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Источник
Фосфин
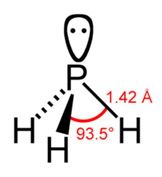
Водородное соединение фосфора – фосфин РН3. Строение молекулы фосфина похоже на строение молекулы аммиака, хотя из-за меньшего вклада s-орбитали в гибридизацию валентный угол практически равен 90°, неподеленная электронная пара занимает преимущественно s-орбиталь, она становится менее доступной для образования связей по донорно-акцепторному механизму, поэтому фосфин гораздо хуже растворим в воде и проявляет меньшую основность, чем аммиак.
Фосфин – бесцветный газ с запахом гнилой рыбы. Очень ядовит, на воздухе воспламеняется, может образовывать взрывчатые смеси. Температура плавления -134 °С, температура кипения -88 °С, то есть значительно ниже, чем у аммиака. Растворимость в воде также значительно меньше, при 17 °С в 100 мл воды растворяется всего 26 мл фосфина. Эти свойства связаны со строением молекулы РН3.
Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Фосфиды
Фосфи́ды – бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления.
По типу химической связи фосфиды подразделяют на соединения с преимущественно ионной связью, металлоподобные и с преимущественно ковалентной связью. К ионным относятся фосфиды щелочных и щелочноземельных элементов и металлов подгруппы цинка. Эти фосфиды легко гидролизуются водой, хорошо растворяются в клетках с выделением PH3, сгорают в токе O2 с образованием оксидов металлов и P, реагируют с галогенами. Некоторые из них обладают полупроводниковыми свойствами из-за того, что в межатомной связи присутствует определенная доля ковалентной составляющей.Их состав, как правило, не соответствует валентностям образующих их элементов. Эти фосфиды тугоплавки, устойчивы к действию воды и кислот. Их химическая стойкость растет с увеличением содержания P. Так, Ni3P, Cr3P, Fe3P, Ti3P легко разлагаются кислотами-окислителями (H2SO4, HNO3, HClO4), а также щелочами. В то же время фосфиды состава TiP, VP, TaP, CrP, FeP, MnP не взаимодействуют с концентрированной соляной кислотой и кислотами-окислителями. Они растворяются при нагревании в царской водке. Все металлоподобные фосфиды разлагаются смесью HF и HNO3 и при сплавлении с щелочами и пероксидами металлов. Многие из них полупроводники благодаря тому, что в химическая связь вносит определенный вклад ковалентная составляющая.
Ковалентные фосфиды образуются непереходными элементами III и IV гр. периодической системы (кроме Tl). Они тугоплавки, их хим. стойкость к воде и другим агрессивным средам сильно зависит от чистоты образца. Особенно устойчивы высоко чистые вещества. Все твердые ковалентные фосфиды-полупроводники, ширина запрещенной зоны которых тем больше, чем выше доля ионной связи в них. Типичные полупроводниковые фосфиды этой группы представляют собой координационные соединения, в которых помимо простых ковалентных связей присутствуют донорно-акцепторные связи. При этом атом P – донор, а атомы более электроположительного элемента – акцепторы электронной пары.
Фосфиды полуметаллов и неметаллов также главным образом ковалентные соединения Они могут быть газами (напр., PH3), твердыми веществами; по электрофизическим свойствам -диэлектриками или полупроводниками. Типичный диэлектрик – BP. Он устойчив к действию кислот-окислителей и щелочей. Другие фосфиды этой группы, напр. AlP и SiP, не обладают большой стойкостью к действию хим. реагентов.
Фосфоновые кислоты
Фосфоновые кислоты– соединения общей формулы RP(O)(OH)2, где R – орг. радикал, связанный с атомом P связью C-P.
Фосфоновые кислоты, как правило, гигроскопичные бесцветные кристаллы с четкими температурами плавления; растворимы в воде и полярных органических растворителях. Фосфоновые кислоты – двухосновные кислоты средней силы; склонны к димеризации. Для многих из них значения рK1 находятся в области 1,1-2,8, рК2 3,9-8,5.
С основаниями фосфоновые кислоты образуют кислые и средние соли (эфиры и соли фосфоновых кислот наз. фосфонатами). Фосфоновые кислоты, содержащие пергалогеналкильные и некоторые замещенные ароматичными радикалы, реагируют с избытком щелочи с разрывом связи P-C. При длительном нагревании фосфоновые кислоты отщепляют H2O и образуют олигоконденсированные соединения.
Фосфоновые кислоты этерифицируются только в присутствии катализаторов (напр., карбодиимидов). Моно- или диэфиры образуются при действии на фосфоновые кислоты диазоалканов, эпоксидов, азиридинов. При действии PCl5, SOCl2 или SF4 образуются соответствующие дигалогенангидриды. Нагревание фосфоновых кислот с их дихлорангидридами приводит к ангидридам фосфоновых кислот.
Обычно фосфоновые кислоты получают гидролизом RP(O)X2 (X = Cl, Br, OR, SR, NR2; X2 = О), окислением первичных фосфинов или фосфонистых кислот, при взаимодействии фосфористой кислоты с олефинами или карбонильными соединениями, а также в реакциях PCl3 с нитрилами, карбоновыми кислотами, альдегидами и кетонами, например:
Аналоги фосфоновых кислот, содержащие атомы S или Se- обычно малоподвижные жидкости, склонные к разложению при повышенных темпепатурах и в водных растворах; они обладают несколько более высокой кислотностью, чем их кислородные аналоги. Многие их свойства и способы получения такие же, как описаны выше. Специфичный способ синтеза ди- и тритиофосфоновых кислот – взаимодействие P4S10 с реактивом Гриньяра с последу.щим гидролизом гидролизом:
Фосфиты
Фосфиты, соли и эфиры фосфористой кислоты H3PO3. Соли бывают однозамещённые (например, NaH2PO3×2,5H2O) и двухзамещённые (например, Na2HPO3×5H2O). Большинство из них, кроме фосфитов щелочных металлов, труднорастворимы в воде. При прокаливании фосфиты распадаются на соответствующие фосфаты и производные фосфора низших степеней окисления вплоть до фосфина PH3. Фосфиты в водных растворах окисляются галогенами, солями ртути (например, HgCl2) до фосфатов. Образуются при нейтрализации фосфористой кислоты гидроокисями. Применяют как восстановители в неорганических синтезах. Фосфиты свинца – светостабилизатор в производстве поливинилхлорида.
Эфиры фосфористой кислоты бывают одно-, двух- и трёхзамещённые, соответственно ROP (O) HOH, (RO)2P (O) H, (KO)3P. Получаются при взаимодействии трёххлористого фосфора со спиртами или алкоголятами:
PCl3 + 3ROH ® (RO)2P (O)
HPCl3 + 3RONa ® (RO)3P
Используются как стабилизаторы полимерных материалов и масел и как полупродукты синтеза фосфорорганических соединений.
Фосфонаты
Фосфонаты – сложные эфиры фосфоновых кислот общей формулы RP(O)(OR1)n(OH)2-n. В зависимости от числа гидроксильных групп фосфонаты делятся на первичные (n=1, кислые фосфонаты), и вторичные (n = 2, полные фосфонаты).
Фосфонаты с низшими алкильными, алкенильными и арильными заместителями -бесцветные жидкости, фосфонаты с высокими молекулярными массами – масла или кристаллы. Связи при атоме фосфора имеют тетраэдрическую конфигурацию, в ИК-спектрах присутствует характеристическая полоса связи P=O при 1200-1280 см−1.
Первичные фосфонаты являются умеренно сильными кислотами (например, для n-ClC6H4P(O)(OC4H9)OH рКа = 1,7) и образуют соли аминами, вторичные образуют аддукты с кислотами Льюиса (например, с галогенидами бора).
Первичные фосфонаты при нагревании диспропорционируют с образованием полифосфатов, вторичные диалкилфосфонаты при нагревании выше 150°С разлагаются с образованием первичных фосфонатов и алкенов:
RP(O)(CH2CH2R1)2 RP(O)(OH)CH2CH2R1 + R1CH=CH2
При взаимодействии с пятихлористым фосфором и первичные, и вторичные фосфонаты образуют хлорангидриды фосфоновых кислот: RP(O)R12 + PCl5 RP(O)R1Cl + R1Cl + POCl3
Глава 6. Качественные реакции на ионы NН4+ (со щелочами), NО2– ( в кислой среде), NО3– (с медью и серной кислотой), РО43– (с нитратом серебра).
Качественная реакция на ионы NH4+
1) При действии щелочей при нагревании выделяется аммиак, который обнаруживают по характерному запаху, по посинению влажной лакмусовой бумаги или по почернению фильтровальной бумаги, смоченной раствором соли ртути (I). Чувствительность реакции – 0,05 µг; предельное разбавление 1:106.
NH4Cl + NaOH = NaCl + NH3 + H2O
(NH4+ + OH- = NH3 + H2O)
Качественная реакция на NО3– (с медью и серной кислотой)
NО2– (с перманганатом калия в кислой среде)Нитраты реагируют с медью в присутствии концентрированной серной кислоты с выделением диоксида азота ( бурого газа) и образование зеленовато-синего раствора ( при добавлении воды раствор становится голубым)
Cu + 2NO3- + 4H+= Cu2+ 2NO2 + 2H2O
Качественная реакция NО2– в кислой среде
Кислоты взаимодействуют с нитрит-ионами с образованием азотистой кислоты, которая разлагается с выделением газа , буреющего на воздухе ( NO окисляется до NO2)
3NO2- + 2H+= NO3- + 2NO2+Н2O
2NO + O2= 2NO2
Качественная реакция на РО43– (с нитратом серебра).
Образование с солями серебра желтого осадка, легко растворимого в серной кислоте или растворе аммиака
3AgNO3 + H3PO4= Ag3PO4 + 3HNO3
Источник
