Какие свойства проявляет хлор в реакции синтеза хлороводорода

Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

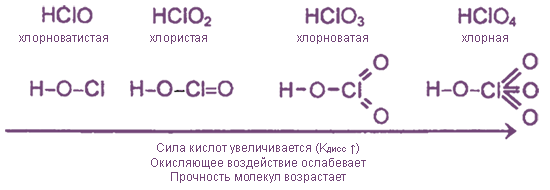
гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
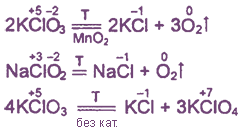
Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник
Хлористый водород – что это такое? Хлороводород – это бесцветный газ, обладающий резким запахом. Он легко растворяется в воде, образуя соляную кислоту. Химическая формула хлористого водорода – HCl. Он состоит из атома водорода и хлора, соединенных ковалентной полярной связью. Хлороводород легко диссоциирует в полярных растворителях, что обеспечивает хорошие кислотные свойства данного соединения. Длина связи составляет 127,4 нм.
Физические свойства
Как было сказано выше, в нормальном состоянии хлороводород – это газ. Он несколько тяжелее воздуха, а также обладает гигроскопичностью, т. е. притягивает пары воды прямо из воздуха, образуя при этом густое облака пара. По этой причине говорят, что хлористый водород «дымит» на воздухе. Если охлаждать данный газ, то на отметке -85 °С он сжижается, а к -114 °C становится твердым веществом. При температуре 1500 °С разлагается на простые вещества (исходя из формулы хлористого водорода, на хлор и водород).

Раствор HCl в воде называют соляной кислотой. Она представляет собой бесцветную едкую жидкость. Иногда имеет желтоватый оттенок из-за примесей хлора или железа. Из-за гигроскопичности максимальная концентрация при 20 °С – 37-38 % по массе. От нее же зависят и другие физические свойства: плотность, вязкость, температуры плавления и кипения.
Химические свойства
Сам хлороводород обычно в реакции не вступает. Лишь только при высокой температуре (более 650 °С) он реагирует с сульфидами, карбидами, нитридами и боридами, а также оксидами переходных металлов. В присутствии кислот Льюиса может взаимодействовать с гидридами бора, кремния и германия. А вот ее водный раствор гораздо более химически активен. По своей формуле хлористый водород – это кислота, поэтому он обладает некоторыми свойствами кислот:
- Взаимодействие с металлами (которые стоят в электрохимическом ряду напряжений до водорода):
Fe + 2HCl = FeCl2 + H2
- Взаимодействие с амфотерными и основными оксидами:
BaO + 2HCl = BaCl2 + H2O
- Взаимодействие со щелочами:
NaOH + HCl = NaCl + H2O

Взаимодействие с некоторыми солями:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
- При взаимодействии с аммиаком образуется соль хлорида аммония:
NH3 + HCl = NH4Cl
Но соляная кислота не взаимодействует со свинцом из-за пассивации. Это обусловлено образованием на поверхности металла слоя хлорида свинца, который нерастворим в воде. Таким образом, этот слой защищает металл от дальнейшего взаимодействия с соляной кислотой.
В органических реакциях она может присоединятся по кратным связям (реакция гидрогалогенирования). Также она может реагировать с белками или аминами, образуя органические соли – хлоргидраты. Искусственные волокна, типа бумаги, при взаимодействии с соляной кислотой разрушаются. В окислительно-восстановительных реакциях с сильными окислителями хлороводород восстанавливается до хлора.
Смесь концентрированной соляной и азотной кислоты (3 к 1 по объему) называют «царской водкой». Она является крайне сильным окислителем. Из-за образования в этой смеси свободного хлора и нитрозила царская водка может растворять даже золото и платину.
Получение
Ранее в промышленности соляную кислоту получали путем взаимодействия хлорида натрия с кислотами, обычно с серной:
2NaCl + H2SO4 = 2HCl + Na2SO4
Но этот способ недостаточно эффективен, а чистота получаемого продукта невысока. Сейчас используется другой способ получения (из простых веществ) хлористого водорода по формуле:
H2 + Cl2 = 2HCl

Для реализации такого способа существуют специальные установки, где оба газа подаются непрерывным потоком на пламя, в котором происходит взаимодействие. Водород подается в небольшом избытке для того, чтобы прореагировал весь хлор и не загрязнял получаемый продукт. Далее хлороводород растворяют в воде и получают соляную кислоту.
В лаборатории возможны более разнообразные способы получения, например гидролиз галогенидов фосфора:
PCl5 + H2O = POCl3 + 2HCl
Получить соляную кислоту можно и путем гидролиза кристаллогидратов некоторых хлоридов металлов при повышенной температуре:
AlCl3·6H2O = Al(OH)3 + 3HCl + 3H2O
Также хлороводород является побочным продуктом реакций хлорирования многих органических соединений.
Применение
Сам хлороводород на практике применения не находит, так как очень быстро впитывает воду из воздуха. Почти весь произведенный хлористый водород идет на производство соляной кислоты.

Применяется в металлургии для очистки поверхности металлов, а также для получения чистых металлов из их руд. Это происходит путем перевода их в хлориды, которые легко восстанавливаются. Так, например, получают титан и цирконий. Широкое применение кислота получила в органическом синтезе (реакции гидрогалогенирования). Также из соляной кислоты иногда получают чистый хлор.
Находит применение и в медицине как лекарство в смеси с пепсином. Его принимают при недостаточной кислотности желудка. Соляная кислота используется в пищевой промышленности в качестве добавки Е507 (регулятор кислотности).
Техника безопасности
При высоких концентрациях соляная кислота – это едкое вещество. Попадая на кожу, она вызывает химические ожоги. Вдыхание газообразного хлороводорода вызывает кашель, удушье, а в тяжелых случаях даже отек легких, который может привести к смерти.
По ГОСТу имеет второй класс опасности. Хлористый водород по стандарту NFPA 704 имеет третью категорию опасности из четырех. Кратковременное воздействие может привести к серьезным временным или умеренным остаточным последствиям.
Первая помощь
При попадании соляной кислоты на кожу рана должна быть обильно промыта водой и слабым раствором щелочи или ее соли (например, содой).
При попадании паров хлороводорода внутрь дыхательных путей пострадавшего необходимо вынести на свежий воздух и сделать ингаляцию кислородом. После этого следует прополоскать горло, промыть глаза и нос 2 % раствором гидрокарбоната натрия. Если соляная кислота попала в глаза, то после этого стоит закапать их раствором новокаина и дикаина с адреналином.
Источник
Класс 9 А, Г Дата: 05.11.20г.
Тема урока. Хлороводород: получение и свойства.
Цель урока: рассмотреть способы получения, свойства хлороводорода; научить соотносить области применения хлороводорода с его свойствами.
Задачи урока:
Образовательные: познакомить учащихся с химической формулой и строением молекулы хлороводорода, физическими и химическими свойствами, получением и применением хлороводорода.
Воспитательные: показать единство материального мира.
Развивающие: приобретение навыков самостоятельной работы.
Формировать УУД:
Познавательные УУД: умение осуществлять поиск нужной информации, выделять главное в тексте, структурировать учебный материал, грамотно формулировать вопросы,
Личностные УУД: умение применять полученные знания в своей практической деятельности.
Регулятивные УУД: умение планировать свою работу при выполнении заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД: умение работать в составе творческих групп, высказывать свое мнение.
Оборудование: учебник «Химия 9 класс» Рудзитис Г.Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал.
ХОД УРОКА
Организационный момент.
Мотивация.
«Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны: состав, строение, свойства …»
(Б.М.Кедров)
Актуализация знаний.
Фронтальная беседа.
– Расскажите о физических свойствах хлора (хлор – газ, желто-зеленого цвета, имеет резкий, удушливый запах. Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС).
– Как меняется химическая активность галогенов от фтора к йоду? (фтор химически наиболее активен, а йод наименее активен).
– Как меняется вытеснительная активность галогенов в растворах их солей? (более активные галогены вытесняют менее активные галогены из их соединений).
– С какими простыми веществами реагирует хлор? (с металлами и водородом).
– Опишите взаимодействие хлора с водой, раскрыв сущность реакции ( Cl2 + H2O = HCl + HClO. Реакция обмена, в результате образуются две кислоты: соляная и хлорноватистая; ОВР).
– Расскажите о возможных случаях реакции соединения хлора с водородом, механизме и сущности реакции (с водородом хлор реагирует на свету, а также при нагревании; взрывается при облучении, с образованием хлороводорода).
– Как растворяется хлороводород в воде и чем является его раствор? (в воде растворяется очень хорошо, образуется соляная кислота).
Письменное домашнее задание. (Выполняется на доске учащимися, пока учащиеся выполняют задания у доски, учитель проводит фронтальную беседу с классом).
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Этот газ – хлор. При взаимодействии хлора с водородом образуется хлороводород, водный раствор «муриевая кислота» – соляная кислота. При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
Изучение нового материала.
Химическая формула хлороводорода – HCl. Химическая связь – ковалентная полярная.
В промышленности хлороводород получают взаимодействие хлора с водородом.
Cl2 + H2 = 2HCl
В лаборатории получают нагреванием хлорида натрия с концентрированной серной кислотой. В таких условиях, при отсутствии воды, выделяется газообразный хлороводород, его затем растворяют в воде и получают соляную кислоту.
2NaCl + H2SO4 = Na2SO4 + 2HCl↑ (см. рис. 13 §14).
Хлороводород – бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит. Наиболее характерным свойством хлороводорода является его большая растворимость в воде (при 0 ºС в одном объеме воды растворяется около 500 объемов газа).
Можно ли получить хлороводород, используя раствор поваренной соли? (нет, т.к. все находящиеся в растворе вещества являются сильными электролитами).
Химические свойства: хлороводород не реагирует ни с металлами, ни с основными оксидами (в отличие от соляной кислоты). Запомните, что соляная кислота и хлороводород – не одно и то же вещество, хотя и описываются условно одинаковой формулой. Эти вещества имеют разные физические и химические свойства.
Применение хлороводорода:
1) Получение соляной кислоты
2) Получение пластмасс и каучука.
Закрепление изученного материала.
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления (хлороводород является одной из составляющих ядовитых вулканических газов).
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Вопросы – подсказки: что такое желудочный сок? Вспомните состав желудочного сока? Какова роль соляной кислоты в пищеварении? При каких нарушениях процесса пищеварения выписывают сильно разбавленный раствор соляной кислоты?
Домашнее задание.
Выучить материал § 14, выполнить № 1-2 с. 55.
Рефлексия.
Учащимся необходимо выбрать 3 слова из 12, которые наиболее точно передают его состояние на уроке:
Раздражение
Злость
Радость
Равнодушие.
Удовлетворение
Вдохновение
Скука.
Тревога.
Покой.
Уверенность
Неуверенность.
Наслаждение.
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Источник
