Какие свойства проявляет kcio4

| Хлорат калия | |
|---|---|
| Систематическое наименование | Хлорат калия |
| Традиционные названия | Бертолетова соль |
| Хим. формула | KClO3 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Температура | |
| • плавления | 356 °C |
| • разложения | ~ 400 |
| Энтальпия | |
| • образования | -391,204 кДж/моль |
| Растворимость | |
| • в воде при 0°C | 3,25 г/100 мл |
| • в воде при 20°C | 7,3 г/100 мл |
| • в воде при 100°C | 56,2 г/100 мл |
| • в воде при 104,2°C | 61,5 г/100 мл |
| Рег. номер CAS | [3811-04-9] |
| PubChem | 6426889 |
| Рег. номер EINECS | 223-289-7 |
| SMILES | [O-]Cl(=O)=O.[K+] |
| InChI | InChI=1S/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 VKJKEPKFPUWCAS-UHFFFAOYSA-M |
| RTECS | FO0350000 |
| Номер ООН | 1485 |
| ChemSpider | 18512 |
| NFPA 704 | 2 3 OX |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Хлорат калия (бертолетова соль[1], калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
История[править | править код]
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
Получение[править | править код]
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства[править | править код]
- При температуре ~ 400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
Применение[править | править код]
Взрывчатые вещества[править | править код]
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов и в зарядах хлопушек (взрыв происходит при протаскивании грубой нити через пиротехнический состав), входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине[править | править код]
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода[править | править код]
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Для получения диоксида хлора[править | править код]
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
Токсичность[править | править код]
Токсичен. Смертельная доза хлората калия составляет 1 г/кг[2].
Примечания[править | править код]
Литература[править | править код]
- Вуколов, С. П., Менделеев Д. И.,. Хлорноватые соли // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Кислородсодержащие
соединения хлора
HClO – хлорноватистая кислота. Ей
соответствует кислотный оксид Cl2O. Соли называются
гипохлоритами.
HClO2 – хлористая кислота.
Кислотный оксид Cl2O3 не получен. Соли – хлориты.
HClO3 – хлорноватая кислота. Кислотный
оксид Cl2O5 не получен. Соли – хлораты.
HClO4– хлорная кислота. Кислотный оксид –
Cl2O7. Соли – перхлораты.
1) HClO – желтоватая жидкость.
Существует только в растворах. Получается при взаимодействии хлора с водой (без
нагревания):
Cl2 + H2O
= HCl + HClO
Соли этой кислоты получаются при
действии на щелочь хлора:
2KOH + Cl2 =холод=
KClO + KCl + H2O
используется как отбеливатель в
текстильной промышленности.
2) HClO2, HClO3 –
не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в
пиротехнике и взрывных работах. Наибольшее значение имеет KClO3 – хлорат
калия (бертолетова соль), получаемая насыщением горячей щелочи хлором:
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
Хлораты – сильнейшие окислители.
При ударе или нагревании взрываются.
3) Известен оксид ClO2,
который можно получить по реакции:
2KClO3 +
H2C2O4 = K2CO3 +
CO2
+ H2O + 2ClO2
ClO2 –
зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO2 + H2O
= HClO2 + HClO3
4) Осторожным нагреванием хлораты
можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO4 + H2SO4 =
HClO4 + KHSO4
Хлорная кислота HClO4 – подвижная
жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти
все ее соли хорошо растворимы в воде.
5) В ряду: HClO → HClO2 →
HClO3 → HClO4 сила кислот растет, а
окислительная способность падает.
Кислородные
соединения галогенов
Галогены с кислородом
непосредственно не реагируют. Но кислородсодержащие кислоты галогенов (кроме
фтора) могут быть получены как продукты реакций диспропорционирования хлора,
брома и йода с водой и щелочами. При
взаимодействии хлора с водой часть растворенного хлора переходит в кислоту НСlO, называемую хлорноватистой
кислотой. В этой молекуле хлор в степени окисления + 1 связан с
кислородом:
Хлорноватистая кислота известна
только в водном растворе. Это неустойчивое вещество претерпевает различные
превращения. На свету кислород отщепляется от хлора:
HClO
-hν→ HCl + O
В момент образования кислород в
виде отдельных атомов очень активен, вследствие чего раствор проявляет сильное
окислительное действие. При отнятии воды, например, действием безводного
хлорида кальция, из сильно охлажденного раствора выделяется оксид хлора (I), Сl2O, в виде красно-бурой жидкости с
температурой кипения +3,8°С. Это тоже неустойчивое вещество, способное
взрываться. Растворяясь в воде, он снова образует хлорноватистую кислоту. При
нагревании раствора НСlO
происходит более глубокое диспропорционирование хлора с переходом в степень
окисления +5:
3HClO = 2HCl + HClO3
Образующееся кислородсодержащее
соединение называется хлорноватой кислотой. Это более
устойчивое соединение, сильная кислота, образующая растворы с массовой долей до
40%. Под действием серной кислоты хлорноватая кислота диспропорционирует,
образуя еще два новых соединения хлора:
3HCl+5O3
= HCl+7O4 + 2Cl+4O2 + H2O
Хлорная кислота НСlO4 содержит хлор в высшей
степени окисления +7. Второй продукт реакции оксид хлора (IV) содержит хлор в необычной для
него степени окисления +4. Хлор в этом состоянии имеет неспаренный электрон.
Это также неустойчивое, взрывчатое соединение хлора. В водном растворе СlO2 диспропорционирует на две
кислоты — хлорноватую и хлористую. В последней степень
окисления хлора +3:
2ClO2+H2O = HClO3 + HClO2
Таким образом, в рассмотренных
реакциях показано образование четырех кислородсодержащих кислот хлора,
образующих ряд с возрастающими нечетными степенями окисления и валентностями
хлора от +1 до +7 (табл.). В этом ряду наблюдается последовательное и резкое
возрастание силы кислот от очень слабой хлорноватистой до одной из самых
сильных хлорной. Усиление кислот в этом ряду связано с увеличением числа атомов
кислорода, соединенных с хлором двойными связями. Это способствует
делокализации заряда аниона, что затрудняет присоединение к нему иона водорода
с образованием молекулы кислоты.
Таблица.
Кислородсодержащие
кислоты хлора
Свойство | Формула | |||
HClO | НСlO2 | НСlO3 | НСlO4 | |
Степень окисления хлора | + 1 | +3 | +5 | +7 |
Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
Название солей | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Все четыре кислоты являются
сильными окислителями, по силе превосходящими хлор. Вместе с тем, как очевидно
из протекания многочисленных реакций, окислительная активность резко падает в
ряду от HClO
к НСlO4. Например, хлорноватистая кислота
моментально выделяет йод из раствора йодида калия, а разбавленная хлорная
кислота с раствором КI
практически не реагирует. Хлорноватистая кислота и ее соли обесцвечивают
органические красители, в то время как хлорная кислота окисляющего действия на
них не оказывает. Таким образом, увеличение числа атомов кислорода, окружающих
атом хлора, способствует стабилизации как молекул кислот, так и анионов их
солей. Повышение устойчивости проявляется и в том, что из четырех кислот только
хлорная может быть получена в безводном состоянии.
Находящие практическое применение
соли хлорноватистой и хлорноватой кислот получаются взаимодействием хлора с
растворами щелочей. Гипохлорит калия КСlO служит отбеливающим средством. Он
получается пропусканием хлора в раствор гидроксида калия. Одновременно
образуется хлорид калия:
Cl2+2KOH
=холод=KClO+KCl+H2O
Этот раствор называется жавелевой
водой (Javel — местечко около Парижа, где впервые стали
изготовлять эту воду в 1792 году — раствор солей калия
хлорноватистой и соляной кислот KOCl + KCl). Кислота НСlO настолько слабая, что вытесняется
из соли под действием углекислого газа:
KClO
+ CO2 + H2O = KHCO3 + HClO
Эта кислота и обесцвечивает
красители.
Как активные окислители гипохлориты
нашли применение в медицине. Они проявляют дезинфицирующее, антисептическое,
противомикробное действие. Гипохлорит натрия NаСlO применяется в растворе с массовой
долей 0,06% для промывания ран, при операциях па грудной клетке, брюшной или
плевральной полостях. Выпускается раствор гипохлорита натрия и для инъекций.
Взаимодействием хлора с другой
щелочью — гидроксидом кальция в отсутствие воды получается практически важный
продукт хлорная известь. Это белый порошок, иногда серый или
желтоватый от присутствия примесей, пахнущий хлором. В составе хлорной извести
имеются СаС2, Са(СlO)2,
Са(ОН)2 и вода. Часто хлорную известь представляют, как
смешанную соль с двумя разными анионами: СаСl(СlO). Хлорная известь реагирует даже
со слабыми кислотами с выделением хлора:
СаСl(СlO) + CO2
=H2O= CaCO3 + Cl2↑
Выделяющийся хлор реагирует с
органическими веществами, в результате чего, в частности, гибнут
микроорганизмы. Поэтому хлорная известь широко применяется в санитарных целях.
Она применяется также для отбеливания бумаги и тканей и для лабораторного
получения хлора.
Пропусканием хлора в горячий
раствор гидроксида калия получают смесь двух солей — хлорида калия КCl и хлората калия КСlO3.
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
При охлаждении раствора хлорат
калия начинает кристаллизоваться. При 20°С его растворимость составляет 7,4 г
на 100 г воды, в то время как растворимость хлорида калия равна 34 г. Хлорат
калия называют бертолетовой солью, так как он был впервые получен
К. Бертолле. Бертолетову соль предполагалось использовать в составе пороха
взамен селитры, но при испытаниях быстрая детонация такого пороха приводила к
разрыву пушечных стволов. Вместо этого бертолетова соль нашла широкое
применение в качестве окислителя в составах для фейерверков. Она является также
окисляющей составной частью спичечной головки. Кислород, отщепляющийся от хлора
в хлорате калия, в твердых смесях окисляет уголь, серу, фосфор, органические
вещества. Реакции сопровождаются яркими вспышками. Напишем реакцию сгорания
сахарозы:
C12H22O11+8KClO3
= 12CO2 +11H2O + 8KCl + 5647 кДж/моль
При нагревании хлорат калия и
другие соли кислородсодержащих кислот хлора разлагаются с выделением кислорода.
Разложение хлората калия ускоряется в присутствии оксида марганца(IV):
2KClO3
=MnO2= 3O2 + 2KCl
При нагревании бертолетовой соли
без катализатора происходит диспропорционирование хлора с образованием
перхлората калия:
4KClO3
=t=400C= 3KClO4 + KCl
При еще более сильном нагревании до
~520°С перхлорат калия тоже разлагается, выделяя кислород. Относительно высокая
термическая устойчивость перхлоратов и устойчивость их в растворах характерна и
для других солей с анионами, в которых центральный атом окружен четырьмя
атомами кислорода. Такие анионы имеют тетраэдрическое строение, а π-связи в них
полностью делокализованы.
Рисунок. Строение анионов кислородсодержащих кислот хлора
Кислородные соединения брома менее
устойчивы по сравнению с кислородными соединениями хлора. Оксид брома Вг2O разлагается уже при температуре
плавления -17°С. Свободный бром реагирует со щелочью при нагревании аналогично
хлору:
3Br2 +
6KOH =t= KBrO3 + 5KBr + 3H2O
Бромат натрия NaВrO3 применяется как окислитель в
аналитической химии. Например, по реакции с броматом калия определяют оксид
мышьяка (III):
3As2O3
+ 2KBrO3 + 9H2O = 6H3AsO4 +
2KBr
Бром трудно окислить до степени
окисления +7. До 1970 г. соли бромной кислоты НВrO4 не были получены, и в
учебниках иногда давались объяснения, почему они не существуют. Впервые
пербромат натрия был получен по реакции
NaBrO3
+ F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Кислородные соединения йода более
устойчивы по сравнению с другими галогенами. В щелочном растворе йод диспропорционирует
аналогично брому. При пропускании хлора в водную суспензию йода образуется
йодноватая кислота:
I2
+ 5Cl2 + 6H2O = 2HIO3 + 10HCl
Из раствора йодноватая кислота
выделяется в виде устойчивого кристаллического вещества. При ее обезвоживании
получается оксид 12О5, устойчивый при обычных условиях. Он нашел применение для
анализа воздуха на присутствие оксида углерода(И). Анализ основан на реакции, сопровождающейся
выделением йода: 5СO
+ I2O5 = I2 + 5CO2
Известна также йодная кислота НIO4, которая может быть получена
действием хлорной кислоты на йод:
2HClO4 + I2 = 2HIO4 + Cl2
После испарения воды из раствора
йодной кислоты получаются бесцветные кристаллы НIO4*2Н2O. Из химических свойств этого
вещества следует, что все атомы кислорода связаны непосредственно с йодом, и
вещество представляет собой ортойодную кислоту Н5IO6.
Как известно, в группах (главных
подгруппах) усиливается металличность при переходе в группе сверху вниз. В
группе галогенов находятся элементы, наиболее далекие по свойствам от металлов.
И все же у тяжелого элемента йода проявляются признаки металличности. Черные
кристаллы йода имеют слабый металлический блеск, а электрическое сопротивление
значительно ниже, чем у такого типичного неметалла, как сера. Йод, подобно
металлам, может входить в состав вещества в качестве катиона. Неустойчивый
катион I+ может быть стабилизирован
образованием комплексного иона с органическими молекулами. При реакции йода с
нитратом серебра в присутствии пиридина С5Н5N образуется комплексный ион такого
типа:
I2+AgNO3+2С5Н5N
= [I(С5Н5N)2]NO3
+ AgI↓
Кислородные соединения фтора
интересны тем, что фтор является единственным элементом, по
электроотрицательности превосходящим кислород. Поэтому простейшее из этих
соединений ОF2 следует называть не оксидом
фтора, а фторидом кислорода. Это газообразное вещество получается при действии
фтора на 2%-ный раствор гидроксида натрия:
2F2 + 2NaOH = 2NaF + OF2↑+H2O
Своим угловым строением молекула
фторида кислорода напоминает молекулу воды, но их дипольные моменты µ направлены противоположно:
Фторид кислорода термодинамически
неустойчив, при t
> 200°С распадается
на кислород и фтор. Есть и более сложные по составу фториды кислорода.
Фтор, так же, как и кислород, не
проявляет высокой валентности, соответствующей номеру группы, так как не имеет
энергетически доступных свободных орбиталей для перехода в возбужденное
состояние.
Источник
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород
не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее – оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным
элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к
брому, и к йоду. Так например HBrO – бромноватистая кислота (соли гипобромиты), HIO – иодноватистая кислота (соли гипоиодиты).
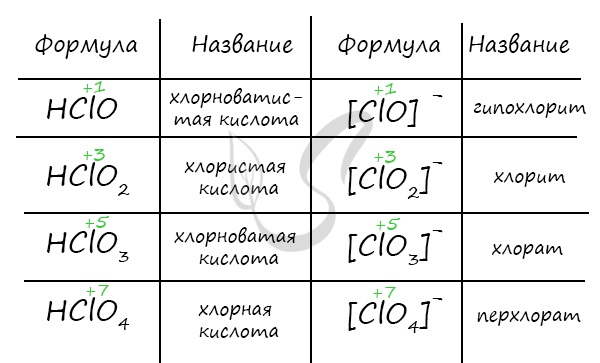
HIO3 – иодноватая кислота (соли иодаты), HBrO3 – бромноватая кислота (соли броматы). По аналогии несложно
составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
- Хлористая кислота
- Хлорноватая кислота
- Хлорная кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
Cl2 + H2O ⇄ HCl + HClO

KClO + H2O + CO2 → KHCO3 + HClO
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO

Хлористая кислота может быть получена из собственных солей – хлоритов, а также в реакции с оксидом хлора IV.
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
H2SO4 + Ba(ClO3)2 → BaSO4↓ + HClO3
Самая сильная кислота в природе – хлорная кислота – может быть получена реакцией перхлората калия или натрия с концентрированной серной
кислотой.
KClO4 + H2SO4 → K2SO4 + HClO4

Химические свойства
- Кислотные свойства
- Разложение кислот и солей
- Окислительные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная – к сильным. Кислоты образуют соли в
реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2

NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и
галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
