Какие свойства проявляет оксид магния
Оксид магния, свойства, получение, химические реакции.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Оксид магния – неорганическое вещество, имеет химическую формулу MgO.
Краткая характеристика оксида магния
Физические свойства оксида магния
Получение оксида магния
Химические свойства оксида магния
Химические реакции оксида магния
Применение и использование оксида магния
Краткая характеристика оксида магния:
Оксид магния – неорганическое вещество белого цвета.
Так как валентность магния равна двум, то оксид магния содержит один атом кислорода и один атом магния.
Химическая формула оксида магния MgO.
Плохо растворяется в воде, вступает с ней в реакцию.
Легкий, рыхлый порошок, легко впитывает воду.
Физические свойства оксида магния:
| Наименование параметра: | Значение: |
| Химическая формула | MgO |
| Синонимы и названия иностранном языке | magnesium oxide (англ.) магнезия жженая (рус.) магния окись (устар. рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белый порошок |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3580 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,58 |
| Температура кипения, °C | 3600 |
| Температура плавления, °C | 2825 |
| Молярная масса, г/моль | 40,3044 |
* Примечание:
— нет данных.
Получение оксида магния:
Оксид магния получают обжигом минералов магнезита и доломита.
Он получается в результате химической реакции – термического разложения карбоната кальция и карбоната магния:
CaMg(CO3)2 → CaО + MgО + СО2 (t = 900-1200 oC);
CaCO3·MgCO3 → CaО + MgО + СО2 (t = 900-1200 oC);
MgCO3 → MgО + СО2 (t > 650 oC);
CaCO3 → CaО + СО2 (t = 900-1200 oC).
CaMg(CO3)2, CaCO3·MgCO3 – химическая формула доломита.
MgCO3 – химическая формула магнезита.
Это промышленный способ получения оксида магния.
Химические свойства оксида магния. Химические реакции оксида магния:
Оксид магния относится к основным оксидам.
Химические свойства оксида магния аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида магния с водородом:
MgО + H2 → Mg + H2О.
В результате реакции образуется магний и вода.
2. реакция оксида магния с углеродом:
MgО + С → Mg + СО (t = 2000 oC).
В результате реакции образуется магний и оксид углерода.
3. реакция оксида магния с серой:
2MgО + 3S → 2MgS + SО2.
В результате реакции образуется сульфид магния и оксид серы.
4. реакция оксида магния с азотом:
2MgО + N2 → 2Mg + 2NО.
В результате реакции образуется магний и оксид азота.
5. реакция оксида магния с кремнием:
2MgО + Si → 2Mg + SiО2.
В результате реакции образуется магний и оксид кремния.
6. реакция оксида магния с калием:
MgО + 2K → Mg + K2О.
В результате реакции образуется магний и оксид калия.
7. реакция оксида магния с кальцием:
MgО + Са → Mg + СаО (t = 1300 oC).
В результате реакции образуется магний и оксид кальция.
8. реакция оксида магния с алюминием:
3MgО + 2Al → 3Mg + Al2О3.
В результате реакции образуется магний и оксид алюминия.
9. реакция оксида магния с хлором и углеродом:
MgO + Cl2 + С → MgCl2 + СО (t = 800-1000 oC).
В результате реакции образуется хлорид магния и оксид углерода.
10. реакция оксида магния с водой:
MgО + Н2О → Mg(ОН)2 (t = 100-125 oC).
Оксид магния реагирует с водой, образуя гидроксид магния.
11. реакция оксида магния с оксидом углерода (углекислым газом):
MgО + СО2 → MgСО3.
Оксид магния реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат магния.
12. реакция оксида магния с оксидом серы:
MgО + SО2 → MgSО3;
MgО + SО3 → MgSО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит магния, во втором случае – сульфат магния.
13. реакция оксида магния с оксидом кремния:
MgО + SiО2 → MgSiО3 (t = 1100-1200 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат магния.
14. реакция оксида магния с оксидом фосфора:
3MgO + P2O5 → Mg3(PO4)2;
3MgO + P2O3 → Mg3(PO3)2;
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: ортофосфат магния и фосфит магния.
15. реакция оксида магния с оксидом алюминия:
MgО + Al2O3 → MgAl2О4 (t = 1600 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат магния (шпинель).
16. реакция оксида магния с оксидом железа:
MgО + Fe2O3 → MgFe2О4 (to).
В результате реакции образуется соль – феррит магния. Реакция протекает при прокаливании реакционной смеси.
17. реакция оксида магния с оксидом азота:
MgО + 2N2О5 → Mg(NO3)2.
В результате реакции образуются соль – нитрат магния.
18. реакция оксида магния с плавиковой кислотой:
MgO + 2HF → MgF2 + H2O.
В результате химической реакции получается соль – фторид магния и вода.
19. реакция оксида магния с азотной кислотой:
MgO + 2HNO3 → 2Mg(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат магния и вода.
Аналогично проходят реакции оксида магния и с другими кислотами.
20. реакция оксида магния с бромистым водородом (бромоводородом):
MgO + 2HBr → MgBr2 + H2O.
В результате химической реакции получается соль – бромид магния и вода.
21. реакция оксида магния с йодоводородом:
MgO + 2HI → MgI2 + H2O.
В результате химической реакции получается соль – йодид магния и вода.
22. реакция оксида магния с оксидом кальция и кремнием:
2MgO + CaO + Si → CaSiO3 + 2Mg.
В результате химической реакции получается соль – силикат кальция и магний.
23. реакция оксида магния с хлоридом натрия:
MgO + 2NaCl → MgCl2 + Na2O.
В результате химической реакции получается соль – хлорид магния и оксид натрия.
24. реакция оксида магния с хлоридом железа:
3MgO + 2FeCl3 → 3MgCl2 + Fe2O3.
В результате химической реакции получается соль – хлорид магния и оксид железа.
25. реакция оксида магния с гидроксидом калия:
MgO + 2KOH → Mg(OH)2 + K2O.
В результате химической реакции получается гидроксид магния и оксид калия.
Применение и использование оксида магния:
Оксид магния используется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, в качестве пищевой добавки E-530.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид магния реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида магния
реакции с оксидом магния
Коэффициент востребованности
5 979
Источник
| Оксид магния | |
|---|---|
 | |
| Систематическое наименование | Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES | O=[Mg] |
| InChI | 1S/Mg.O CPLXHLVBOLITMK-UHFFFAOYSA-N |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
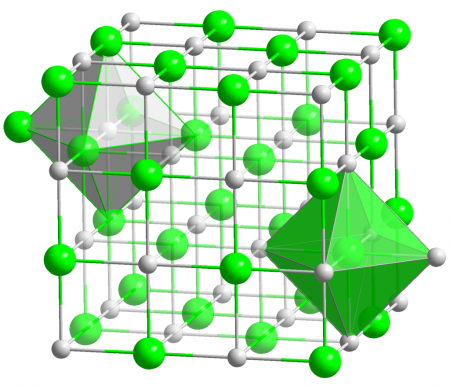
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
MgO + 2HCl → MgCl2 + H2O MgO + H2O → Mg(OH)2
Получение
Оксид магния получают обжигом минералов магнезита и доломита.
CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2 MgCO3 → MgO + CO2
Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
Соединения магния | |
|---|---|
| |
Источник
Оксид магния (MgO) – белые гигроскопичные твердые минералы, которые встречаются в природе в виде периклаза и являются источником магния.
 Получение оксида магния возможно при обжиге минералов магнезита и доломита.
Получение оксида магния возможно при обжиге минералов магнезита и доломита.
В лабораторных условиях получение оксида магния происходит путем обработки карбоната магния хлоридом магния с известью и последующей тепловой обработкой.
Свойства оксида магния
Оксид магния – белый порошок без запаха растворимый в кислоте и аммиаке и нерастворимый в спирте.
Молекулярная формула оксида магния – MgO, молярная масса – 40,3044 г/моль, плотность – 3,58 г/см³, температура плавления – 2852 °C, 3125 K, 5166 °F, температура кипения – 3600 °C, 3873 K, 6512 °F, растворимость в воде – 0,0086 г/100 мл (30°С).
Применение оксида магния
В традиционной медицине оксид магния используется как минеральная добавка для профилактики и лечения дефицита магния в крови. Магний является очень важным компонентом для нормального функционирования клеток, нерв, мышц, костей и сердца.
Как правило, хорошо сбалансированная диета обеспечивает нормальное содержание магния в крови. Однако прием таких лекарственных средств как фуросемид и гидрохлоротиазид, желудочно-кишечные заболевания, плохое питание, алкоголизм и сахарный диабет приводят к развитию дефицита магния в организме.
Антацидные свойства оксида магния помогают при расстройстве желудка, повышенной кислотности желудка и изжоге, нейтрализуя кислотность желудка. Также оксид магния применяется в качестве слабительного при лечении язвы желудка, двенадцатиперстной кишки и камней оксалата кальция в почках.
Оксид магния входит в состав медикаментов и пищевых добавок, действие которых направлено на восполнение дефицита магния в организме. Лекарства на основе оксида магния принимают внутрь, желательно во время еды, чтобы исключить расстройство желудка и диарею. Принимать препараты необходимо регулярно в одно и то же время, для получения максимальной пользы. Дозировка зависит от состояния здоровья и реакции на лечение.
Переизбыток оксида магния в крови может привести к серьезным побочным эффектам. Прежде чем принимать добавки, в состав которых входит оксид магния, необходима врачебная консультация, так как в них могут содержаться неактивные компоненты, которые вызывающие аллергические реакции.
В качестве промышленного компонента оксид магния используется в производстве бумаги, магниевых солей (английская соль), ацетатов, хлоридов и в качестве компонента в некоторых видах цемента.
В стекловолоконной промышленности оксид магния используется в обработке стали и никеля.
Оксид магния входит в состав изоляторов промышленных кабелей, как основной огнеупорный материал для тиглей и в качестве основного компонента в производстве огнеупорных строительных материалов. Он широко используется в отопительных системах в качестве компонента нагревательных элементов трубчатых конструкций.
Прессованные кристаллы оксида магния используются в производстве оптического материала. Они прозрачные от 0,3 до 7 мкм и обладают хорошим показателем преломлении 1,72 при 1 мкм, а также обладают низкой стоимостью.
Оксид магния используется на заводах по утилизации отходов, как вещество способное контролировать растворимость радионуклидов.
Также оксида магнии используется в качестве защитного покрытия для плазменных дисплеев, а спортсмены используют порошок оксида магния в качестве белой посыпки для рук, благодаря которой они не скользят по спортивным снарядам.
В промышленности оксид магния применяется для производства резины, синтетических каучуков и очистки нефтепродуктов, а в электронной промышленности он используется как абразив для очистки поверхностей.
В пищевой промышленности оксид магния известен как пищевая добавка E530 – эмульгатор, не растворяемый в воде, который используется в производстве:
- Сухого молока;
- Сухих сливок;
- Шоколада;
- Какао;
- Пищевых масел.
Противопоказания и вред оксида магния
Прием медикаментов на основе оксида магния может привести к расстройствам желудка и поносу, серьезным аллергическим реакциям (сыпь, зуд и отеки в особенности в области лица, языка и горла), крапивнице, сильным головокружениям, судорогам, перепадам настроения, слабости, тошноте, рвоте, усталости и проблемам с дыханием.
Лекарства на основе оксида магния с осторожностью назначаются при болезни почек, во время беременности и в период лактации.
 Медикаменты в виде жидкостей и порошков, в состав которых входит оксид магния, также могут содержать сахар и подсластитель аспартам. В жидкостях также может содержаться спирт. Их с осторожностью следует принимать при таких болезнях, как диабет, алкогольная зависимость, заболевания печени, фенилкетонурия и при любых других заболеваниях, лечение которых требует ограничения этих веществ в повседневном рационе.
Медикаменты в виде жидкостей и порошков, в состав которых входит оксид магния, также могут содержать сахар и подсластитель аспартам. В жидкостях также может содержаться спирт. Их с осторожностью следует принимать при таких болезнях, как диабет, алкогольная зависимость, заболевания печени, фенилкетонурия и при любых других заболеваниях, лечение которых требует ограничения этих веществ в повседневном рационе.
Прием оксида магния противопоказан при употреблении целлюлозы натрия фосфата, дигоксина и полистиролсульфаната натрия.
Оксид магния может полностью нейтрализовать действие таких медикаментов, как:
- Тетрациклины (демеклоциклин, доксициклин, миноциклин и тетрациклин);
- Бисфосфонаты (алендронат);
- Лекарства для щитовидной железы (левотироксин);
- Антибиотики (ципрофлоксацин, левофлоксацин).
Использования оксида магния может вызывать легкие раздражения кожи и глаз. Вдыхание порошка оксида магния может вызвать раздражение носа и горла, а вдыхание паров оксида магния может вызвать состояние литейной лихорадки, сопровождаемой такими симптомами, как металлический привкус во рту, раздражение горла, сухой кашель, увеличение лейкоцитов в крови, озноб и слабость мышц.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник
Химическое название
Оксид магния
Химические свойства
Вещество имеет ряд традиционных названий: жженая магнезия, периклаз. Химическая формула оксида магния: MgO. Согласно фармакопее, соединение представляет собой мелкие белые кристаллы, которые не растворяются в воде. В фармакологии средство используют в форме легкого, белого рыхлого порошка, который обладает способностью впитывать воду. Оксид кипит при 3600 градусах Цельсия, молекулярная масса = 40,3 грамма на моль.
Химические свойства Оксида Магния. Вещество вступает в реакции с разбавленными к-ами, при этом образуя соли. Оксид Магния реагирует с горячей водой с образованием гидроксида, не вступает в реакцию с холодной жидкостью. Magnesii oxydum (Оксид Магния на латинском) получают при обжиге магнезита и доломита. MgCO3 разлагается до оксида и угарного газа.
Применение вещества:
- используют в промышленности при производстве огнеупорных материалов, цемента, для очистки от примесей нефтепродуктов, в качестве наполнителя при производстве резиновых изделий;
- в качестве абразива для очистки различных поверхностей в промышленности;
- в пищевой промышленности в качестве добавки E530;
- спортсмены используют жженую магнезию в качестве присыпки, чтобы не соскальзывать со снарядов;
- в медицине – для нейтрализации соляной или других кислот в желудке.
Фармакологическое действие
Противоязвенное, стимулирующее перистальтику кишечника, противовоспалительное, антацидное.
Фармакодинамика и фармакокинетика
Магния Оксид после попадания в пищеварительный тракт под действием воды превращается в гидроксид. Вещество нейтрализует соляную кислоту, снижает активность пищеварительных ферментов в целом. После приема лекарства на голодных желудок антацидный эффект сохраняется на протяжении получаса. При приеме после еды – до 4 часов.
В желудке также образуется магния хлорид, который, при проникновении в кишечник, увеличивает осмотическое давление, оказывает слабительное действие, усиливая перистальтику кишечника.
Вещество не всасывается через стенки желудка и не проникает в системный кровоток. Вторичной гиперсекреции при лечении средством не наблюдается. Лекарство не вызывает алкалоз.
При сочетании средства с пиридоксином снижается интенсивность образования оксалата кальция. Такая комбинация лек. препаратов предупреждает образование оксалатных камней.
Показания к применению
Лекарство назначают:
- при остром гастрите, при обострении хронического гастрита с повышенной или нормальной секрецией желудочных кислот;
- пациентам с обострением язвы желудка и 12-перстной кишки;
- больным с гастралгией, диспепсией после приема лекарств, нарушения диеты, употребления алкоголя, кофе или никотина;
- при рефлюкс-эзофагите;
- пациентам с панкреатитом;
- для лечения запоров;
- после отравления кислотами;
- в комбинации с прочими лекарствами для профилактики оксалатного нефроуролитиаза.
Противопоказания
Вещество не используют:
- при гипермагниемии;
- при повышенной чувствительности.
Не все лекарственные формы можно применять в педиатрической практике.
Побочные действия
Магния Оксид может спровоцировать диарею, диспепсию, аллергические реакции.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. В среднем разовая дозировка составляет 250 мг – 2,5 грамма. Кратность применения зависит от показаний.
Передозировка
Данные о передозировке отсутствуют.
Взаимодействие
Магния Оксид уменьшает побочные реакции от приема антацидных средств с алюминием, увеличивает продолжительность их действия.
При сочетании препарата с индометацином снижается плазменная концентрация последнего, уменьшается раздражающее действие лекарства на пищеварительный тракт.
Лекарство снижает скорость всасывания нитрофурантоина, солей железа и тетрациклина.
Вещество замедляет всасывание азитромицина, снижает его максимальную концентрацию в крови и время достижения этой концентрации. Такая комбинация не рекомендуется.
Особые указания
Особую осторожность рекомендуется соблюдать пациентам с заболеваниями почек. При длительном лечении может возникнуть гипермагниемия.
Лекарство часто пьют совместно с антацидами алюминия, чтобы снизить побочные эффекты со стороны пищеварительной системы и увеличить продолжительность действия препарата.
Детям
Средство редко применяют в педиатрической практике. Не все лекарственные формы можно использовать у детей.
При беременности и лактации
Можно назначать во время кормления грудью и при беременности.
Препараты, в которых содержится (Аналоги)
Торговое название вещества: Окись Магния.
Отзывы
Отзывов об использовании лекарства практически нет. Некоторые отмечают, что его сложно приобрести в аптеке. Отрицательных отзывов о применении средства не обнаружено.
Цена, где купить
Купить Оксид Магния, дозировкой 400 мг – таблетки, можно приблизительно за 600 рублей, 60 штук.
Источник
