Какие свойства проявляет оксиды ванадия

- Авторы
- Файлы
- Литература
Токарева А.А.
1
Неёлова О.В.
1
1 Северо-Осетинский государственный университет им. К.Л. Хетагурова
1. Неорганическая химия: в 3 т. / под ред. Ю.Д. Третьякова. Т. 3: Химия переходных элементов. Кн. 1: учебник для студ. высш. учеб. заведений / [А.А. Дроздов, В.П. Зломанов, Г.Н. Мазо, Ф.М. Спиридонов]. – М.: Издательский центр «Академия». 2008. – 352 с.
2. Ахметов Н.С. Общая и неорганическая химия: учеб. для вузов. – М.: Высшая школа, 1998. – 743 с.
Целью работы является изучение литературных данных о свойствах ванадия и его соединениях и экспериментальное получение соединений ванадия, в том числе и гидроксидов, в различных степенях окисления, изучение их свойств.
С кислородом ванадий образует несколько оксидов: VO, V2O3, VO2, V2O5. Им соответствуют гидроксиды: V(OH)2, V(OH)3, VО(OH)2 и НVO3. VO и V(OH)2 проявляют основные свойства, V2O3 и V(OH)3 – амфотерные с преобладанием основных свойств, VO2 и VО(OH)2 – амфотерные свойства и V2O5 и НVO3 – амфотерные с преобладанием кислотных свойств [1].
Коричневый гидроксид V(OH)2, образующийся при действии щелочей на растворы солей V(II), проявляет основные свойства и очень быстро окисляется до гидроксида ванадия (III):
VSO4 + 2NaOH = V(OH)2↓+ Na2SO4.
Для получения и сохранения V(OH)2 требуется инертная атмосфера.
Действуя на соли ванадия (III) щелочью, можно получить гидроксид V(OH)3, который выделяется при рН 4-5 в виде рыхлого грязно-зеленого осадка. Гидроксид ванадия (III) проявляет свойства основания в большей степени, чем гидроксид Cr(III). Это вещество является сильным восстановителем, на воздухе легко окисляется, постепенно переходя в оксоформу VO(OH)2 коричневого цвета:
V2(SO4)3 + 6NaOH = 2V(OH)3 + 3Na2SO4,
4V(OH)3 + O2 = 4VO(OH)2 + 2H2O.
Гидроксид ванадия (III) не реагирует с растворами щелочей, однако ванадаты (III) (гипованадиты), например KVO2 могут быть получены нагреванием оксида ванадия (IV) с оксидом калия:
2K2O + 4VO2 = 4KVO2 + O2.
При обычных условиях степень окисления +4 для ванадия наиболее характерна. Соединения V(III) довольно легко окисляются до производных V(IV) молекулярным кислородом, а соединения V(V) восстанавливаются до производных V(IV). Наиболее устойчивое координационное число ванадия (IV) равно 6. Оксид VO2 амфотерен; при растворении VО2 и его гидратов в неокисляющих кислотах образуются растворы солей ванадия, при растворении VO2 в щелочах – растворы солей тетраванадистой кислоты или оксованадаты (IV) (бурого цвета), чаще всего состава M2+1 [V4O9] [2]. Соли ванадила получают восстановлением ванадиевого ангидрида в кислом растворе этиловым спиртом, щавелевой кислотой, соляной кислотой, сернистым газом, тиосульфатом, роданидом и др. При взаимодействии ионов VO2+ и OH- в соотношении 1:2 выпадает коричневый осадок гидроксида VO(OH)2:
VOSO4 + 2NaOH = VO(OH)2 + Na2SO4.
В избытке щелочи осадок растворяется с образованием желто- коричневых растворов, содержащих различные ванадат (IV)- ионы [1].
Среди оксидов ванадия наиболее устойчив, известен, важен ванадиевый ангидрид V2O5 желто-оранжевого цвета. Водные растворы V2О5 имеют кислую реакцию, реагируя со щелочами, дают соли. В щелочном растворе присутствуют разнообразные оксоанионы, состав которых зависит от концентрации ванадия и рН среды.
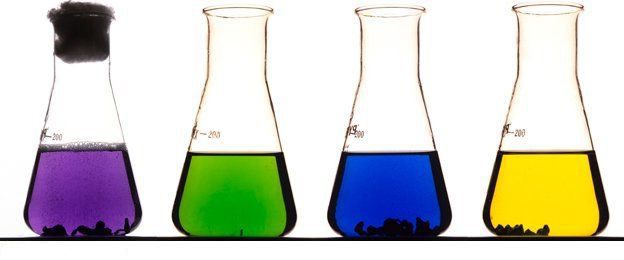
При восстановлении цинком раствора NaVO3 в сернокислой среде экспериментально получены соединения ванадия VOSO4, V2(SO4)3, VSO4 соответственно синего, зеленого и фиолетового цвета:
2NaVO3 + Zn + 4H2SO4 =
= 2VOSO4 + ZnSO4 + Na2SO4 + 4H2O,
2VOSO4 + Zn + H2SO4 = V2(SO4)3 + ZnSO4 + 2H2O,
V2(SO4)3 + 2Zn + H2SO4 = 2VSO4 + 2ZnSO4 + H2.
Осадок разделяют на две части: к первой части добавляют 10 мл 2 М раствора H2SO4, наблюдая растворение осадка и окрашивание раствора в бледно – фиолетовый цвет:
V(OH)2↓ + H2SO4 = VSO4 + 2H2O.
К другой части осадка приливают 10 мл 2 М раствора NaOH, не отмечая никаких изменений.
V(OH)2 – гидроксид с основными свойствами.
К раствору соли V2(SO4)3 зеленого цвета прибавляют 2 М раствор NaOH, наблюдают образование коричневого осадка V(OH)3, растворимого и в кислотах и щелочах:
V(OH)3↓ + H2SO4 = V2(SO4)3 + 3H2O (раствор становится бледно-бирюзового цвета),
V(OH)3↓ + NaOH = Na[V(OH)4] (раствор становится светло-коричневого цвета).
Библиографическая ссылка
Токарева А.А., Неёлова О.В. ОКСИДЫ И ГИДРОКСИДЫ ВАНАДИЯ, ИХ СВОЙСТВА И ПОЛУЧЕНИЕ // Международный студенческий научный вестник. – 2015. – № 3-4.;
URL: https://eduherald.ru/ru/article/view?id=14206 (дата обращения: 28.01.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
К середине XX века в химической науке появился термин – металлы стратегического значения. Под ним подразумевали группу элементов, физико-химические свойства которых позволяли их использовать в производствах военно-промышленного комплекса. Речь идет о таких металлах, как хром, тантал, ниобий, молибден и вольфрам. Ванадий, свойства которого мы рассмотрим в данной статье, также по праву занимает одно из центральных мест среди металлов, применяемых в современном машиностроении, черной металлургии, инструментальном и химическом производстве. Металл образует с кислородом четыре оксида, проявляя в них валентность, равную 2, 3, 4 и 5. Наибольший практический интерес представляет соединение с наивысшей степенью окисления металла – V2O5, которое мы изучим более подробно.

Знакомимся с ванадием
В химической науке существует давно устоявшееся правило, гласящее, что характеристику химического элемента нужно начинать с его положения в периодической системе Д.И. Менделеева. Химическая формула ванадия как простого вещества – V, порядковый номер – 23, атомная масса – 50,9414. Он располагается в четвертом периоде, пятой группе и, вместе с ниобием и танталом, является типичным представителем тугоплавких металлов. Образцы чистого вещества пластичны и имеют серебристо-серый цвет. Атом ванадия является d-элементом, имеет на последнем энергетическом уровне два s-электрона, однако валентными будут также и те отрицательные частицы, которые расположены на d-подуровне этого же четвертого уровня.
Где встречается металл и каковы его физические свойства
Сам элемент в чистом виде в природе не найти. Зато он присутствует в качестве обязательного компонента в полиметаллических и железных рудах. Ранее мы говорили о пластичности и ковкости простого вещества, теперь добавим, что важные физические свойства ванадия – это высокие температуры кипения и плавления, равные, соответственно, 3400 °С и 1920 °С. Подобно титану он резко ухудшает свои физико-химические параметры при загрязнении такими примесями, как азот, водород или кислород. В частности, снижаются его пластичность и механическая прочность, и ванадий становится хрупким.
Особенные химические свойства
Металл способен к пассивации, т.е. имеет уникальную способность противостоять действию агрессивных химических сред: растворам кислот, щелочей и солей, образуя на своей поверхности защитную пленку – оксид ванадия. Кристаллическая решетка элемента имеет кубическую структуру. Отметим также, что антикоррозионная стойкость сталей, содержащих элемент, очень высока, что позволяет использовать их в качестве несущих креплений опор мостов и морских нефтяных буровых установок. Нельзя представить без ванадийсодержащих сталей и современное инструментальное производство. Вместе с ниобием, хромом и титаном элемент применяют для легирования специальных сплавов, применяемых в ракетостроении и космической промышленности. Однако концентрированная нитратная и сульфатная кислоты, раствор фтороводорода в воде и смесь хлоридной и нитратной кислот, называемая царской водкой, легко взаимодействуют с металлом. Элемент ванадий как простое вещество может реагировать с хлором, бромом, серой, при этом образуются соответствующие соли. С кислородом дает несколько оксидов, сильно отличающихся между собой своими химическими свойствами. Рассмотрим их далее.

Основные и амфотерные оксиды
Металл образует два оксида – VO и V2O3, которые проявляют типичные основные свойства. В лаборатории монооксид добывают реакцией восстановления V2O5 мелкодисперсным порошком ванадия. Основные оксиды реагируют с растворами кислот, образуя соответствующие соли. А уже из них можно получить гидроксиды, проводя реакцию обмена со щелочами. Оксид ванадия (III) обнаруживается в качестве компонента минерала карелианита, а получают его в лабораторных условиях при нагревании V2O5 с серой, углем или водородом. Оба основных оксида имеют сильно выраженные восстановительные свойства. Оксид VO2 – это типичное амфотерное соединение, вступающее в реакцию как с кислотами, так и со щелочами. В растворе, pH которого меньше 7, обнаруживаются положительно заряженные ионы ванадила VO2+, придающие раствору светло-синий цвет, а в щелочной среде образуются соли поливанадиевой кислоты. Оксид ванадия (IV) притягивает воду, т.е. является гигроскопичным веществом, в реакциях ведет себя, как восстановитель.

Гемипентоксид ванадия
Соединение, формула которого V2O5, – наиболее важный оксид металла. Это водоростворимое кристаллическое вещество оранжевого цвета, реагирующее со щелочами с образованием ванадатов – солей метаванадиевой кислоты HVO3. Широко применяется в качестве катализатора в реакции окисления двуокиси серы до серного ангидрида в промышленном производстве сульфатной кислоты. Пятиокись ванадия имеет ромбическую кристаллическую решетку и признаки амфотерности с преобладанием свойств кислотного оксида. В реакциях ведет себя как сильный окислитель. Соединение применяют в технологиях стекловарения, медицине и в органическом синтезе.
Способы извлечения ванадия из его соединений
Ранее мы упоминали о том, что металл является компонентом железной руды. В доменном производстве элемент вместе с примесями углерода и фосфора переходит в чугун. При выплавке стали оксид ванадия 5 осаждается в составе шлака, где его содержание может достигать 16 %. Добавляя к нему поваренную соль и проводя обжиг смеси в печах, получают продукт, который в дальнейшем растворяют в воде. Полученный водный концентрат обрабатывают сульфатной кислотой и выделяют из него V2O5. Чтобы выделить из оксида чистый ванадий, можно воспользоваться методом кальциетермии – восстановлением металлов с помощью металлического кальция. Для снижения технологических затрат в реакции с пятиокисью ванадия вместо кальция часто используют алюминий. Металл можно получить и восстановлением оксида трехвалентного ванадия углем.
Биологическая роль
Ванадий присутствует в живых организмах как микроэлемент, входящий в состав межклеточной жидкости морских иглокожих. У голотурий и морских ежей он связан с белками, которые выполняют функцию транспортировки к клеткам кислорода и удаления углекислого газа. Незначительно содержание элемента в организмах теплокровных животных и человека, где он находится в составе ферментов поджелудочной железы, в нейроглии и нефронах. В растениях микроэлемент участвует в качестве фермента темновой фазы фотосинтеза и влияет на уровень пигмента хлорофилла, находящегося в хлоропластах. Он также обнаруживается в клубеньковых бактериях, являющихся азотофиксаторами, в тканях высших грибов. В составе чернозема, наряду с соединениями бора, меди, цинка и марганца, оксид ванадия влияет на плодородие почвы.

В нашей статье мы изучили основные свойства ванадия и его оксидов, а также рассмотрели применение его соединений в промышленности.
Источник
Ванадий взаимодействует с кислородом, образуя достаточно большое разнообразие оксидов, важнейшими из которых являются VO, V2O3, VO2, V2O5.
Между оксидами V2O5 и VO2 имеются промежуточные оксиды состава VnO2n+1 (наиболее изучены V3O7, V4O9, V6O13).
Между оксидами VO2 и V2O3 имеются промежуточные оксиды состава VnO2n-1, со структурой, близкой к структуре рутила: V3O5 и фазы Магнели (V4O7, V5O9, V6O11, V8O15), представляющие собой темные порошки, обладающие парамагнитными свойствами, которые можно менять путем введения различных примесей.
Оксид ванадия VO(II)
- твердое и хрупкое порошкообразное вещество черного цвета, обладающее металлической проводимостью;
- температура плавления = 1830°C;
- структура кристаллической решетки аналогична хлориду натрия;
- проявляет свойства оснОвного оксида;
- не реагирует с водой и щелочами;
- медленно растворяется с кислотами, за исключением азотной, с которой хорошо взаимодействует;
- при нагревании на воздухе окисляется до высших оксидов.
Оксид ванадия V2O3(III)
- черный тугоплавкий порошок;
- температура плавления = 1970°C;
- структура кристаллической решетки сходна со структурой корунда α-Al2O3;
- при охлаждении до -105°C появляется металлическая проводимость;
- при нагревании на воздухе окисляется до высших оксидов (IV – 350°C; V – 500°C);
- при нагревании до 1300°C восстанавливается углеродом до металла;
- с щелочными металлами вступает в реакцию при нагревании выше 1000°C;
- при температуре 900-1350°C расплавленным кальцием восстанавливается до ванадия;
- является амфотерным оксидом с преобладанием оснОвных свойств;
- реагирует с кислотами, образуя соли зеленого цвета;
- с растворами щелочей не взаимодействует;
- в кислой и нейтральной среде водными растворами KClO3, KIO3, NaIO4 окисляется до V2O5;
- с оксидами различных металлов при нагревании образует ванадаты (LiVO2, NaVO2) и смешанные оксиды (AlVO3, MgVO4);
- получают восстановлением ванадиевого ангидрида водородом или аммиаком при температуре 450°C:
3V2O5+4NH3 → 3V2O3+2N2+6H2O
Оксид ванадия VO2(IV)
- кристаллы черно-синего цвета, нерастворимые в воде;
- температура плавления = 1545°C;
- существует в двух модификациях, с обратимым фазовым переходом:
- низкотемпературная α-модификация (до 70°C) имеет моноклинную искаженную структуру кристаллической решетки;
- высокотемпературная β-модификация представляет тетрагональную структуру по типу рутила, обладает хорошей электрической проводимостью и магнитной восприимчивостью.
- проявляет амфотерные свойства;
- с кислотами реагирует с образованием солей диоксованадия (IV);
- с щелочами образует ванадаты (IV);
- получают спеканием эквимолярной смеси V2O3 и V2O5 при температуре 800°C;
- диоксид ванадия также получают восстановлением высшего оксида сернистым газом (350-580°C) или раствором водной глюкозы.
Оксид ванадия V2O5(V)
- ядовитый порошок желто-оранжевого цвета, является основным продуктом химической технологии ванадия;
- слаборастворим в воде, хорошо растворяется в спирте;
- температура плавления 680°C;
- в лабораторных условиях получают разложением на воздухе метаванадата аммония при температуре 350°C:
2NH4VO3 → V2O5+2NH3+H2O - является амфотерным оксидом, но проявляет кислотные свойства, поэтому, его еще называют ванадиевым ангидридом;
- легко реагирует с кислотами, образуя растворы желтого цвета;
- взаимодействует с щелочами с образованием ванадатов бесцветного или оранжево-желтую окраску (в зависимости от концентрации щелочи);
- в водных растворах восстанавливается, например, галогеноводородными кислотами до ванадия(IV):
V2O5+6HCl = 2VOCl2+Cl2↑+3H2O - с фтором и хлором образует оксогалогениды (450°C);
- восстанавливается серой до VO2 (300°C) и V2O3 (448°C);
- в среде угарного и углекислого газа при температуре 600°C восстанавливается до V2O3;
- с углеродом реагирует с образованием различных веществ:
- 600°C – V6O13
- 750°C – смесь V6O13, VO2, V3O5
- 800°C – смесь V2O3 и оксокарбонатов
- 1000°C – V2O3
Оксиды ниобия и тантала
Оксиды ниобия и тантала не так хорошо изучены, как оксиды ванадия.
- высшие оксиды Nb и Ta – белые инертные порошки;
- температура плавления = 1490°C (Nb2O5), 1870°C (Ta2O5);
- практически не проявляют окислительных свойств;
- реагируют со щелочами при 500°C с образованием ниобатов и танталатов:
Nb2O5+2NaOH → 2NaNbO3+H2O - растворяются в концентрированных растворах щавелевой кислоты с образованием оксооксалатных комплексов;
- температура плавления высших оксидов возрастает сверх-вниз в группе, что объясняется увеличением степени ионности связи;
- при 1000°C оксид Nb2O5 восстанавливается водородом до NbO2 – порошка черного цвета со структурой рутила;
- при дальнейшем нагревании (1700°C) NbO восстанавливается водородом или ниобием до NbO – вещества серого цвета с кубической структурой кристаллической решетки и металлическим типом проводимости;
- тантал не склонен к образованию низших оксидов, в литературе описаны TaO2, Ta2O3, TaO, Ta2O.
Источник
| Оксид ванадия V | |
|---|---|
| Систематическое наименование | Оксид ванадия V |
| Хим. формула | V2O5 |
| Рац. формула | V2O5 |
| Состояние | твёрдое |
| Молярная масса | 181.88 г/моль |
| Плотность | 3,357 г/см³ |
| Температура | |
| • плавления | 670 °C |
| • кипения | 2030 °C |
| • разложения | 3182 ± 1 °F |
| Мол. теплоёмк. | 127,7 Дж/(моль·К) |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,35 г/100 мл |
| Кристаллическая структура | ромбическая |
| Рег. номер CAS | 1314-62-1 |
| PubChem | 14814 |
| Рег. номер EINECS | 215-239-8 |
| SMILES | O=[V](=O)O[V](=O)=O |
| InChI | 1S/5O.2V GNTDGMZSJNCJKK-UHFFFAOYSA-N |
| RTECS | YW2450000 |
| ChEBI | 30045 |
| Номер ООН | 2862 |
| ChemSpider | 14130 |
| ЛД50 | 10 мг/кг |
| Токсичность | Чрезвычайно токсичен (СДЯВ), яд общетоксического действия, нейротоксичен, канцерогенен, мутагенен, ирритант. |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |

Оксид ванадия (пентаоксид диванадия) — неорганическое соединение.
Физические свойства
Порошкообразное ядовитое вещество бледно-оранжевого цвета. Также встречаются кристаллы жёлто-красного цвета. Плотность 3,34 г/см3. Температура кипения +1827 °C. Температура плавления +680 °C. Диамагнетик. Полупроводник n-типа. Хорошо растворяется в этаноле, щелочах, кислотах. Растворимость в воде незначительна (0,07 г/л при 25°С).

Химические свойства
Незначительно растворяется в воде, с образованием бледно-жёлтого раствора, содержащего метаванадиевую кислоту HVO3, которая сообщает раствору кислую реакцию. Проявляет амфотерные свойства (с преобладанием кислотных). При сплавлении с щелочами образуются хорошо растворимые в воде ортованадаты:
V2O5 + 6 KOH → 2 K3VO4 + 3 H2O V2O5 + 6 NaOH → 2 Na3VO4 + 3 H2O
Соединения ванадия V являются сильными окислителями. Так, например, концентрированная соляная кислота окисляется оксидом ванадия до свободного хлора:
V2O5 + 6 HCl → 2 VOCl2 + Cl2 + 3 H2O
Окислительная активность пентаоксида ванадия из нефти и нефтепродуктов
Оксид ванадия V, образующийся в результате выжигания остатков нефтяного кокса на крекирующих катализаторах (регенерации катализаторов) реагирует с их цеолитной компонентой и необратимо дезактивирует («отравляет») их, разрушая их активную кристаллическую структуру, причём этот процесс усиливается при высоких температурах и в присутствии ионов натрия. Аналогичная проблема встаёт и до крекинга, при каталитическом гидрообессеривании нефти и тяжёлых нефтяных фракций.
Кроме того, пятиокись ванадия в дымовых газах от сгорания ванадийсодержащего горючего корродирует поверхности нагрева жаростойких деталей двигателей внутреннего сгорания и паровых котлов, причём особенно подвержены ванадиевой коррозии лопатки газовых турбин. При температурах выше 650 °C находящийся в полужидком состоянии V2O5 катализирует процесс окисления металла турбинных лопаток кислородом и в то же время растворяет продукты этого окисления, причём этот процесс усиливается серой и натрием (плавящийся при 625 °C ванадилванадат натрия Na2O·V2O4·5V2O5 растворяет защитную плёнку оксидов железа на поверхности стали).


Применение
Компонент специальных стёкол, глазурей и люминофоров красного свечения. Он широко применяется в качестве положительного электрода (анода) в мощных литиевых батареях и аккумуляторах.
Оксид ванадия может быть использован, чтобы стимулировать центры окраски в корунде (минерал Al2O3), для создания имитации александрита, хотя александрит в природе является хризобериллом (BeAl2O4).
Катализаторы из оксида ванадия V используют в производстве серной кислоты по методу фирмы «Монсанто» для окисления диоксида серы до триоксида, для окисления углеводородов, получения уксусной и муравьиной кислот, получения фталевого и малеинового ангидридов, анилиновых красителей.

Получение
Получают при сжигании металлического ванадия в кислороде под давлением. Также получают прокаливанием на воздухе или в кислороде других оксидов: VO, V2O3, VO2. Так же можно получить прокаливанием метаванадата аммония:
4 NH4VO3 + 3 O2 →to 2 V2O5 + 2 N2 ↑ + 8 H2O
При гидролизе хлорида ванадия V и бромида ванадия V. При взаимодействии с V2O5 образуются ванадаты — соли ванадиевой кислоты, H2[O(V2O5)2,5]

Токсичность
Оксид ванадия V ядовит. Смертельная доза (ЛД50) для крыс орально — 10 мг. Смертельная доза для человека орально примерно — 1 г. Яд общетоксического действия, влияет на ЦНС, канцерогенен, мутагенен, ирритант. ПДК в воздухе рабочей зоны составляет 0,5 мг/м3, что в два раза меньше ПДК хлора. При вдыхании вызывает раздражение дыхательной системы, при долгом контакте вызывает патологические изменения в организме, может отражаться на здоровье будущих детей. Наносит большой и долгосрочный вред окружающей среде при попадании в водоемы.
Нахождение в природе
В природе встречается в виде минерала щербинаита, а также в составе ванадиевых руд.
Источник
