Какие свойства проявляет сероводород

Сероводород
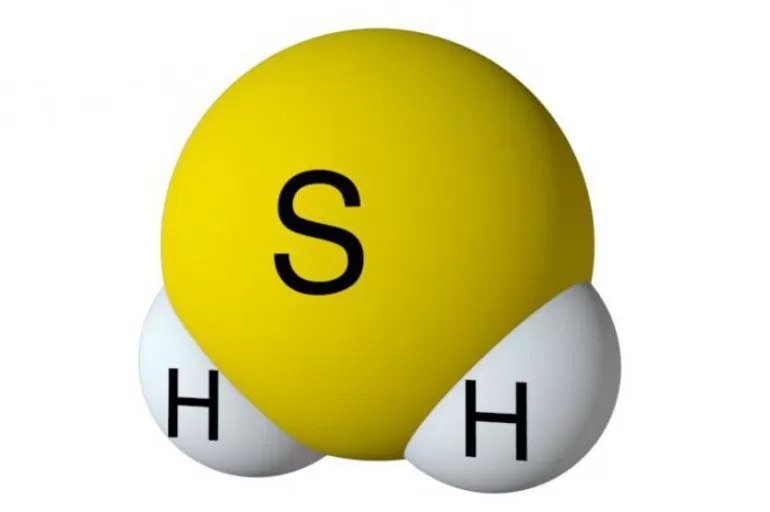
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.

Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
СЕРОВОДОРОД
Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит,
растворим в воде (в 1V
H2O растворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Влияние сероводорода на организм:
Сероводород не толькоскверно
пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом
количестве быстро наступает паралич дыхательных нервов, и тогда человек
перестает ощущать запах – в этом и заключается смертельная опасность
сероводорода.
Насчитывается
множество случаев отравления вредным газом, когда пострадавшими были
рабочие, на ремонте трубопроводов. Этот газ тяжелее, поэтому он
накапливается в ямах, колодцах, откуда быстро выбраться не так-то
просто.
Получение
1)
H2
+ S
→ H2S↑ (при t)
2)
FeS
+ 2HCl
→ FeCl2
+ H2S↑
Химические свойства
1) Раствор H2S в воде – слабая двухосновная кислота.
Диссоциация происходит в две ступени:
H2S → H+
+ HS-
(первая ступень, образуется гидросульфид – ион)
HS- → 2H+ + S2-
(вторая ступень)
Сероводородная
кислота образует два ряда солей – средние (сульфиды) и кислые (гидросульфиды):
Na2S – сульфид натрия;
CaS
– сульфид кальция;
NaHS
– гидросульфид натрия;
Ca(HS)2 – гидросульфид
кальция.
2)
Взаимодействует с основаниями:
H2S + 2NaOH(избыток) → Na2S + 2H2O
H2S (избыток) + NaOH → NaНS + H2O
3) H2S проявляет очень сильные
восстановительные свойства:
H2S-2
+ Br2 → S0 + 2HBr
H2S-2
+ 2FeCl3 → 2FeCl2 + S0 + 2HCl
H2S-2
+ 4Cl2 + 4H2O →
H2S+6O4 + 8HCl
3H2S-2
+ 8HNO3(конц) → 3H2S+6O4
+ 8NO + 4H2O
H2S-2
+ H2S+6O4(конц) → S0 + S+4O2 +
2H2O
(при нагревании реакция идет по – иному:
H2S-2 + 3H2S+6O4(конц)
→ 4S+4O2 + 4H2O
4) Сероводород
окисляется:
при
недостатке O2
2H2S-2 +
O2
→ 2S0
+
2H2O
при избытке O2
2H2S-2
+ 3O2 → 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом
чернеет:
4Ag
+ 2H2S + O2
→ 2Ag2S↓ + 2H2O
Потемневшим
предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с
раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до
металла, а раствор соды удерживает ионы серы.
6) Качественная реакция на сероводород и
растворимые сульфиды – образование темно-коричневого (почти черного) осадка PbS:
H2S +
Pb(NO3)2 → PbS↓ + 2HNO3
Na2S
+ Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+
+
S2-
→
PbS↓
Загрязнение атмосферы вызывает почернение
поверхности картин, написанных масляными красками, в состав которых входят
свинцовые белила. Одной
из основных причин потемнения художественных картин старых мастеров было
использование свинцовых белил, которые за несколько веков, взаимодействуя со
следами сероводорода в воздухе (образуются в небольших количествах при гниении
белков; в атмосфере промышленных регионов и др.) превращаются в PbS. Свинцовые белила – это пигмент, представляющий
собой карбонат свинца (II).
Он реагирует с сероводородом, содержащимся в загрязнённой атмосфере, образуя
сульфид свинца (II),
соединение чёрного цвета:
PbCO3 + H2S = PbS↓ + CO2 + H2O
При обработке сульфида свинца (II) пероксидом водорода происходит реакция:
PbS +
4H2O2 = PbSO4 + 4H2O,
при этом образуется сульфат свинца (II), соединение белого цвета.
Таким образом реставрируют почерневшие
масляные картины.

7) Реставрация:
PbS
+ 4H2O2
→ PbSO4(белый)
+ 4H2O
Сульфиды
Получение сульфидов
1) Многие сульфиды получают нагреванием
металла с серой:
Hg
+ S
→
HgS
2) Растворимые
сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH →
K2S + 2H2O
3) Нерастворимые
сульфиды получают обменными реакциями:
CdCl2
+ Na2S → 2NaCl + CdS↓
Pb(NO3)2
+ Na2S → 2NaNO3 + PbS↓
ZnSO4
+ Na2S → Na2SO4 + ZnS↓
MnSO4
+ Na2S → Na2SO4 + MnS↓
2SbCl3
+ 3Na2S → 6NaCl + Sb2S3↓
SnCl2
+ Na2S → 2NaCl + SnS↓
Химические свойства сульфидов
1) Растворимые
сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют
щелочную реакцию:
K2S +
H2O → KHS + KOH
S2- +
H2O → HS- + OH-
2) Сульфиды
металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в
сильных кислотах:
ZnS + H2SO4
→ ZnSO4 + H2S
3)
Нерастворимые сульфиды можно перевести в растворимое состояние действием
концентрированной HNO3:
FeS2
+ 8HNO3 → Fe(NO3)3 + 2H2SO4
+ 5NO + 2H2O
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu →CuS →H2S →SO2
Задание №2
Составьте
уравнения окислительно-восстановительных реакций полного и неполного
сгорания сероводорода. Расставьте коэффициенты методом электронного
баланса, укажите окислитель и восстановитель для каждой реакции, а так
же процессы окисления и восстановления.
Задание №3
Запишите
уравнение химической реакции сероводорода с раствором нитрата свинца
(II) в молекулярном, полном и кратком ионном виде. Отметьте признаки
этой реакции, является ли реакция обратимой?
Задание №4
Сероводород пропустили через 18%-ый раствор сульфата меди (II) массой
200 г. Вычислите массу осадка, выпавшего в результате этой реакции.
Задание №5
Определите объём сероводорода (н.у.), образовавшегося при взаимодействии
соляной кислоты с 25% – ым раствором сульфида железа (II) массой 2 кг?
Источник
Сероводород (H₂S) представляет собой бесцветный газ c запахом тухлых яиц. По плотности он тяжелее водорода. Сероводород смертельно ядовит для человека и животных. Даже незначительное его содержание в воздухе вызывает головокружение и тошноту, но самым страшным является то, что при длительном его вдыхании этот запах уже не ощущается.
Однако при отравлении сероводородом существует простое противоядие: следует завернуть в платок кусок хлорной извести, затем смочить, и какое-то время нюхать этот сверток.
Сероводород получают путем взаимодействия серы с водородом при температуре 350 °С:
H₂ + S → H₂S↑
Это окислительно-восстановительная реакция: в ходе нее изменяются степени окисления участвующих в ней элементов.
В лабораторных условиях сероводород получают воздействием на сульфид железа серной или соляной кислоты:
FeS + 2HCl → FeCl₂ + H₂S
Это реакция обмена: в ней взаимодействующие вещества обмениваются своими ионами. Данный процесс обычно проводят с помощью аппарата Киппа.
Свойства сероводорода
При горении сероводорода образуется оксид серы 4 и водяной пар:
2H₂S + 3О₂ → 2Н₂О + 2SO₂
H₂S горит голубоватым пламенем, а если над ним подержать перевернутый химический стакан, то на его стенках появится прозрачный конденсат (вода).
Однако при незначительном понижении температуры данная реакция проходит несколько иначе: на стенках предварительно охлажденного стакана появится уже желтоватый налет свободной серы:
2H₂S + О₂ → 2Н₂О + 2S
На этой реакции основан промышленный способ получения серы.
При поджигании предварительно подготовленной газообразной смеси сероводорода и кислорода происходит взрыв.
Реакция сероводорода и оксида серы(IV) также позволяет получить свободную серу:
2H₂S + SО₂ → 2Н₂О + 3S
Сероводород растворим в воде, причем три объема этого газа могут раствориться в одном объеме воды, образуя слабую и нестойкую сероводородную кислоту (Н₂S). Эту кислоту также называют сероводородной водой. Как видите, формулы газа-сероводорода и сероводородной кислоты записываются одинаково.
Если к сероводородной кислоте прилить раствор соли свинца, выпадет черный осадок сульфида свинца:
H₂S + Pb(NO₃)₂ → PbS + 2HNO₃
Это качественная реакция для обнаружения сероводорода. Она же демонстрирует способность сероводородной кислоты вступать в реакции обмена с растворами солей. Таким образом, любая растворимая соль свинца является реактивом на сероводород.
Некоторые другие сульфиды металлов также имеют характерную окраску, например: сульфид цинка ZnS — белую, сульфид кадмия CdS — желтую, сульфид меди CuS — черную, сульфид сурьмы Sb₂S₃ — красную.
Кстати, сероводород является нестойким газом и при нагревании практически полностью разлагается на водород и свободную серу:
H₂S → Н₂ + S
Сероводород интенсивно взаимодействует с водными растворами галогенов:
H₂S + 4Cl₂ + 4H₂O→ H₂SO₄ + 8HCl
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют:
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода).
Еще одно из недавно появившихся направлений в науке — сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Н₂⁰ + S⁰→ H₂⁺S²⁻
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода — протон:
Н⁰ -1е⁻= Н⁺
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻. Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов. Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
2S⁰ + 3O2⁰ → 2S⁺⁶O₃⁻²
Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
S⁰ + О2⁰ → S⁺4 O2⁻²
Сера может отдать также два электрона c образованием хлорида серы(II) :
S⁰ + Cl2⁰ → S⁺² Cl2⁻
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl.
Однако в случае образования H2S окисление — удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми. В результате этого каждый атом водорода в его молекуле становится протоном:
Н2⁰-2е⁻ → 2Н⁺,
а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²):
S⁰ + 2е⁻ → S⁻²
Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода — реакция получения свободной серы:
2H₂⁺S-²+ S⁺⁴О₂-²→ 2H₂⁺O-²+ 3S⁰
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² – 4е⁻→ 2S⁰ — восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ — окислитель, восстанавливается.
Источник
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений. В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м. Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики

Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34. 10-29 Кл.м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O. Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O. Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.

В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S-2 = 2HBr + S0.
- 4Cl 2 + 4H 2 O +H 2 S-2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S-2 = S0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии. Средние соли с содержанием аниона S2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными. Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М2+(Н S)2 и M+ HS. Нестойкими являются гидросульфиды Ca2+ Sr2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот. Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно. В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения. Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом. Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:

- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий. Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров. Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.

Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси. Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие. Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа. Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови. В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.
В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.

Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей. Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.
Источник
