Какие свойства проявляют бинарные соединения

Бинарные соединения – это вещества, которые образованы двумя различными химическими элементами. Этот термин применяют при обозначении качественного и количественного состава неорганических соединений.
Бинарные химические соединения считаются важным объектом в изучении природы веществ. При их описании используют следующие понятия: поляризация связи, степень окисления, валентность. Данные химические термины позволяют понять суть образования химической связи, особенности строения неорганических веществ.
Рассмотрим основные классы бинарных соединений, особенности их химического строения и свойства, некоторые области их промышленного применения.

Оксиды
Данный класс неорганических веществ является самым распространенным в природе. Среди известных представителей этой группы соединений выделим:
- оксид кремния (речной песок);
- оксид водорода (вода);
- углекислый газ;
- глина (оксид алюминия);
- железняки (оксиды железа).
Такие бинарные соединения – это сложные вещества, в составе которых обязательно присутствует кислород, проявляющий степень окисления -2.
Агрегатное состояние оксидов
Соединения меди, кальция, железа являются кристаллическими твердыми веществами. Такое же агрегатное состояние имеют оксиды некоторых неметаллов, например шестивалентной серы, пятивалентного фосфора, кремния. Жидкостью при нормальных условиях является вода. Подавляющее большинство кислородных соединений неметаллов являются газами.
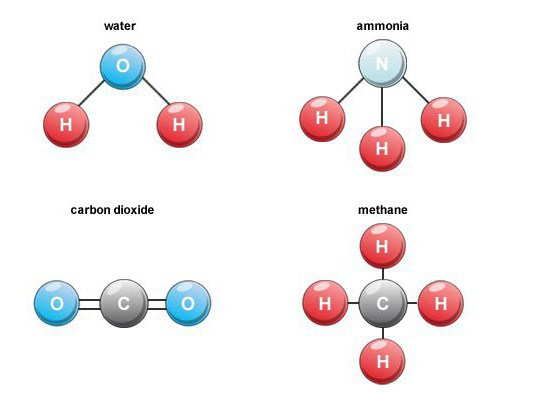
Особенности образования
Многие бинарные кислородные соединения образуются в природе. Например, при сгорании топлива, дыхании, гниении органических веществ формируется углекислый газ (оксид углерода 4). В воздухе его объемное содержание составляет около 0,03 процентов.
Подобные бинарные соединения – это продукты деятельности вулканов, а также составная часть минеральной воды. Углекислый газ не поддерживает горения, поэтому данное химическое соединение применяется для тушения пожаров.
Летучие водородные соединения
Такие бинарные соединения – это важная группа веществ, в составе которых присутствует водород. Среди представителей, имеющих промышленное значение, отметим метан, воду, сероводород, аммиак, а также галогеноводороды.
Часть летучих водородных соединений присутствует в почвенных водах, живых организмах, поэтому можно вести речь об их геохимической и биохимической роли.
Чтобы составлять бинарные соединения такого вида, на первое место ставят водород, имеющий валентность. В качестве второго элемента выступает неметалл, имеющий отрицательную степень окисления.
Для расстановки индексов в бинарном соединении между валентностями определяется наименьшее общее кратное. Количество атомов каждого элемента определяют путем деления его на валентности каждого элемента, входящего в состав соединения.
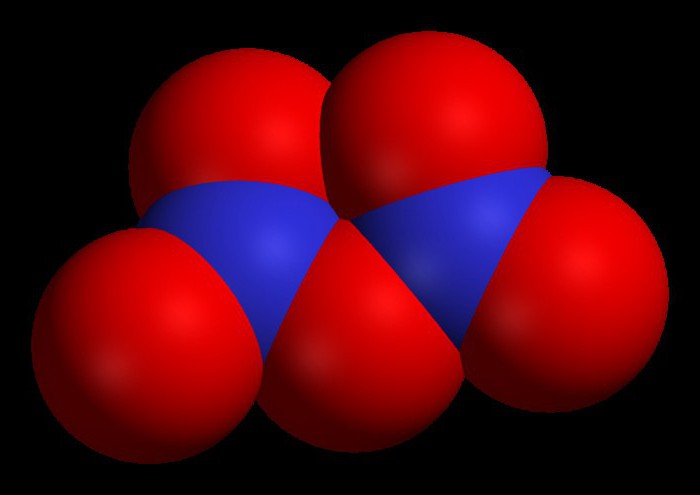
Хлороводород
Рассмотрим формулы бинарных соединений: хлороводорода и аммиака. Именно эти вещества имеют значение для современной химической промышленности. HCl при нормальных условиях является газообразным соединением, хорошо растворимым в воде. После растворения газообразного хлороводорода образуется соляная кислота, используемая во многих химических процессах и производственных цепочках.
Это бинарное соединение содержится в желудочном соке человека и животных, является барьером для болезнетворных микробов, проникающих с пищей в желудок.
Среди основных областей применения соляной кислоты выделим получение хлоридов, синтез хлорсодержащих продуктов, травление металлов, очистку труб от оксидов и карбонатов, кожевенное производство.
Аммиак, имеющий формулу NH3, является бесцветным газом, обладающим специфическим резким запахом. Его неограниченная растворимость в воде позволяет получать нашатырный спирт, востребованный в медицине. В природе данное бинарное соединение образуется в процессе гниения органических продуктов, в составе которых присутствует азот.

Классификация оксидов
Кислородсодержащее бинарное соединение металла, имеющего валентность 1 или 2, является основным оксидом. Например, к этой группе относят оксиды щелочных и щелочноземельных металлов.
Оксиды неметаллов, а также металлов с валентностью больше 4, являются кислотными соединениями.
В зависимости от химических свойств представителей данного класса делят на солеобразующие и несолеобразующие группы.
Среди типичных представителей второй группы отметим угарный газ (CO), оксид азота 1 (NO).
Формирование систематических названий соединений
Среди заданий, предлагаемых выпускникам, сдающим государственный экзамен по химии, есть и такое: «Составьте молекулярные формулы возможных бинарных кислородных соединений серы (азота, фосфора)». Для того чтобы справиться с поставленной задачей, необходимо иметь представление не только об алгоритме, но и об особенностях номенклатуры данного класса неорганических веществ.
При формировании наименования бинарного соединения, первоначально указывают тот элемент, который в формуле располагается справа, добавляя суффикс «ид». Далее указывают название первого элемента. Для ковалентных соединений добавляют приставки, по которым можно установить количественное соотношение между составными частями бинарного соединения.
Например, SO3 – триоксид серы, N2O4 – тетроксид диазота, I2CL6 – гексахлорид диода.
Если в бинарном соединении присутствует химический элемент, способный проявлять разные степени окисления, после названия соединения в круглых скобках указывают состояние окисления.
К примеру, два соединения железа отличаются по названию: FeCL3 – оксид железа (3), FeCL2 – оксид железа (2).
Для гидридов, в частности неметаллических элементов, пользуются тривиальными названиями. Так, H2O – вода, HCL – хлороводород, HI – йодоводород, HF – плавиковая кислота.
Катионы
Положительным ионам тех элементов, которые способны образовывать только один устойчивый ион, дают такие же названия, как и у самих символов. К ним относятся все представители первой и второй групп периодической системы Менделеева.
Например, катионы натрия и магния имеют вид: Na+, Mg2+. Переходные элементы способны образовывать несколько видов катионов, поэтому в названии необходимо указывать валентность, проявляемую в каждом отдельном случае.
Анионы
У простых (одноатомных) и комплексных (многоатомных) анионов применяется суффикс –ид.
Распространенным оксоанионом определенного элемента является суффикс –ам. Для оксоаниона элемента, находящегося в формуле с меньшей степенью окисления, применяется суффикс –ит. Для минимального состояния окисления используется приставка гипо-, а для максимального значения – пер-. Например, ион О2- является оксид-ионом, а О- – пероксидом.
Существуют и разнообразные тривиальные названия гидридов. Например, N2H4 именуют гидразином, а PH3 называют фосфином.
Серосодержащие оксоанионы имеют следующие названия:
- SO42- – сульфат;
- S2O32- – тиосульфат;
- NCS- – тиоцианат.
Соли
Во многих итоговых тестах по химии предлагается следующее задание: «Составьте формулы бинарных соединений металлов». Если в составе таких соединений есть анионы хлора, брома, йода, такие соединения называют галогенидами, относят к классу солей. При составлении формул этих бинарных соединений на первое место ставится металл, затем соответствующий галогенид-ион.
Для определения количества атомов каждого элемента находят наименьшее кратное между валентностями, при делении получают индексы.
У таких соединений высокая температура плавления и кипения, хорошая растворимость в воде, при нормальных условиях они являются твердыми веществами. Например, хлориды натрия и калия входят в состав морской воды.
Поваренную соль люди применяют с древних времен. В настоящее время использование этого бинарного соединения не ограничивается употреблением в пищу. При электролизе водного раствора хлорида натрия получают металлический натрий и газообразный хлор. Эти продукты используются в различных производственных процессах, например для получения гидроксида натрия, хлороводорода.
Значение бинарных соединений
К данной группе относится огромное количество веществ, поэтому можно с уверенностью говорить о масштабности их использования в разных сферах человеческой деятельности. Аммиак в химической промышленности применяют в качестве прекурсора при изготовлении азотной кислоты, производстве минеральных удобрений. Именно это бинарное соединение применяют в тонком органическом синтезе, долгое время использовали в холодильных установках.
Благодаря уникальной твердости карбида вольфрама, это соединение нашло применение в изготовлении многообразного режущего инструмента. Химическая инертность этого бинарного соединения позволяет применять его в агрессивных средах: лабораторном оборудовании, печах.
«Веселящий газ» (оксид азота 1) в смеси с кислородом используется в медицине для общего наркоза.
Все бинарные соединения имеют ковалентный либо ионный характер химической связи, молекулярную, ионную или атомную кристаллическую решетку.
Заключение
При составлении формул бинарных соединений необходимо соблюдать определенный алгоритм действий. Сначала записывается элемент, который проявляет положительную степень окисления (имеет меньшее значение электрической отрицательности). При определении значения степени окисления у второго элемента из восьми вычитают номер группы, в котором он находится. Если полученные числа отличаются между собой, определяется наименьшее общее кратное, затем вычисляются индексы.
Помимо оксидов, к данным соединениям причисляют карбиды, силициды, пероксиды, гидриды. Карбиды алюминия и кальция используют для лабораторного получения метана и ацетилена, пероксиды используют в химической промышленности в качестве сильных окислителей.
Такой галогенид, как фтороводород (плавиковая кислота), используется в электротехнике при паянии. Среди самых важных бинарных соединений, без которых трудно представить себе существование живых организмов, лидирует вода. Особенности строения этого неорганического соединения подробно изучаются в школьном курсе химии. Именно на ее примере ребята получают представления о последовательности действий при составлении формул бинарных соединений.
В заключение отметим, что сложно найти такую сферу современной промышленности, область человеческой жизни, где бы ни применялись разнообразные бинарные соединения.
Источник
Бинарными соединениями называют соединения, образованные двумя элементами. Наиболее распространёнными и важными являются соединения различных элементов с кислородом (оксиды), элементами 7-й группы главной подгруппы, называемых общим термином галогены – фтором, хлором, бромом и иодом (галогениды) и серой (сульфиды).
Почти все элементы ПСЭМобразуют соединения с кислородом – большинство при непосредственном взаимодействии элементов. Название соединение элемента с кислородом образуют путем прибавления названия элемента в родительном падеже к слову оксид. Например, СаО – оксид кальция. Если элемент образует несколько оксидов, то после названия добавляют степень окисления элемента в круглых скобках, например, FeO – оксид железа (II), Fe2O3 – оксид железа (III). Приведем несколько примеров реакций образования оксидов:
2Ca + O2 =2CaO оксид кальция;
2Mg + O2 =2MgO оксид магния;
4Al + 3O2 = 2Al2O3 оксид алюминия;
Si + O2 = SiO2 оксид кремния;
S + O2 = SO2 оксид серы (IV).
Реакции элементов с галогенами сопровождаются образованием галогенидов:
H2 + Cl2 = 2HCl хлорид водорода (хлористый водород);
2Na + Cl2 = 2NaCl хлорид натрия (поваренная соль);
Сa + F2 = CaF2 фторид кальция;
2Al + 3I2 = 2AlI3 иодид алюминия.
Водные растворы соединений галогенов с водородом являются кислотами, например HF – плавиковая кислота, HCl – соляная или хлористоводородная кислота.
Многие элементы могут вступать в реакции с серой, образуя сульфиды:
2Na + S = Na2S сульфид натрия;
Mg + S =MgS сульфид магния.
Водный раствор соединения серы с водородом (H2S) проявляет кислотные свойства и носит название сероводородной кислоты.
Химические свойства оксидов.Оксиды металлов 1-й и 2-й групп главных подгрупп ПСЭМ могут взаимодействовать с водой, образуя гидроксидыили основания:
Na2O + H2 O = 2NaOH гидроксид натрия (едкий натр);
СаO + H2 O = Ca(OH)2гидроксид кальция (гашёная известь).
Оксиды, способные образовывать прямо или косвенно основания, называют основными оксидами.
Оксиды многих неметаллов при взаимодействии с водой образуют кислоты:
СO2 + H2 O = H2СO3 угольная кислота;
SO3 + H2 O = H2SO4 серная кислота.
Оксиды, способные образовывать прямо или косвенно кислоты, называют кислотными оксидами.
Основные оксиды способны взаимодействовать с кислотными оксидами с образованием солей:
СаO + СO2 = СаСO3, карбонат кальция, соль угольной кислоты;
MgO + SO3 = MgSO4, сульфат магния, соль серной кислоты.
Ряд оксидов, называемых амфотерными,способен реагировать и с кислотными и основными оксидами. К ним относятся, например, оксиды бериллия, алюминия, цинка.
ZnO + СаO = СaZnO2, цинкат кальция;
ZnO + SO3 = ZnSO4 , сульфат цинка.
Многие оксиды непосредственно с водой не взаимодействуют, например, SiO2, MgO и др. Тем не менее, косвенными реакциями могут быть получены соответствующие основания (например, Mg(OH)2 – гидроксид магния) или кислоты (H2SiO3 – кремневая кислота). По этой причине оксид магния относят к основным оксидам, а оксид кремния – к кислотным.
Гидроксиды (кислоты, основания,
Амфотерные гидроксиды)
Основания и содержащие кислород кислоты имеют в своём составе гидроксидную группу (ОН), и называются гидроксидами. Например:
Различия в химических свойствах гидроксидов определяются различиями свойств атомов, с которыми связаны гидроксидные группировки ОН. Гидроксиды, образованные атомами с валентностью, равной 1,почти всегда являются основаниями. Большинство гидроксидов, образованных двухвалентными атомами, также относятся к основаниям. Гидроксиды, образованные атомами с валентностью от 4 до 8, относятся к кислотам. Если же валентность атомов равна 3, то их гидроксиды обычно являются амфотерными. Амфотерными являются также некоторые из гидроксидов двухвалентных и четырехвалентных атомов.
Для кислот характерны следующие основные химические свойства:
1) взаимодействие с активными металлами с образованием солей и выделением водорода:
H2SO4 + Mg = MgSO4 + H2;
2) взаимодействие с основаниями и амфотерными гидроксидами (реакция нейтрализации), в результате чего образуются соли и вода:
HNO3 + NaOH = NaNO3 + H2O;
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O;
3) взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HCl + MgO = MgCl2 + H2O;
2HCl + ZnO = ZnCl2 + H2O.
Наиболее типичными реакциями оснований являются:
1) взаимодействие с кислотами и амфотерными гидроксидами с образованием солей и воды (реакция нейтрализации):
Са(OH)2 + H2SO4 = СаSO4 + H2O;
Са(OH)2 + Zn(OH)2 = СаZnO2 + 2H2O;
2) взаимодействие с кислотными и амфотерными оксидами с образованием солей и воды:
2KOH + CO2 = K2CO3 + H2O;
2NaOH + Al2O3 = 2NaAlO2 + H2O.
Амфотерные гидроксиды ведут себя в реакциях с кислотами как основания, а в реакциях с основаниями как кислоты.
В таблице 3.1. приведены формулы и названия важнейших кислот и их солей и ряда оснований.
Соли
Соединения, содержащие в своём составе атомы металлов и кислотные остатки, называются солями.
Соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металла. При полном замещении всех атомов водорода в молекуле кислоты образуются средние соли, например Na2SO4 – сульфат натрия. При частичном замещении атомов водорода образуются кислые соли, например NaHSO4 – гидросульфат натрия (устаревшее название – бисульфат натрия).
Соли можно также рассматривать как продукты замещения гидроксидных групп в молекуле основания на кислотные остатки. При полном замещении всех гидроксидных групп образуются средние соли, например СаCl2. При частичном замещении образуются основные соли, например Ca(OH)Cl – гидроксохлорид кальция. Очевидно, что
Таблица 3.1. Формулы и названия некоторых оснований, кислот и их солей.
| Формула | Химическое название | Синоним (тривиальное название) | Химическое название солей |
| H2SO4 | Серная кислота | Сульфаты | |
| HNO3 | Азотная кислота | Нитраты | |
| HCl | Хлористоводородная кислота | Соляная кислота | Хлориды |
| H2CO3 | Угольная кислота | Карбонаты | |
| NaOH | Гидроксид натрия | Едкий натр, каустическая сода | |
| KOH | Гидроксид калия | Едкое кали | |
| Ca(OH)2 | Гидроксид кальция | Гашеная известь | |
| NH4OH | Гидроксид аммония | Водный ам-миак, наша-тырный спирт |
основные соли не могут быть образованы гидроксидами одновалентных металлов.
Приведем некоторые химические свойства солей:
1) взаимодействие с растворимыми в воде основаниями (NaOH, КOH, Са(OH)2); реакции протекают в том случае, если образующийся гидроксид плохо растворим в воде.:
Zn(NO3)2 + 2NaOH =2 NaNO3 + Zn(OH)2 ↓.
Стрелка означает, что гидроксид цинка выпадает в осадок.
2) взаимодействие с кислотами; реакция протекает, если продукт реакции является летучим:
Na2CO3 + H2SO4 = Na2SO4 + H2CO3;
Угольная кислота неустойчива, легко разлагается на воду и летучий углекислый газ. Иначе реакция может быть записана так:
Na2CO3 + H2SO4 = Na2SO4 + H2О + CO2↑.
Стрелка означает, что углекислый газ улетучивается.
3) Соли взаимодействуют друг с другом, если один из продуктов реакции плохо растворим в воде:
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Источник
Элементы главных и побочных подгрупп
Свойства элементов главной и побочной подгрупп существенно различаются. В то же время благодаря периодической системе мы находим много общего в свойствах всех элементов, образующих данную группу.
Так, в VII группе имеются два элемента — хлор (VIIA группа) и марганец (VIIB группа). Хлор образует простое вещество — неметалл, газообразный при обычных условиях, очень ядовитый. Марганец — типичный металл со всеми свойствами металлов (твердый, пластичный, электропроводный). Что же объединяет эти несхожие элементы? Почему они находятся в одной группе периодической системы? Все дело в том, что и атомы хлора, и атомы марганца содержат по 7 валентных электронов:
Cl $1s^22s^22p^6 underline{3s^23p^5}$;
Mn 1s$^2$2s$^2$2p$^6$3s$^2$3p$^6$ $underline{3d^5 4s^2}$.
Поэтому высшая степень окисления для этих элементов одна и та же, а именно +7.
Хлор и марганец образуют высшие оксиды одного состава: $Cl_2O_7$ и $Mn_2O_7$. Оба эти оксида кислотные, энергично взаимодействуют с водой с образованием кислот одного и того же состава:
Cl$_2$O$_7$ + Н$_2$О → 2HClO$_4$ хлорная кислота,
Mn$_2$O$_7$ + Н$_2$О → 2HMnO$_4$ марганцевая кислота.
Оба оксида (и отвечающие им кислоты) очень неустойчивы и являются сильнейшими окислителями.
И хлорная, и марганцевая кислота относятся к наиболее сильным кислотам. При нейтрализации кислот получаются однотипные соли — перхлораты и перманганаты, например KClO$_4$ и KMnO$_4$. При небольшом нагревании обе соли легко разлагаются с выделением кислорода. Все это и позволяет рассматривать элементы хлор и марганец в одной группе периодической системы элементов Д. И. Менделеева.
Следует подчеркнуть, что закономерности изменения свойств по группам, описанные ниже, относятся только к элементам главных подгрупп.
Атомный радиус
Атомный радиус увеличивается с увеличением количества энергетических уровней, то есть сверху вниз по группе. У элементов, стоящих в одном периоде и обладающих равным количеством энергетических уровней, атомный радиус, на первый взгляд, меняться не должен. Однако вследствие взаимодействие ядра и электронов усиливается при движении по периоду слева направо, что приводит к незначительному сжатию атома — уменьшению его радиуса.

Электроотрицательность
Определение
Способность атома элемента притягивать к себе электроны химической связи называют электроотрицательностью (ЭО).
Элементы-металлы легче отдают электроны, чем притягивают их, иными словами, они имеют низкую электроотрицательность — меньше 1,8. Элементы-неметаллы, наоборот, легче притягивают электроны и имеют высокие значения ЭО.

Окислительно-восстановительные свойства соединений элементов. Металличность и неметалличность
Слова «металл» и «неметалл» применимы не только к химическим элементам, но и к простым веществам. Например, говоря, что простое вещество является металлом, мы подразумеваем не только что оно состоит из атомов элемента-металла, но и определенную общность физических (металлический блеск, пластичность) и химических (восстановитель) свойств.
Напомним, что из известных на данный момент 116 химических элементов 98 являются металлами. Металлы расположены в главных подгруппах в левом нижем углу (относительно диагонали бор-астат) таблицы Менделеева и в побочных подгруппах.
Атомы металлов на внешнем уровне содержат не более четырех электронов, как правило, от одного до трех. Отдавая эти электроны, они приобретают устойчивую оболочку ближайшего инертного газа.

Таки образом, металлы в химических реакциях являются восстановителями — они легко отдают электроны и приобретают положительную степень окисления. В этом заключается их принципиальное отличие от элементов-неметаллов.
Поэтому очень часто говорят о металлических свойствах как синониме восстановительных свойств.
В наибольшей степени металлические свойства выражены у элементов главной подгруппы I группы периодической системы — щелочных металлов. Их атомы настолько легко отдают валентный электрон, что в природе эти элементы встречаются исключительно в виде соединений.
Поскольку сверху вниз возрастают атомные радиусы элементов, сила притяжения валентных электронов к ядру ослабевает и увеличивается легкость отдачи внешних электронов, то есть восстановительные (или металлические) свойства.
Металлические (восстановительные) свойства элементов при движении по периоду убывают слева направо; а по группе убывают снизу вверх.
Элементы-металлы образуют генетический ряд химических соединений, в которых проявляются их металлические химические свойства: металл — оксид металла ($Me_xO_y$) — гидроксид (основание $Me^{+n}(OH)_n$. В сложных веществах проявление металлических свойств характеризуется понятием основность, и говорят, что оксиды и гидроксиды проявляют основные свойства. Соответственно, основные свойства оксидов и гидроксидов металлов сверху вниз по подгруппе увеличиваются, а кислотные — уменьшаются.
Элементы-неметаллы имеют на внешнем энергетическом уровне от четырех до семи электронов, при этом элементы восьмой группы образуют семейство инертных газов. Такие элементы имеют восемь электронов на внешнем энергетическом уровне, то есть такой уровень является завершенным, а сами элементы не вступают в химические реакции с другими элементами, то есть являются химически инертными.
Неметаллы в химических реакциях являются окислителями — они легко присоединяют электроны, отнимая их от атомов других элементов, и приобретают отрицательный заряд.
Легче всего принимают электроны те элементы, у которых число электронов на внешнем уровне больше четырех — до завершения внешнего уровня им более энергетически выгодно принять несколько электронов, чем отдать свои. В наибольшей степени свойства неметаллов проявляют галогены — элементы главной подгруппы VII группы.
Проследим закономерность изменения окислительных свойств по периоду на примере элементов второго периода:
3Li − 4Be − 5B − 6C − 7N − 😯 − 9F − 10Ne.
Литий и бериллий (типичные металлы) — окислительными свойствами не обладают. Неметаллы бор и углерода — очень слабые окислители. Например, они реагируют с углеродом только в электрической печи, где температура превышает 1500$^o$С. С неметаллом азотом алюминий вступает в реакцию уже при 1000$^o$С, а с кислородом порошок алюминия реагирует при внесении в пламя горелки. Фтор окисляет порошкообразный алюминий уже при комнатной температуре. А вот завершающий второй период инертный газ неон вообще не вступает в химические реакции.
Таким образом, неметаллические (окислительные) свойства простых веществ при движении по периоду слева направо возрастают.
Элементы-неметаллы образуют генетический ряд химических соединений, в которых проявляются их неметаллические химические свойства: неметалл — оксид неметалла ($HMe_xO_y$) — гидроксид неметалла (кислородсодержащая кислота $H_n(HMeO)^{n-}$). В сложных веществах проявление неметаллических свойств характеризуется понятием кислотность, и говорят, что оксиды и гидроксиды проявляют кислотные свойства. Соответственно, кислотные свойства оксидов и гидроксидов неметаллов в высших степенях окисления сверху вниз по подгруппе уменьшаются, а основные — увеличиваются.
Кислотные свойства оксидов и гидроксидов по периоду слева направо также возрастают.
Но изменение окислительно-восстановительных свойств происходит постепенно. Так, металл бериллий, в отличие от типичного металла лития, взаимодействует не только с кислотами, но и со щелочами (что характерно для ряда неметаллов), а простое вещество графит, образованное элементом-неметаллом углеродом, подобно металлам, обладает металлическим блеском и проводит электрический ток.
Энергия ионизации
Определение
Энергия ионизации — это наименьшая энергия, которая должна быть затрачена на отрыв электрона от нейтрального атома.

Ионный радиус

Диагональная периодичность
В заключение укажем, что химические элементы, расположенные в диагональном направлении периодической системы, также иногда могут проявлять близость многих физических и химических свойств. Это явление носит название диагонального сходства. Так, химические свойства лития и его соединений иногда оказываются гораздо ближе к свойствам магния, чем к свойствам остальных щелочных металлов. Аналогично свойства бериллия гораздо ближе к свойствам алюминия, чем к свойствам щелочноземельных металлов, а свойства бора ближе к свойствам кремния.

Диагональное сходство можно объяснить, если принять во внимание характер изменения атомных радиусов по группам и периодам: уменьшение радиусов в периодах (слева направо) приблизительно компенсируется увеличением радиусов в группах (сверху вниз). Тем самым оказываются весьма близки атомные радиусы лития и магния, бериллия и алюминия и др.
Все вышеупомянутые закономерности изменения свойств условно отражены в схеме ниже:


Сравнение строения и свойств элементов VIIА и VIIB групп
Чтобы увидеть, как изменяются свойства элементов по периоду рассмотрим строение и свойства типичных металлов и неметаллов – представителей IA и VIIA -группы. Кроме того, рассмотрим также свойства элементов побочных IB и VIIB -групп и сравним их между собой.

К седьмой группе главной подгруппы Периодической системы относятся элементы семейства галогенов. В длиннопериодном варианте ПС эта группа 17. Элементы этой группы обладают строением и свойствами типичных неметаллов, то есть имеют небольшой радиус и 7 электронов на внешнем уровне, поэтому относятся к p-элементам.
Типичным представителем галогенов является хлор. Электронная конфигурация этого элемента отвечает электронной формуле $1s^22s^22p^63s^23p^5$ или $[Ne]3s^23p^5$. Это означает, что валентными являются 7 внешних электронов – 2 s-электрона и 5р-электронов, которые образуют 3 пары и имеют один неспаренный электрон. Поэтому, образуя связь с менее электроотрицательными элементами (водородом или металлами), хлор отнимает у них 1 электрон и достраивает тем самым свой незавершенный уровень. При этом хлор проявляет свойства окислителя и имеет в соединениях степень окисление -1.
Нужно помнить, что хлор расположен в третьем периоде, поэтому имеет три энергетических уровня, а, значит на третьем, внешнем уровне у него имеются вакантные (незанятые) d-орбитали. При переходе в возбужденное состояние электроны с s- и р-подуровней могут перескакивать на более высокий d-энергетический подуровень:
В этом случае “распаренными” получаются 3, 5 или 7 электронов. Поэтому в соединениях с более электроотрицательными элементами, а именно с кислородом, хлор может проявлять степени окисления +1; +3; +5 или +7. В этих степенях окисления он образует оксиды и соответствующие им кислородсодержащие кислоты:
HCL- хлороводородная, соли – хлориды
HClO – хлорноватистая (кислотный оксид $Cl_2O$, соли — гипохлориты), очень слабая кислота, неустойчивая, окислитель:
$2HClO + H_2S longrightarrow S + Cl_2 + 2H_2O$
$HClO_2$ – хлористая (кислотный оксид $Cl_2O_3$, соли — хлориты), неустойчивая;
$HClO_3$ – хлорноватая (кислотный оксид — $Cl_2O_5$, соли – хлораты, $KClO_3$ – бертоллетова соль), в свободном виде не получена, «живет» только в растворах, сильный окислитель:
$HClO_3 + S + H_2O longrightarrow H_2SO_4 + HCl$
$HClO_4$– хлорная (кислотный оксид — $Cl_2O_7$, соли – перхлораты)
Все кислородсодержащие кислоты хлора являются сильными окислителями. Их свойства изменяются следующим образом:
с увеличением степени окисления хлора увеличивается сила кислородсодержащих кислот и их окислительные свойства.
В то же время, в минимальной степени окисления (-1) хлор образует сильную кислоту HCl, но не является в ней окислителем.
Рассмотрим теперь особенности строения и свойств элементов IA группы (в длиннопериодном варианте ПС это тоже группа I) на примере натрия. Элементы этой группы являются типичными металлами, то есть обладают большим радиусом, имеют всего 1 валентный электрон, то есть относятся к s-элементам, и в химических реакциях являются типичными восстановителями. Элементы этой группы называются щелочными металлами.

Натрий находится с хлором в одном периоде, имеет электронную конфигурацию $1s^22s^22p^63s^1$ или $[Ne]3s^1$. то есть различия с атомом натрия заключается только в числе внешних валентных электронов. Имея один неспаренный электрон на внешнем уровне, натрий обладает свойствами восстановителя, то есть легко отдает валентный электрон на образование связи, а хлор, обладая свойствами окислителя, легко присоединяет этот электрон. Поэтому при образовании молекулы хлорида натрия валентный электрон натрия полностью переходит к хлору и образуется соединение с ионным типом связи:

Теперь рассмотрим и сравним свойства элементов побочных подгрупп IB и VIIB -групп. К IB-группе, или в длиннопериодном варианте XI группы, относятся металлы подгруппы меди: Cu, Ag, Au. Особенностью строения этих элементов является наличие заполненного предвнешнего (n-1)d-подуровня, которое происходит за счёт перескока электрона с ns-подуровня. Причина возможности такого “перескока” электрона объясняется высокой энергетической устойчивостью полностью заполненного d-подуровня и более высокой, по сравнению с 4s, энергией 3d-подуровня (вспомните порядок заполнения подуровней).

Строением энергетических уровней объясняется химическая инертность простых веществ, образованных этими элементами, которые называют “благородными металлами”. Если медь и серебро при обычных условиях медленно окисляются на воздухе, а также могут вступать во взаимодействие с соединениями серы, например сероводородом, то золото при нормальных условиях не реагирует с химическими веществами. Исключение составляет “царская водка” – смесь концентрированной соляной и азотной кислот.
Для сравнения осталось рассмотреть строение и свойства элементов VIIB-подгруппы, или VII группы в длиннопериодном варианте ПС. Эта подгруппа называется подгруппой марганца и включает три элемента: Mn-магранец, Tc – технеций, Re – рений Рассмотри особенности строения этих элементов на примере марганца. Электронная конфигурация марганца отображается электронной формулой $1s^22s^22p^63s^23p^63d^54s^2$ или $[Ar]3d^54s^2$. Как видно из формулы, у марганца не заполнен предвнешний уровень, на котором находится 5 электронов из 10-ти возможных. Для марганца характерны степени окисления +2, +4 и +7, что связано с более устойчивой конфигурацией $d^5$ и $d^3$.
Простое вещество- марганец, металл серебристо-белого цвета, широко использующийся в металлургии. Марганец образует следующие оксиды: MnO, $Mn_2O_3$, $MnO_2$, $MnO_3$ (не выделен в свободном состоянии) и марганцевый ангидрид $Mn_2O_7$. Оксиды низших валентностей (II, III) носят основной характер, высших – кислотный. Кислотным оксидам соответствуют кислоты и образованные ими соли:
Манганаты — соли нестойких, несуществующих в свободном состоянии кислородных кислот марганца в степенях окисления V, VI и VII:
$MnO_4^{3−}$ – гипоманганаты,
$MnO_4^{2−}$ – манганаты,
$MnO_4^−$ – перманганаты
Все соли марганца, особенно перманганаты, являются сильными окислителями. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. Необходимо запомнить:
Степени окисления марганца:
В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
Источник
