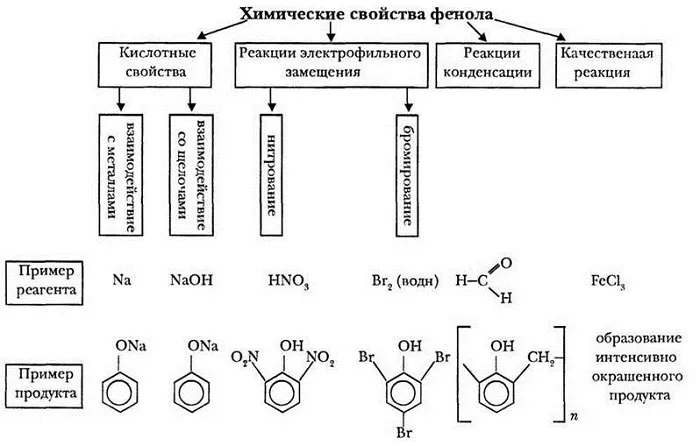
Какие свойства проявляют фенолы

Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: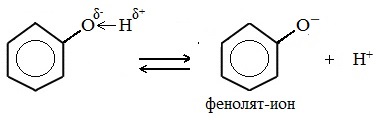
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: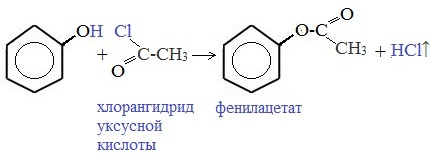
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
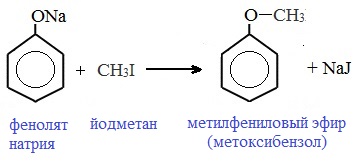
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
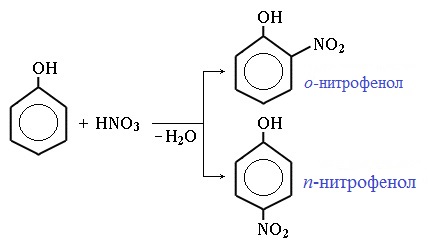
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):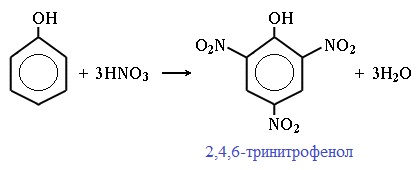
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):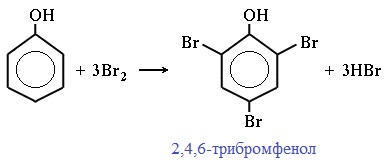
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: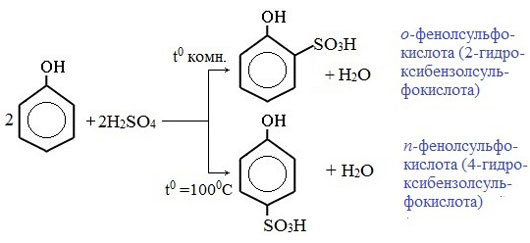 Реакции присоединения
Реакции присоединения
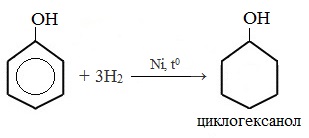
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
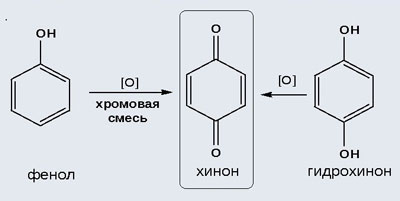
IV. Качественная реакция! – обнаружение фенола
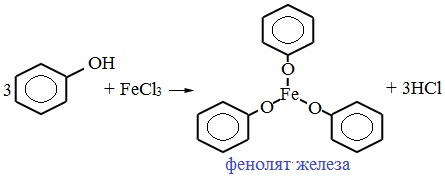
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Источник
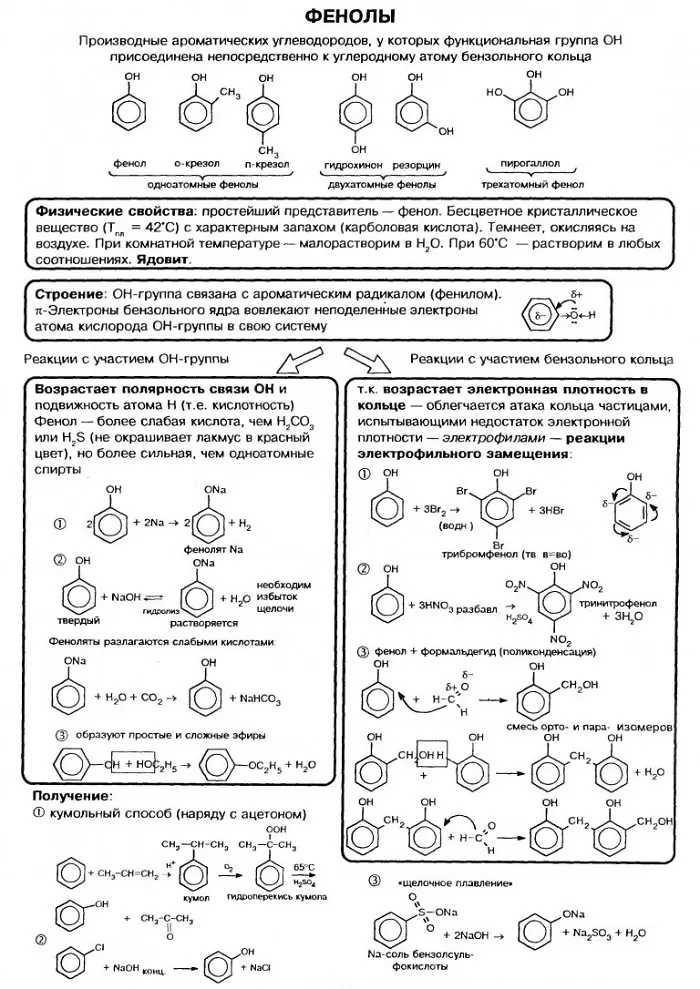
Ôåíîëû – ïðîèçâîäíûå àðîìàòè÷åñêèõ óãëåâîäîðîäîâ, â ñîñòàâ êîòîðûõ ìîãóò âõîäèòü îäíà èëè íåñêîëüêî ãèäðîêñèëüíûõ ãðóïï, ñîåäèíåííûõ ñ áåíçîëüíûì êîëüöîì.
Êàê íàçûâàòü ôåíîëû?
Ïî ïðàâèëàì ÈÞÏÀÊ ñîõðàíÿåòñÿ íàçâàíèå «ôåíîë». Íóìåðàöèÿ àòîìîâ èäåò îò àòîìà, êîòîðûé íåïîñðåäñòâåííî ñâÿçàí ñ ãèäðîêñè-ãðóïïîé (åñëè îíà – ñòàðøàÿ) è íóìåðóþò òàê, ÷òîáû çàìåñòèòåëè ïîëó÷èëè íàèìåíüøèé íîìåð.
Ïðåäñòàâèòåëü – ôåíîë – Ñ6Í5ÎÍ:
Ñòðîåíèå ôåíîëà.
Ó àòîìà êèñëîðîäà íà âíåøíåì óðîâíå íàõîäèòñÿ íåïîäåëåííàÿ ýëåêòðîííàÿ ïàðà, êîòîðàÿ «âòÿãèâàåòñÿ» â ñèñòåìó êîëüöà (+Ì-ýôôåêò ÎÍ-ãðóïïû). Â ðåçóëüòàòå ìîãóò âîçíèêíóòü 2 ýôôåêòà:
1) ïîâûøåíèå ýëåêòðîííîé ïëîòíîñòè áåíçîëüíîãî êîëüöà â ïîëîæåíèÿ îðòî- è ïàðà-. Â îñíîâíîì, òàêîé ýôôåêò ïðîÿâëÿåòñÿ â ðåàêöèÿõ ýëåêòðîôèëüíîãî çàìåùåíèÿ.
2) óìåíüøàåòñÿ ïëîòíîñòü íà àòîìå êèñëîðîäà, âñëåäñòâèå ÷åãî ñâÿçü Î-Í îñëàáëÿåòñÿ è ìîæåò ðâàòüñÿ. Ýôôåêò ñâÿçàí ñ ïîâûøåííîé êèñëîòíîñòè ôåíîëà ïî ñðàâíåíèþ ñ ïðåäåëüíûìè ñïèðòàìè.
Ìîíîçàìåùåííûå ïðîèçâîäíûå ôåíîëà (êðåçîë) ìîãóò áûòü â 3õ ñòðóêòóðíûõ èçîìåðàõ:

Ôèçè÷åñêèå ñâîéñòâà ôåíîëîâ.
Ôåíîëû – êðèñòàëëè÷åñêèå âåùåñòâà ïðè êîìíàòîé òåìïåðàòóðå. Ïëîõî ðàñòâîðèìû â õîëîäíîé âîäå, íî õîðîøî – â ãîðÿ÷åé è â âîäíûõ ðàñòâîðàõ ùåëî÷åé. Îáëàäàþò õàðàêòåðíûì çàïàõîì. Âñëåäñòâèå îáðàçîâàíèÿ âîäîðîäíûõ ñâÿçåé, îáëàäàþò âûñîêîé òåìïåðàòóðîé êèïåíèÿ è ïëàâëåíèÿ.
Ïîëó÷åíèå ôåíîëîâ.
1. Èç ãàëîãåíáåíçîëîâ. Ïðè íàãðåâàíèè õëîðáåíçîëà è ãèäðîêñèäà íàòðèÿ ïîä äàâëåíèåì ïîëó÷àþò ôåíîëÿò íàòðèÿ, êîòîðûé ïîñëå âçàèìîäåéñòâèÿ ñ êèñëîòîé, ïðåâðàùàåòñÿ â ôåíîë:
2. Ïðîìûøëåííûé ñïîñîá: ïðè êàòàëèòè÷åñêîì îêèñëåíèè êóìîëà íà âîçäóõå ïîëó÷àåòñÿ ôåíîë è àöåòîí:

3. Èç àðîìàòè÷åñêèõ ñóëüôîêèñëîò ñ ïîìîùüþ ñïëàâëåíèÿ ñ ùåëî÷àìè. ×àùå ïðîâîäÿò ðåàêöèþ äëÿ ïîëó÷åíèÿ ìíîãîàòîìíûõ ôåíîëîâ:

Õèìè÷åñêèå ñâîéñòâà ôåíîëîâ.
ð-îðáèòàëü àòîìà êèñëîðîäà îáðàçóåò ñ àðîìàòè÷åñêèì êîëüöîì åäèíóþ ñèñòåìó. Ïîýòîìó ýëåêòðîííàÿ ïëîòíîñòü íà àòîìå êèñëîðîäå óìåíüøàåòñÿ, â áåíçîëüíîì êîëüöå – óâåëè÷èâàåòñÿ. Ïîëÿðíîñòü ñâÿçè Î-Í ïîâûøàåòñÿ, è âîäîðîä ãèäðîêñèëüíîé ãðóïïû ñòàíîâèòñÿ áîëåå ðåàêöèîíîñïîñîáíûì è ëåãêî ìîæåò áûòü çàìåùåí àòîìîì ìåòàëëà äàæå ïðè äåéñòâèè ùåëî÷åé.
Êèñëîòíîñòü ôåíîëîâ âûøå, ÷åì ó ñïèðòîâ, ïîýòîìó ìîæíî ïðîâîäèòü ðåàêöèè:
Íî ôåíîë – ñëàáàÿ êèñëîòà. Åñëè ÷åðåç åãî ñîëè ïðîïóñêàòü óãëåêèñëûé èëè ñåðíèñòûé ãàç, òî âûäåëÿåòñÿ ôåíîë, ÷òî äîêàçûâàåò, ÷òî óãîëüíàÿ è ñåðíèñòàÿ êèñëîòà ÿâëÿþòñÿ áîëåå ñèëüíûìè êèñëîòàìè:
Êèñëîòíûå ñâîéñòâà ôåíîëîâ îñëàáëÿþòñÿ ïðè ââåäåíèè â êîëüöî çàìåñòèòåëåé I ðîäà è óñèëèâàþòñÿ – ïðè ââåäåíèè II.
2) Îáðàçîâàíèå ñëîæíûõ ýôèðîâ. Ïðîöåññ ïðîòåêàåò ïðè âîçäåéñòâèå õëîðàíãèäðèäîâ:
3) Ðåàêöèÿ ýëåêòðîôèëüíîãî çàìåùåíèÿ. Ò.ê. ÎÍ-ãðóïïà ÿâëÿåòñÿ çàìåñòèòåëåì ïåðâîãî ðîäà, òî ðåàêöèîííàÿ ñïîñîáíîñòü áåíçîëüíîãî êîëüöà â îðòî- è ïàðà- ïîëîæåíèÿõ ïîâûøàåòñÿ. Ïðè äåéñòâèè íà ôåíîë áðîìíîé âîäû íàáëþäàåòñÿ âûäåëåíèå îñàäêà – ýòî êà÷åñòâåííàÿ ðåàêöèÿ íà ôåíîë:

4) Íèòðîâàíèå ôåíîëîâ. Ðåàêöèþ ïðîâîäÿò íèòðèðóþùåé ñìåñüþ, â ðåçóëüòàòå ÷åãî îáðàçóåòñÿ ïèêðèíîâàÿ êèñëîòà:

5) Ïîëèêîíäåíñàöèÿ ôåíîëîâ. Ðåàêöèÿ ïðîòåêàåò ïîä âîçäåéñòâèè êàòàëèçàòîðîâ:

6) Îêèñëåíèå ôåíîëîâ. Ôåíîëû ëåãêî îêèñëÿþòñÿ êèñëîðîäîì âîçäóõà:

7) Êà÷åñòâåííîé ðåàêöèåé íà ôåíîë ÿâëÿåòñÿ âîçäåéñòâèå ðàñòâîðà õëîðèäà æåëåçà è îáðàçîâàíèå êîìïëåêñà ôèîëåòîâîãî öâåòà.
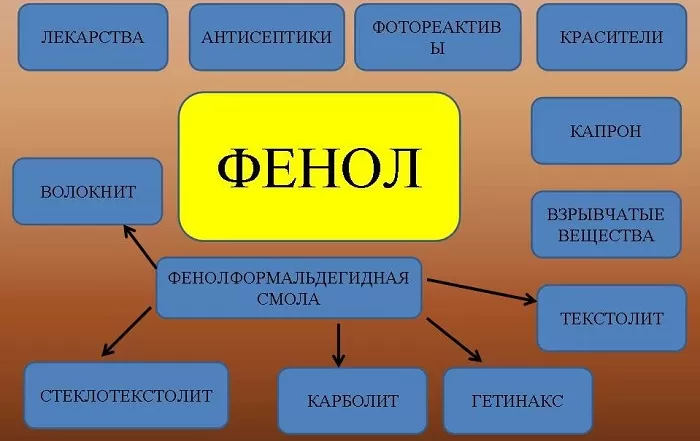
Ïðèìåíåíèå ôåíîëîâ.
Ôåíîëû èñïîëüçóþò ïðè ïîëó÷åíèè ôåíîëôîðìàëüäåãèäíûõ ñìîë, ñèíòåòè÷åñêèõ âîëîêîí, êðàñèòåëåé è ëåêàðñòâåííûõ ñðåäñòâ, äåçèíôèöèðóþùèõ âåùåñòâ. Ïèêðèíîâàÿ êèñëîòà èñïîëüçóåòñÿ â êà÷åñòâå âçðûâ÷àòûõ âåùåñòâ.
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
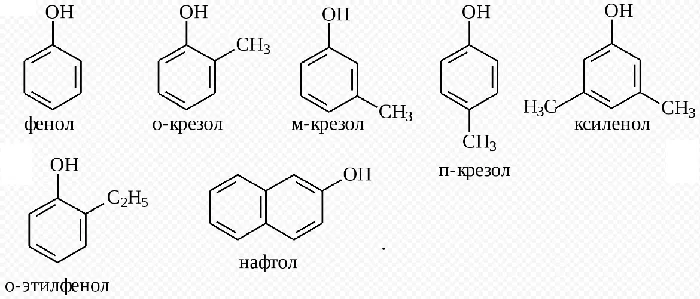
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Состав веществ можно выразить общей формулой С6Н6-n(ОН)n.
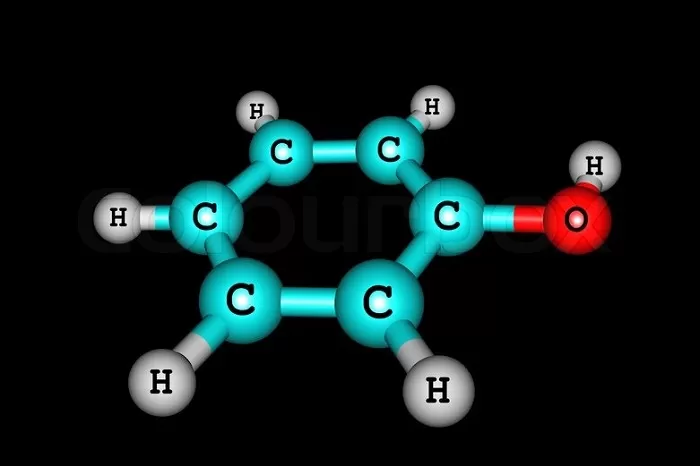
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
галогенирование;
нитрование;
гидрирование;
реакция поликонденсации.
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
диссоциация;
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,90С. Молярная масса 94 г/моль.

В холодной воде фенол является малорастворимым веществом. При температуре выше +700С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
2 С6Н5ОН + 2Na = 2С6Н5ОNa + H2
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
С6Н5ОН + KOН = С6Н5ОK +H2O
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
С6Н5
ОН + НО–С4Н9 = С6Н5–О–С4Н9
+Н2О
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3
даёт 2,4,6 тринитрофенол (пикриновую кислоту):
С6Н5ОН + 3HNO3
= C6H2(NO2)3OH +3H2O
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
С6Н5ОН + 3Br2
= C6H2Br3ОН + 3HBr
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
2С6Н5ОН + 5Н2 = С6Н11ОН + С6Н10О
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
С6Н5ОН + Н2О2 = С6Н4(ОН)2
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
По схеме С6Н6 —– С6Н5Cl —– С6Н5ОН. Минусом метода являются жёсткие условия замещения хлора на гидроксогруппу. Реакции приходится проводить при высокой температуре и давлении.
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
лекарственных препаратов;
взрывчатых веществ;
красителей;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.
Источник
