Какие свойства проявляют металлы окислителей или восстановителей

ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Общие химические свойства металлов представлены в таблице:

Видео “Самовоспламенение никеля на воздухе”
1). Металлы по – разному реагируют с водой:

Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
2). Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
Щелочные и щелочноземельные | Fe, Cr, Al | Металлы до водорода Сd-Pb | Металлы после водорода (при t) | Au, Pt | |
X | H2S↑ могут S↓ или SO2↑ | 1)пассивируются на холоде; 2) при нагревании → SO2↑ | S↓ могут H2S илиSO2 | SO2↑ | – |
H2SO4 (разб) + Zn = ZnSO4 + H2↑
H2SO4 (разб) + Cu ≠
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑
Внимание!
Pt, Au + H2SO4 (конц.) → реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Al, Fe, Cr + H2SO4 (конц.) t˚C→ SO2

4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
Внимание!
Pt, Au + HNO3 → реакции нет
Al, Fe, Cr + HNO3 (конц) холодная→ пассивация
Al, Fe, Cr + HNO3 (конц) t˚C→ NO2
Al, Fe, Cr + HNO3 (разб) → NO
3). С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Вытеснение металла из соли другим металлом
ВИДЕО-ОПЫТ
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым:
Вытеснение водорода металлами

от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Видео – Эксперимент «Взаимодействие хлорида олова (II) с цинком («Оловянный ежик»)»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
Li+ H2O =
Cu + H2O =
Al + H2O =
Ba + H2O =
Mg + H2O =
Ca + HCl=
Na + H2SO4(К)=
Al + H2S=
Ca + H3PO4=
HCl + Zn =
H2SO4 (к)+ Cu=
H2S + Mg =
HCl + Cu =
HNO3 (K)+ Сu =
H2S + Pt =
H3PO4 + Fe =
HNO3 (p)+ Na=
Fe + Pb(NO3)2 =
№2. Закончите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель):
Al + O2 =
Li + H2O =
Na + HNO3 (k) =
Mg + Pb(NO3)2 =
Ni + HCl =
Ag + H2SO4 (k) =
№3. Вставьте вместо точек пропущенные знаки (<, > или =)
заряд ядра | Li…Rb | Na…Al | Ca…K |
число энергетических уровней | Li…Rb | Na…Al | Ca…K |
число внешних электронов | Li…Rb | Na…Al | Ca…K |
радиус атома | Li…Rb | Na…Al | Ca…K |
восстановительные свойства | Li…Rb | Na…Al | Ca…K |
№4. Закончите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель):
K+ O2 =
Mg+ H2O =
Pb+ HNO3 (p) =
Fe+ CuCl2 =
Zn + H2SO4 (p) =
Zn + H2SO4 (k) =
№5. Решите тестовые задания
1.Выберите группу элементов, в которой находятся только металлы: А) Al, As, P; Б) Mg, Ca, Si; В) K, Ca, Pb 2. Выберите группу, в которой находятся только простые вещества – неметаллы: А) K2O, SO2, SiO2; Б) H2, Cl2, I2 ; В)Ca, Ba, HCl; 3. Укажите общее в строении атомов K и Li: А) 2 электрона на последнем электронном слое; Б) 1 электрон на последнем электронном слое; В) одинаковое число электронных слоев. 4. Металлический кальций проявляет свойства: А) окислителя; Б) восстановителя; В) окислителя или восстановителя в зависимости от условий. 5. Металлические свойства натрия слабее, чем у – А) магния; Б) калия; В) лития. 6. К неактивным металлам относятся: А) алюминий, медь, цинк; Б) ртуть, серебро, медь; В) кальций, бериллий, серебро. 7. Какое физическое свойство не является общими для всех металлов: А) электропроводность, Б) теплопроводность, В) твердое агрегатное состояние при нормальных условиях, Г) металлический блеск | ||
Часть В. Ответом к заданиям этой части является набор букв, которые следует записать Установите соответствие. С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
|
Источник
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.

Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
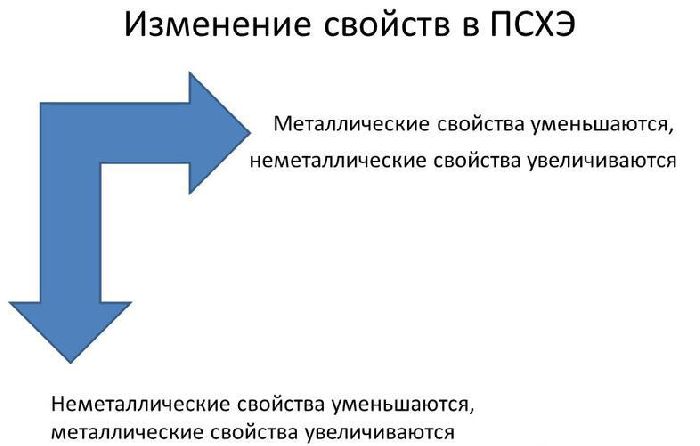
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция | Особенности | Уравнение |
С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина | – 4Li + O2 → 2Li2O; – 2Na + O2 → Na2O2; – K + O2 → KO2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление | – Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании | – 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
С углеродом | Литий и натрий, остальные – при нагревании | – 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
С серой | Не взаимодействуют золото и платина | – 2K + S → K2S; – Fe + S → FeS; – Zn + S → ZnS |
С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности | – 2Na + 2H2O → 2NaOH + H2↑; – Ca + 2H2O → Ca(OH)2 + H2; – Pb + H2O → PbO + H2↑ |
С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах | – Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
Отрасль | Производство | Металлы |
Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
Ювелирная промышленность | Украшения | Au, Pt, Ag |
Медицина | Протезы | Ti, Ni, Au |

Рис. 3. Висмут.
Что мы узнали?
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения. Металлы используются в медицине, промышленности, металлургии, электронике.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10

Лидия Маслова
10/10

Анна Богданова
10/10

Сергей Ефремов
7/10
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 402.
Источник
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня – особенный день. “И что же в нем такого необычного?” – спросите вы. Отвечаю. Я, наконец-то, добралась до моего самого любимого царства-королевства, до моих конфет и пирожных, малинок и клубничек! Окислительно-восстановительные реакции! Вы даже не представляете, насколько это интересно!
Мои ученики в процессе подготовки к экзамену по химии, проходят несколько стадий вызревания. Первое серьезное испытание на прочность – газы! Это из серии “гестапо отдыхает”. Решив огромное количество газовых задач, по сравнению с которыми 28-е задачи ЕГЭ – детский лепет, народ полностью структурирует свой мозг и настраивает мышление на профессиональное восприятие химии по-взрослому.
Вторая ступень химической зрелости и мудрости – окислительно-восстановительные реакции. Они приучают к усидчивости и внимательности. Набравшись опыта в написании ОВР, ребята начинают чувствовать себя ломоносовыми, клапейронами и менделеевыми в одном флаконе. За спиной вырастают крылья и… понеслось! Дальнейшее изучение химии проходит на едином дыхании, профессиональный рост – в геометрической прогрессии. На этой стадии мои ученики уже могут заткнуть за пояс каждого второго школьного преподавателя химии!
Понимая всю серьезность материала статьи, я отключила мобильную связь с внешним миром – с Карлсоном, Алисой (которая из страны Чудес), Сири, Фрекен Бок (тем более, что она работает химичкой в школе, где учится Малыш) и всеми остальными озорниками и хулиганами. Оставила только астральную связь для служебного пользования. Возможно, музы на чаек залетят или еще кто-нибудь забредет. А мы с вами займемся самым интересным делом – будем раскладывать по полочкам все накопленные мною знания по теории и практике окислительно-восстановительных реакций. Долго будем этим заниматься. Пока не надоест. Итак, поехали!
Окислительно-восстановительные реакции (ОВР) – химические реакции, в результате которых происходит изменение степеней окисления элементов.
ОВР протекают с участием двух участников – окислителя и восстановителя, и состоят из двух противоположных процессов:
1) Окисление – процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется – окислитель восстанавливается).
2) Восстановление – процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается – восстановитель окисляется).
Кто же вы, господа окислители и восстановители? Как вас узнать среди огромного количества химических веществ? Сегодня разберем самые общие характеристики участников ОВР (окислителей и восстановителей) на отдельных примерах. После изучения технологии написания ОВР (в следующей статье), поработаем с целыми семействами окислителей и восстановителей, с неорганическими и органическими веществами, проводя реакции в разных средах. А пока – читаем внимательно!
Окислитель – атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
Окислительная активность – способность атома отбирать электроны у других атомов.
Окислительно-восстановительный потенциал (редокс-потенциал) – показатель окислительной активности, мера способности атомов химического элемента присоединять электроны (восстанавливаться). Стандартные потенциалы окислительно-восстановительных пар помещены в таблицу.
Чем выше стандартный потенциал окислительно-восстановительной пары, тем выше окислительная активность атомов элемента, тем он – более сильный окислитель
Окислительную активность определяют два фактора:
1) Электроотрицательность. Чем выше электроотрицательность химического элемента, тем выше окислительная активность простого вещества. В Периодической Системе Элементов электроотрицательность растет в сторону правого верхнего угла (слева направо и снизу вверх). Самый сильный окислитель – фтор, на втором месте – кислород.
2) Степень окисления. Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы). Почему? Да, потому что у такого атома на внешнем уровне вообще нет валентных электронов. Ни одного. Все валентные электроны он где-то потерял (отдал кому-то) и остался гол, как сокол (в чем мать родила). Больше отдавать нечего, поэтому можно только присоединять.
У вас часто возникает вопрос – почему при дефиците электронов формируется положительная степень окисления или положительный заряд иона (т.е. почему у окислителя валентные электроны в дефиците или отсутствуют, а его заряд +n)? Да, потому что электроны заряжены отрицательно, а протоны (в ядре) – положительно. В электронейтральном атоме протоны и электроны уравновешены (сколько протонов, столько электронов). Если электроны убрать, то проявятся положительные заряды протонов, которые никуда не деваются в химических реакциях (их можно сдвинуть с насиженного места только ядерными реакциями). Теперь понятно? Если все еще “ежик в тумане”, читайте эту и следующие статьи. Я буду рассматривать все тяжело понимаемые моменты с разных сторон. В конце концов, все станет на свои места и туман рассеется.
Давайте, придумаем образ окислителя. Кто вы, мистер-окислитель? Это – захватчик, завоеватель, грабитель, который скачет на коне и, угрожая, копьем и ружьем, отбирает электроны у восстановителей (часто, отбирает все, что есть). Окислитель не только безжалостный разбойник, но еще и жадина – очень проблематично вернуть назад электроны, которые забрал окислитель. Как только окислитель ограбит восстановителя (заберет у него электроны) он тут же падает вниз по градационной шкале степеней окисления (“падает в глазах окружающих”).
Пример сильного окислителя – перманганат-ион. Его часто используют в различных ОВР. Обратите внимание, в зависимости от среды реакции, перманганат-ион образует различные продукты.
Ребята, не слушайте училок-химичек, которые заставляют запоминать продукты ВСЕХ окислительно-восстановительных реакций. Если вы забыли образующиеся вещества и просите помочь, они орут, обзывая вас неучами и и бездельниками. При этом, сами срочно хватают спасательный учебник по химии и пафосно зачитывают вам и всему классу продукты конкретной реакции. Вы задайте этим глупым училкам вопрос – помнят ли они дни рождения всех своих родственников? Что касается меня, то после 16-ти часов работы (такое тоже бывает), я часто забываю номер своего телефона. Но… ЛЮБУЮ ОВР напишу за пару минут (как говорят, темной ночью под кроватью)! Потому, что знаю особые секреты окислительно-восстановительных реакций, которые, между прочим, собираюсь раскрыть моим ученикам и всем моим читателям.
Постепенно, статья за статьей, мы будем изучать технологию написания окислительно-восстановительных реакций, знакомиться с целыми семействами окислителей и восстановителей, их особенностями, характером поведения в разных средах, предполагаемыми продукты. Лукавить не буду, кое-что нам, все-таки, придется запомнить. Совсем немного. Чуть-чуть. Примерно 15 точек, включающих продукты ОВР и основные рекомендации. И вы напишите ЛЮБУЮ окислительно-восстановительную реакцию! В ЛЮБОЙ среде!
Первое задание: запомните три продукта восстановления перманганат-иона (выделено красным цветом) в зависимости от среды протекания окислительно-восстановительной реакции (кислая, нейтральная или щелочная).
Восстановитель – атом в составе молекулы или иона, который отдает электроны окислителю. Происходит процесс окисления восстановителя (его степень окисления повышается).
Восстановительная активность – способность атома отдавать электроны другим атомам.
Восстановительную активность определяют два фактора:
1) Радиус атома. Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления. Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность.
Только свойства восстановителя проявляют атомы с минимально возможной степенью окисления. Для неметаллов она равна “восемь минус номер группы”. Для металлов – ноль. Как только восстановитель отдаст электроны окислителю, он поднимется вверх по градационной шкале степеней окисления (“растет в глазах окружающих”).
Посмотрите, как ведет себя сера в роли восстановителя в разных веществах (с разными степенями окисления).
Настало время придумать образ восстановителя. Кто вы, мистер-восстановитель? У меня восстановитель ассоциируется с добрым дедушкой-альтруистом, который одаривает электронами каждого желающего окислителя.
Как же вас различить, господа окислители и восстановители в группе веществ, предложенных для реакций?!
Окислитель можно отыскать по высокой (иногда, максимально высокой) степени окисления, кроме того, мы изучим многие семейные портреты окислителей. Продукты окислителей мы ЗАПОМНИМ (их около 10, не более), кроме того, проведем анализ процесса восстановления окислителя по градационной шкале степеней окисления.
Восстановитель отыщем по низкой (иногда, максимально низкой) степени окисления. Продукт восстановителя будем устанавливать путем анализа с использованием градационных шкал степеней окисления. Хотя… сделаю вам подарок. Читайте мнемоническое стихотворение. Пригодится.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
Репетитор по химии и биологии кбн В.Богунова
Источник
