Какие три состояния вещества вам известны перечислите их свойства

Ответ или решение1
Первый вопрос:
Имеются три агрегатный состояния веществ: это твердое состояние, жидкое состояние и газообразное состояние.
Второй вопрос:
Свойства твердых веществ: имеют постоянный объем, не обладают текучестью, не сжимаются, способны сохранять свою форму, имеют строго определенную температуру плавления.
ВашУрокРекомендация
Знаешь ответ?
Как написать хороший ответ?Как написать хороший ответ?
Как добавить хороший ответ?
Что необходимо делать:
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Что делать не стоит:
- Списывать или копировать что-либо. Высоко ценятся ваши личные, уникальные ответы;
- Писать не по сути. «Я не знаю». «Думай сам». «Это же так просто» – подобные выражения не приносят пользы;
- Писать ответ ПРОПИСНЫМИ БУКВАМИ;
- Материться. Это невежливо и неэтично по отношению к другим пользователям.
Пример вопроса
Аноним
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Хороший ответ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Плохой ответ
Аноним
Ну, синоним это такое слово, которое очень похоже на другое по своему обозначению. Тут может подойти что-то связанное с морем.
Будьте внимательны!
- Копировать с других сайтов запрещено. Стикеры и подарки за такие ответы не начисляются. Используй свои знания. 🙂
- Публикуются только развернутые объяснения. Ответ не может быть меньше 110 символов!
Как добавить хороший ответ?
Что необходимо делать:
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Что делать не стоит:
- Списывать или копировать что-либо. Высоко ценятся ваши личные, уникальные ответы;
- Писать не по сути. «Я не знаю». «Думай сам». «Это же так просто» – подобные выражения не приносят пользы;
- Писать ответ ПРОПИСНЫМИ БУКВАМИ;
- Материться. Это невежливо и неэтично по отношению к другим пользователям.
Пример вопроса
Аноним
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Хороший ответ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Плохой ответ
Аноним
Ну, синоним это такое слово, которое очень похоже на другое по своему обозначению. Тут может подойти что-то связанное с морем.
Узнай, что тебя ждёт на ЕГЭ 2021
Регулярно решая тесты, ты сможешь оценить свой уровень знаний и поработать над слабыми местами
Перейти к разделу
Хочешь выучивать по 10 английских слов в день?
Выбирай верные определения слов и продвигайся в рейтинге игроков. Чем больше слов запоминаешь, тем выше результат!
Играть!
Получи подарки и стикеры «Вконтакте»
Отвечая на вопросы любознательных учеников, зарабатывай баллы, которые можно потратить на подарок себе или другу!
Узнать больше

Источник
Наверняка со школы всем известно, что бывает 4 агрегатных состояния вещества – твёрдое, жидкое, газообразное и плазма. Последнее известно вам многим, хотя и не все представляют, что это такое. Но ведь агрегатных состояний куда больше!
Основных, самых распространённых, пять. Но если учитывать все необычные состояния веществ, то получится около 15. Итак, в каких же формах бывает вещество?
P.S. твёрдое, жидкое и газообразное я описывать не буду – вы все про них знаете????
Плазма
Четвёртое агрегатное состояние, про которое знает большинство людей. Это состояние образуется при нагревании газа. Когда температуры очень высокие, некоторые электроны отсоединяются от своих ядер и начинают хаотично летать среди газового облака – настолько много стало у них энергии. Образуется так называемый ионизированный газ.
Плазма, в отличие от газа, отлично проводит электрический ток – поэтому её используют, к примеру, в газоразрядных лампах. А получают её очень просто – либо нагревом свыше 1 миллиона градусов, либо пропусканием электрического тока.
Кстати, плазму применяют и в сварке – плазменная сварка начинает использоваться повсеместно и её можно сделать чуть ли не своими руками!
Конденсат Бозе-Эйнштейна
Если можно очень сильно нагреть вещество, почему его нельзя очень сильно охладить? Ответ на этот вопрос даёт абсолютный ноль – значение температуры в -273,15 °C или 0 К (Кельвинов). При этой температуре у любых частиц пропадает вся кинетическая энергия и молекулы перестают двигаться. Тем не менее, абсолютный ноль недостижим, так как даже при отсутствии энергии атомы продолжают колебаться – это происходит из-за особенностей квантового мира.
Но если мы будем очень близко подходить к значению абсолютного нуля, то получим Конденсат Бозе-Эйнштейна – агрегатное состояние вещества, когда квантовые эффекты начинают проявляться на макроскопическом уровне. До сих пор это состояние изучено крайне мало, но тем не менее, мы смогли заморозить даже свет! Учёные сумели охладить пучок фотонов до 0.0000001 К, и при этом они начали себя вести как одна громадная волна.
Аморфные вещества
Итак, аморфные тела находятся между твёрдыми и жидкими веществами. у них есть кристаллическая решётка (как у углерода или кремния), но она не является строго упорядоченной, а имеет достаточно пространства для того, чтобы “плавать” (как это делают молекулы воды).
Самым известным примером аморфного тела является стекло. И хотя на бытовом уровне разница между ним и стеной из кремния незаметна, это всё же абсолютно разные состояния – нужно лишь посмотреть в микроскоп!
Кстати, то, что стекло стекает со временем вниз – это миф. Старые стёкла, обладающие такой особенностью, просто страдали от несовершенств изготовления стёкол в прошлом. Можете проверить этот миф на современных стёклах – хоть 1000 лет смотрите на них, ничего не увидите 🙂
Сверхтекучие жидкости
Эта особенность начинает проявляться при приближении к абсолютному нулю. Когда учёные охлаждали гелий, то заметили, что в какой-то момент времени он становится настолько текучим, что чуть ли не нарушает законы гравитации и поверхностного натяжения и ползёт вверх по стенкам пробирки!
Второе замечательное свойство этих жидкостей – это сверхпроводимость. То есть неважно, какого объёма была бы жидкость. Нагрей её в одном месте – и она моментально распределит всё тепло в своём объёме и передаст его в другую точку!
Кстати, некоторые конденсаты Бозе-Эйнштейна обладают теми же свойствами. И всё же это два разных агрегатных состояния.
Вырожденный газ
Отправляемся в космос! Здесь могут быть просто дикие формы материи. Вы же знаете, как образуются чёрные дыры? Когда масса звезды очень большая, а её радиус, напротив, очень мал, то вещество начинает сжиматься, пока не коллапсирует (очень быстро сжимается) в чёрную дыру. Из неё уже ничто не сможет вырваться…
Мы не знаем, из чего состоят чёрные дыры. Но мы знаем, что вещество предколлапсирующей звезды – это электронно-вырожденный газ, когда гравитация пытается “опустить” электроны с высших слоёв на низшие, а сами электроны этого сделать не дают.
Любопытно ещё вещество, из которого состоят нейтронные звёзды. Как понятно из названия, эти звёзды состоят целиком из нейтронов, что очень и очень ненормально… Как раз эту ненормальность и называют нейтронно-вырожденным веществом
Фотонное вещество
Помните, вам говорили, что частицы света, фотоны, не имеют массу? Забудьте. Тут физики из MIT и Гарварда научились замедлять фотоны настолько, что они начинают обмениваться энергией между собой и даже формировать “молекулы света”!
На самом деле фотоны остаются безмассовыми и молекула света выглядит молекулой просто внешне. Хотя это свойство можно будет использовать в будущих изобретениях – к примеру, в световых мечах, которые до этого момента казались детской мечтой.
Кварк-глюонная плазма
Теперь прыгнем назад во времени – в самое начало, на 13.8 миллиарда световых лет. После Большого взрыва не было звёзд и планет, не было молекул и атомов, даже электронов, протонов и нейтронов. Вся материя существовала в форме кварков (частичек материи) и глюонов (переносчиков взаимодействий между кварками). Температура там была настолько огромной, что наши законы физики попросту не работали при ней! Все частицы двигались со скоростью света, и этому бульону потребовалось долгое время, чтобы остыть.
Кстати, кварк-глюонная плазма существует не только в наших теориях – учёные смогли получить её на Большом Адронном Коллайдере и узнали много интересного про её свойства.
Множество других состояний
Существуют также и другие – тёмная материя и тёмная энергия, металлы Яна-Теллера, глазма, кварковая материя и многие другие. Но те, про которые вы прочитали, являются основными, поэтому их стоит знать.
Итак, на вопрос “сколько всего агрегатных состояний” вы можете сказать “около 15”. А можете привести в пример только 5 – большинство учёных придерживаются именно этой цифры 🙂
Понравилась статья? Ставьте палец вверх и подписывайтесь на мой канал – там ещё множество научных тем: космос, химия, физика, технологии,изобретения и многое другое. Читайте меня в телеграме (Будни Учёного 2.0) и в Яндекс.Дзене (Мир науки)!
Источник
Определение 1
Агрегатные состояния вещества(от лат. “aggrego” означает “присоединяю”, “связываю”) – это состояния одного и того же вещества в твердом, жидком и газообразном виде.
При переходе из одного состояния в другое наблюдается скачкообразное изменение энергии, энтропии, плотности и прочих свойств вещества.
Твердые и жидкие тела
Определение 2
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
- Кристаллические;
- Аморфные.
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение. Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Определение 3
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом. Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение 4
Газ – это такое состояние вещества, при котором расстояния между молекулами огромны.
Силами взаимодействия между молекулами при небольших давлениях можно пренебречь. Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Как известно, вещества способны переходить из одного агрегатного состояния в другое.
Определение 5
Испарение – это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости либо твердого тела вылетают молекулы, кинетическая энергия которых преобразовывает потенциальную энергию взаимодействия молекул.
Испарение является фазовым переходом. При испарении часть жидкости или твердого тела преобразуется в пар.
Определение 6
Вещество в газообразном состоянии, которое находится в динамическом равновесии с жидкостью, называется насыщенным паром. При этом изменение внутренней энергии тела равняется:
∆U=±mr (1),
где m – это масса тела, r – это удельная теплота парообразования (Дж/кг).
Определение 7
Конденсация представляет собой процесс, обратный парообразованию.
Изменение внутренней энергии рассчитывается по формуле (1).
Определение 8
Плавление – это процесс преобразования вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
При нагревании вещества растет его внутренняя энергия, поэтому увеличивается скорость теплового движения молекул. При достижении веществом своей температуры плавления кристаллическая решетка твердого тела разрушается. Связи между частицами также разрушаются, растет энергия взаимодействия между частицами. Теплота, которая передается телу, идет на увеличение внутренней энергии данного тела, и часть энергии расходуется на совершение работы по изменению объема тела при его плавлении. У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
∆U=±mλ (2),
где λ – это удельная теплота плавления (Дж/кг).
Определение 9
Кристаллизация представляет собой процесс, обратный плавлению.
Изменение внутренней энергии рассчитывается по формуле (2).
Изменение внутренней энергии каждого тела системы при нагревании или охлаждении вычисляется по формуле:
∆U=mc∆T (3),
где c – это удельная теплоемкость вещества, ДжкгК, △T – это изменение температуры тела.
Определение 10
При рассматривании преобразований веществ из одних агрегатных состояний в другие нельзя обойтись без так называемого уравнения теплового баланса: суммарное количество теплоты, выделяемое в теплоизолированной системе, равняется количеству теплоты (суммарному), которое в данной системе поглощается.
Q1+Q2+Q3+…+Qn=Q’1+Q’2+Q’3+…+Q’k.
По сути, уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
В теплоизолированном сосуде находятся вода и лед с температурой ti=0°C. Масса воды mυ и льда mi соответственно равняется 0,5 кг и 60 г. В воду впускают водяной пар массой mp=10 г при температуре tp=100°C. Какой будет температура воды в сосуде после того, как установится тепловое равновесие? При этом теплоемкость сосуда учитывать не нужно.
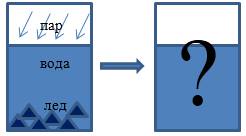
Рисунок 1
Решение
Определим, какие процессы осуществляются в системе, какие агрегатные состояния вещества мы наблюдали и какие получили.
Водяной пар конденсируется, отдавая при этом тепло.
Тепловая энергия идет на плавление льда и, может быть, нагревание имеющейся и полученной изо льда воды.
Прежде всего, проверим, сколько теплоты выделяется при конденсации имеющейся массы пара:
Qp=-rmp;Qp=2,26·106·10-2=2,26·104 (Дж),
здесь из справочных материалов у нас есть r=2,26·106 Джкг – удельная теплота парообразования (применяется и для конденсации).
Для плавления льда понадобится следующее количество тепла:
Qi=λmiQi=6·10-2·3,3·105≈2·104 (Дж),
здесь из справочных материалов у нас есть λ=3,3·105 Джкг – удельная теплота плавления льда.
Выходит, что пар отдает тепла больше, чем необходимо, только для расплавления имеющегося льда, значит, уравнение теплового баланса запишем следующим образом:
rmp+cmp(Tp-T)=λmi+c(mυ+mi)(T-Ti).
Теплота выделяется при конденсации пара массой mp и остывании воды, образуемой из пара от температуры Tp до искомой T. Теплота поглощается при плавлении льда массой mi и нагревании воды массой mυ+mi от температуры Ti до T. Обозначим T-Ti=∆T для разности Tp-T получаем:
Tp-T=Tp-Ti-∆T=100-∆T.
Уравнение теплового баланса будет иметь вид:
rmp+cmp(100-∆T)=λmi+c(mυ+mi)∆T;c(mυ+mi+mp)∆T=rmp+cmp100-λmi;∆T=rmp+cmp100-λmicmυ+mi+mp.
Сделаем вычисления с учетом того, что теплоемкость воды табличная
c=4,2·103 ДжкгК, Tp=tp+273=373 К, Ti=ti+273=273 К:∆T=2,26·106·10-2+4,2·103·10-2·102-6·10-2·3,3·1054,2·103·5,7·10-1≈3 (К),
тогда T=273+3=276 К
Ответ: Температура воды в сосуде после установления теплового равновесия будет равняться 276 К.
Пример 2
На рисунке 2 изображен участок изотермы, который отвечает переходу вещества из кристаллического в жидкое состояние. Что соответствует данному участку на диаграмме p,T?
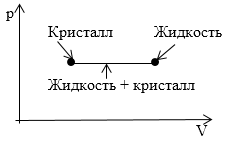
Рисунок 2
Ответ: Вся совокупность состояний, которые изображены на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T показано одной точкой, которая определяет значения p и T, при которых происходит преобразование из одного агрегатного состояния в другое.
Источник
