Какие важнейшие свойства отражены в фторе

В Периодической системе Менделеева фтор находится во втором периоде. Атомный вес фтора 19 и атомный номер 9.
Свободный фтор – бледно-желтый газ. Запах фтора резкий и раздражающий, напоминает одновременно запах хлора и озона. По запаху можно обнаружить присутствие одной части фтора в миллионе частей воздуха. Один литр газа при 0°С и нормальном давлении весит 1,71 г.
При низкой температуре (-187°С) фтор конденсируется в жидкость канареечно-желтого цвета.
Жидкий фтор обладает высоким удельным весом. До сих пор во многих литературных источниках и учебниках фигурирует старое (заниженное) значение плотности фтора при т. кип. – 1,108 г/см3. Точное значение плотности фтора – 1,513 г/см3 (при т. кип.).
При обычной температуре, даже применяя высокое давление, фтор невозможно превратить в жидкость – вследствие низкой критической температуры (-129°С). Поэтому при конденсации и хранении фтора не пригодны способы, разработанные для хлора. При -218°С жидкий фтор замерзает в светло-желтое кристаллическое тело, которое ниже -252°С становится бесцветным.
Фтор первый член группы галогенов. По своим свойствам он во многом напоминает их, но, подобно всем первым членам групп других элементов, обнаруживает и значительные отличия. Атом фтора имеет всего два электронных слоя (n=2). Во внутреннем (К-слое) содержится два, а во внешнем (L-слое) – семь электронов. Это сообщает фтору ярко выраженные электроотрицательные свойства. Благодаря нечетному числу электронов во внешнем слое фтор особенно легко присоединяет электрон, превращаясь в отрицательный одновалентный ион.
Фтор обладает рядом особенностей, которые в известной степени объясняют своеобразные свойства его соединений. В первую очередь следует отметить малые размеры атома фтора. Так, его атомный радиус 0,64, тогда как радиус хлора равен 0,99, а радиус йода 1,33 Å. Таким образом, объем атома фтора составляет только одну четвертую часть объема атома хлора и менее одной десятой объема атома йода. Приобретая один недостающий электрон, атом фтора превращается в анион, который также отличается минимальной величиной ионного радиуса – 1,33 Å (соответствующие радиусы хлора и брома: 1,81 и 2,20 Å). Малые размеры атомов позволяют фтору плотно упаковываться вокруг атомов других элементов, в результате чего образуются соединения, богатые фтором и соответствующие высшим валентностям элементов, например: SF6, S2F10, UF6, IF7, OsF8.
Фтор обладает наибольшей реакционной способностью среди неметаллических элементов, его окислительный потенциал выше потенциала озона. Высокая электроотрицательность фтора обусловлена максимальным (по сравнению с другими элементами) сродством к электрону и очень большим потенциалом ионизации. Нормальный электродный потенциал фтора 2,85 в, тогда как для хлора и кислорода эта величина составляет 1,36 и 1,22 в. Если электроотрицательность фтора, выраженную в условных единицах, сравнить с электроотрицательностью некоторых других элементов, получается следующий ряд: фтор (4), кислород (3,5), азот и хлор (3,0), углерод (2,5), литий (1).
Причиной большой реакционной способности атомов фтора является стремление завершить октет внешнего электронного слоя, и сила этого стремления настолько велика, что фтор взаимодействует со всеми веществами за исключением некоторых инертных газов. Все реакции с участием фтора отличаются очень высоким тепловым эффектом. Например, на 1 кг эквимолекулярной смеси лития и фтора выделяется 5650 ккал, бериллия и фтора 4830, углерода и фтора 1830 ккал. При взаимодействии фтора с водородом выделяется 128,4 ккал/моль, тогда как присоединение водорода к кислороду сопровождается выделением только 57,8 ккал/моль.
С кислородом и азотом, которые наиболее близки фтору по своей электроотрицательности, он непосредственно не соединяется. Азот можно использовать как инертный разбавитель при реакциях фтора в газовой фазе. С кислородом фтор соединяется только в электрическом разряде, образуя сравнительно стабильное соединение – дифторид кислорода OF2. Поскольку фтор более электроотрицательный элемент, чем кислород, то в данном соединении атом кислорода заряжен положительно. В этом заключается резкое отличие фтора от других галогенов, образующих с кислородом неустойчивые окислы с отрицательно заряженным кислородом. И вообще во всех соединениях с кислородом фтор имеет отрицательный заряд, поэтому нельзя ожидать образования кислородных кислот фтора, аналогичных кислотам хлора, например, фторноватой HFO3 или фторной HFO4.
Фтор при комнатной и даже при пониженной температуре реагирует с бромом, кремнием, аморфным углем и некоторыми металлами. Тепловой эффект реакции настолько велик, что пламя сгорающих в среде фтора веществ по яркости напоминает кислородно-ацетиленовое пламя или пламя электросварки.
Оригинальность химического поведения фтора и часто удивительные результаты его взаимодействия с другими элементами и их соединениями в известной степени объясняются тем, что он является наиболее электроотрицательным элементом и, входя в состав молекулы, вызывает резкое изменение распределения электронной плотности. Так, введение фтора в неорганические и органические кислоты превращает “их в более сильные кислоты, чем те, которые не содержат фтора. Неорганические фториды азота (трехфтористый азот, тетрафтор гидразин и перфторамины) не обладают основными свойствами. Фтор в любых соединениях имеет отрицательную степень окисления. Только в молекулярном фторе степень окисления равна нулю. Даже в соединении с кислородом F2O фтор имеет отрицательную степень окисления.
Большая электроотрицательность фтора обусловливает возникновение водородной связи во фтористом водороде.
Особенностью молекулы фтора является малая величина энергии связи, равная 37 ккал/моль. Если сопоставить ее с энергиями связей в молекулах других галогенов, то она окажется близкой к энергии диссоциации йода:
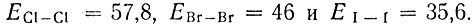
Именно это обстоятельство наряду с большими энергиями связей, образуемых атомом фтора с другими атомами (за исключением азота и кислорода), обусловливает исключительно высокую химическую активность элементарного фтора по сравнению с другими галогенами и неметаллами.
Малая энергия связи в молекуле фтора обусловливает малую прочность молекулы, иначе говоря, -диссоциацию, часто предшествующую химическим процессам. Диссоциация может быть вызвана либо термически, либо фотохимически. Несмотря на небольшую энергию диссоциации связи F – F, необходимы весьма высокие температуры, чтобы молекула фтора заметно диссоциировала. Так, при 300°С степень диссоциации фтора составляет 0,0005, а при 500°С – 0,3%. Однако следует иметь в виду, что при чрезвычайно низкой энергии активации, потребной, например, для отщепления водорода атомами фтора, вероятно, даже такая малая степень диссоциации достаточна, чтобы вызвать в данном случае ценной процесс. Более того, если не принять мер предосторожности, вследствие выделения значительного количества тепла произойдет быстрое разветвление цепной реакции.
Большинство металлов взаимодействует с фтором при обычной температуре, но многие из них образуют стойкую защитную пленку фторида, которая препятствует дальнейшей реакции. Свинец, уран, ванадий реагируют с фтором на холоде. Натрий и кальций в этих условиях воспламеняются. При небольшом разогревании во фторе загораются титан, молибден и вольфрам. С фтором энергично взаимодействуют нагретые металлы платиновой группы. Так, осмий и рутений загораются в атмосфере фтора при 250°С, а платина и палладий – при температуре темно-красного каления.
Очень важным соединением является трехфтористая сурьма- реагент обмена галоидов на фтор. Наиболее простой способ ее получения – растворение трехокиси сурьмы во фтористоводородной кислоте. Не меньшее значение в химии фтора имеют фториды кобальта – дифторид и (мощный фторирующий агент!) трифторид. Последний получают действием фтора на дихлорид или дифторид кобальта при 150°С.
При взаимодействии элементарного фтора с другими галоидами образуются галоидофториды. Известны фториды иода, брома и хлора.
Галоидофториды очень реакционноспособные вещества. В этом отношении они приближаются к элементарному фтору. Трифторид брома, например, взрывообразно реагирует с водой, деревом, резиной и даже асбестом. Наиболее интересное свойство галоидофторидов – их сильное окислительное действие.
Наиболее реакционноспособен трифторид хлора. Он почти количественно превращает хлористое серебро во фторид двухвалентного серебра AgF2 – один из лучших фторирующих агентов. С окислами металлов трифторид хлора образует фториды высшей валентности: например, урановые соединения при реакции с ним количественно превращаются в гексафторид урана.
Алюминий, железо, хром, никель при обычной температуре образуют защитную пленку фторида. Коррозионная устойчивость деталей из этих металлов снижается с увеличением содержания в них углерода, кремния, титана и других легирующих добавок. Из стали можно изготовлять трубопроводы, используемые только при обычной температуре. Однако пленка фторида не всегда защищает металлы от фтора. Серебро и железо загораются во фторе при температуре около 500°С, но “никель, покрытый фтористым никелем, не реагирует с фтором даже при 600°С.
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем, при этом образуется фтористый водород и элементарный кислород:
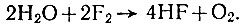
В этой реакции, в отличие от обычных случаев горения, кислород не причина, а продукт горения.
Перфторметан (четырехфтористый углерод) – единственное органическое вещество, которое при обычной температуре не взаимодействует с фтором. Фториды металлов, находящихся в состоянии высшей валентности, также противостоят фтору. Они менее летучи, чем соответствующие хлориды. Для неметаллов наблюдается обратная закономерность (табл. 1).
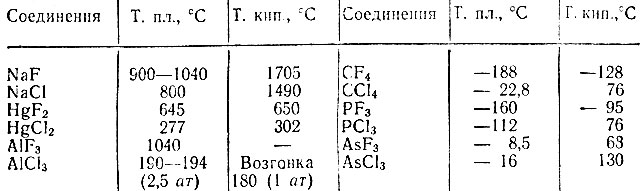
Таблица 1
Фтор имеет только один устойчивый изотоп – F19. Известны радиоактивные изотопы фтора с массами 16, 17, 18, 20, 21, но они имеют настолько короткие периоды полураспада, что практическое применение их, например в качестве меченых атомов, весьма ограничено. При кратковременных опытах, вероятно, может применяться F18, период полураспада которого 105 мин.
До недавнего времени было известно, что атомы инертных, или, как их называли ранее, благородных газов, не склонны принимать или отдавать электроны, что у них нет ни отрицательной, ни положительной валентности и что они не вступают в химические реакции; полностью укомплектованная электронная оболочка лишает эти атомы химической жизни. “Химическая пустыня” – так выглядели инертные газы, составляющие нулевую группу элементов. Но в 1962 г. в этой пустыне были обнаружены признаки жизни!
Барлетт, действуя кислородом на гексафторид платины, получил соединение PtF6O2 и показал, что оно имеет ионное строение [O2]+[PtF6]-. Он предположил, что если гексафторид платины может окислить молекулярный кислород до O+2, то он должен быть способен также превратить ксенон в Хе+, поскольку первые потенциалы ионизации молекулярного кислорода (12, 2 эв) и ксенона (12, 13 эв) практически одинаковыми действительно: при взаимодействии ксенона с гексафторидом платины, который также является газом, Барлетт получил оранжево-желтое твердое вещество, которому было приписано тоже ионное строение [Xe]+[PtF6]. Это вещество сублимируется в вакууме и гидролизуется водой до ксенона, кислорода, фтористого водорода и двуокиси платины. Оказалось, что сравнительно несложными операциями можно осуществить непосредственную реакцию между фтором и инертными газами. Заповедные вещества, которые с молчаливого согласия химиков оставались нетронутыми в течение многих десятилетий, вскоре сделались объектом многочисленных исследований. Достаточно сказать, что за пять лет после работ Барлетта было опубликовано несколько сот исследований, посвященных химии “инертных” газов.
Действуя ксеноном на фтор при 400°С, исследователи получили четырехфтористый ксенон XeF4, представляющий собой бесцветные кристаллы. Это вещество устойчиво при комнатной температуре и плавится около 100°С. Были получены также фторид и гаксафторид ксенона, соединения криптона и радона (KrF4 и RnFx.) и такие вещества, как XeRnF6, XeF2(SbF5).
Тетрафторид и гексафторид ксенона гидролизуются в воде, образуя водные растворы ХеО3. Растворы эти устойчивы, обладают сильным окислительным действием. Описаны соли ксеноновой кислоты – перксенаты: Na4XeO6•2,2H2O, Ba2Xeo6•1,5H2O и др.
Водные растворы перксената натрия медленно выделяют кислород, образуя элементарный ксенон. Многие из соединений ксенона стабильны при обычной температуре, но XeO3, представляющий собой твердое белое вещество, взрывается в вакууме при нагревании до 40°С. Особенностью этих соединений является совмещение в одной молекуле сильно электроотрицательных атомов кислорода и фтора и атомов наиболее тяжелых инертных газов. Легкие инертные газы – гелий и неон, у которых внешние электроны связаны более прочно, не реагируют так легко, хотя не исключено, что некоторые их соединения могут быть получены. Вероятно, химия легких инертных газов будет еще более своеобразной, а методы их получения окажутся не менее оригинальными.
Таким образом, оказалась развенчанной легенда о полной инертности элементов нулевой группы, недавно казавшаяся аксиомой, и подтверждена способность фтора давать соединения со всеми элементами.
Источник
Фтор – химический элемент (символ F, атомный номер 9), неметалл, который относится к группе галогенов. Это самое активное и электроотрицательное вещество. При нормальной температуре и давлении молекула фтора является ядовитым газом бледно-желтого цвета с формулой F2. Как и другие галоиды, молекулярный фтор очень опасен и при контакте с кожей вызывает тяжелые химические ожоги.
Использование
Фтор и его соединения широко применяются, в т. ч. и для получения фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Плавиковая кислота используется для травления стекла, а плазма из фтора – для производства полупроводниковых и других материалов. Низкие концентрации ионов F в зубной пасте и питьевой воде могут помочь предотвратить кариес зубов, в то время как более высокие концентрации входят в состав некоторых инсектицидов. Многие общие анестетики представляют собой производные фторуглеводородов. Изотоп 18F является источником позитронов для получения медицинских изображений методом позитронно-эмиссионной томографии, а гексафторид урана используется для разделения изотопов урана и получения обогащенного урана для атомных электростанций.

История открытия
Минералы, содержащие соединения фтора, были известны за много лет до выделения этого химического элемента. Например, минерал плавиковый шпат (или флюорит), состоящий из фторида кальция, был описан в 1530 г. Георгием Агриколой. Он заметил, что его можно использовать в качестве флюса — вещества, которое помогает снизить температуру плавления металла или руды и помогает очистить нужный металл. Поэтому фтор название свое латинское название получил от слова fluere («течь»).
В 1670 году стеклодув Генрих Шванхард обнаружил, что стекло травится под действием фтористого кальция (плавикового шпата), обработанного кислотой. Карл Шееле и многие более поздние исследователи, в том числе Гемфри Дэви, Жозеф-Луи Гей-Люссак, Антуан Лавуазье, Луи Тенар, экспериментировали с плавиковой кислотой (HF), которую было несложно получить путем обработки CaF концентрированной серной кислотой.
В конце концов, стало понятно, что HF содержит ранее неизвестный элемент. Это вещество, однако, из-за его чрезмерной реактивности в течение многих лет выделить не удавалось. Его не только трудно отделить от соединений, но оно тут же вступает в реакцию с другими их компонентами. Выделение элементарного фтора из плавиковой кислоты чрезвычайно опасно, и ранние попытки ослепили и убили нескольких ученых. Эти люди стали известны как «мученики фтора».

Открытие и производство
Наконец, в 1886 году французскому химику Анри Муассану удалось выделить фтор путем электролиза смеси расплавленных фторидов калия и плавиковой кислоты. За это он был удостоен Нобелевской премии 1906 года в области химии. Его электролитический подход продолжает использоваться сегодня для промышленного получения данного химического элемента.
Первое масштабное производство фтора началось во время Второй мировой войны. Он требовался для одного из этапов создания атомной бомбы в рамках Манхэттенского проекта. Фтор использовался для получения гексафторида урана (UF6), который, в свою очередь, применялся для отделения друг от друга двух изотопов 235U и 238U. Сегодня газообразный UF6 необходим для получения обогащенного урана для ядерной энергетики.
Важнейшие свойства фтора
В периодической таблице элемент находится в верхней части 17 группы (бывшая группа 7А), которую называют галогенной. К другим галогенам относятся хлор, бром, йод и астат. Кроме того, F находится во втором периоде между кислородом и неоном.
Чистый фтор – это коррозионный газ (химическая формула F2) с характерным резким запахом, который обнаруживается в концентрации 20 нл на литр объема. Как наиболее реактивный и электроотрицательный из всех элементов, он легко образует соединения с большинством из них. Фтор слишком реактивный, чтобы существовать в элементарной форме и имеет такое сродство с большинством материалов, включая кремний, что его нельзя готовить или хранить в стеклянных емкостях. Во влажном воздухе он реагирует с водой, образуя не менее опасную плавиковую кислоту.
Фтор, взаимодействуя с водородом, взрывается даже при низкой температуре и в темноте. Он бурно реагирует с водой, образуя плавиковую кислоту и газообразный кислород. Различные материалы, в том числе мелкодисперсные металлы и стекла, в струе газообразного фтора горят ярким пламенем. Кроме того, данный химический элемент образует соединения с благородными газами криптоном, ксеноном и радоном. Однако непосредственно с азотом и кислородом он не реагирует.
Несмотря на крайнюю активность фтора, сегодня стали доступны методы его безопасной обработки и транспортировки. Элемент может храниться в емкостях из стали или монеля (богатого никелем сплава), так как на поверхности этих материалов образуются фториды, которые препятствуют дальнейшей реакции.
Фториды – это вещества, в которых фтор присутствует в виде отрицательно заряженного иона (F-) в сочетании с некоторыми положительно заряженными элементами. Соединения фтора с металлами являются одними из наиболее стабильных солей. При растворении в воде они делятся на ионы. Другими формами фтора являются комплексы, например, [FeF4]-, и H2F+.

Изотопы
Существует множество изотопов данного галогена, начиная от 14F и заканчивая 31F. Но изотопный состав фтора включает только один из них, 19F, который содержит 10 нейтронов, так как только он является стабильным. Радиоактивный изотоп 18F – ценный источник позитронов.
Биологическое воздействие
Фтор в организме в основном содержится в костях и зубах в виде ионов. Фторирование питьевой воды в концентрации менее одной части на миллион значительно снижает частоту кариеса — так считают в Национальном исследовательском совете Национальной академии наук США. С другой стороны, избыточное накопление фтора может привести к флюорозу, который проявляется в крапчатости зубов. Этот эффект обычно наблюдается в местностях, где содержание данного химического элемента в питьевой воде превышает концентрацию 10 промилле.
Элементарный фтор и фтористые соли токсичны и с ними следует обходиться с большой осторожностью. Контакта с кожей или глазами следует тщательно избегать. Реакция с кожным покровом производит фтористоводородную кислоту, которая быстро проникает через ткани и реагирует с кальцием в костях, повреждая их навсегда.
Фтор в окружающей среде
Ежегодная мировая добыча минерала флюорита составляет около 4 млн т, а общая мощность разведанных месторождений находится в пределах 120 млн т. Основными районами добычи этого минерала являются Мексика, Китай и Западная Европа.
В природе фтор встречается в земной коре, где его можно найти в горных породах, угле и глине. Фториды попадают в воздух при ветровой эрозии почв. Фтор является 13-м по распространенности химическим элементом в земной коре – его содержание равно 950 промилле. В почвах его средняя концентрация – примерно 330 промилле. Фтороводород может выделяться в воздух в результате процессов горения в промышленности. Фториды, которые находятся в воздухе, в конечном итоге выпадают на землю или в воду. Когда фтор образует связь с очень мелкими частицами, то может оставаться в воздухе в течение длительного периода времени.
В атмосфере 0,6 миллиардных долей данного химического элемента присутствуют в виде солевого тумана и органических соединений хлора. В городских условиях концентрация достигает 50 частей на миллиард.

Соединения
Фтор – это химический элемент, который образует широкий спектр органических и неорганических соединений. Химики могут заменить им атомы водорода, тем самым создавая множество новых веществ. Высокореактивный галоген образует соединения с благородными газами. В 1962 году Нил Бартлетт синтезировал гексафторплатинат ксенона (XePtF6). Фториды криптона и радона также были получены. Еще одним соединением является фторгидрид аргона, устойчивый лишь при экстремально низких температурах.
Промышленное применение
В атомарном и молекулярном состоянии фтор используется для плазменного травления в производстве полупроводников, плоских дисплеев и микроэлектромеханических систем. Плавиковая кислота применяется для травления стекла в лампах и других изделиях.
Наряду с некоторыми из его соединений, фтор – это важная составляющая производства фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Химический элемент необходим для получения галогенированных алканов (галоны), которые, в свою очередь, широко использовались в системах кондиционирования воздуха и охлаждения. Позже такое применение хлорфторуглеродов было запрещено, поскольку они способствуют разрушению озонового слоя в верхних слоях атмосферы.

Гексафторид серы – чрезвычайно инертный, нетоксичный газ, относящийся к веществам, вызывающим парниковый эффект. Без фтора невозможно производство пластмасс с низким коэффициентом трения, таких как тефлон. Многие анестетики (например, севофлуран, десфлуран и изофлуран) являются производными фторуглеводородов. Гексафторалюминат натрия (криолит) применяется в электролизе алюминия.
Соединения фтора, в том числе NaF, используются в зубных пастах для предотвращения кариеса. Эти вещества добавляются в системы муниципального водоснабжения для фторирования воды, однако из-за воздействия на здоровье человека эта практика считается спорной. При более высоких концентрациях NaF используются в качестве инсектицида, особенно для борьбы с тараканами.
В прошлом фториды применялись для снижения температуры плавления металлов и руд и повышения их текучести. Фтор – это важный компонент производства гексафторида урана, который применяется для разделения его изотопов. 18F, радиоактивный изотоп с периодом полураспада 110 минут, излучает позитроны и часто используется в медицинской позитронно-эмиссионной томографии.
Физические свойства фтора
Базовые характеристики химического элемента следующие:
- Атомная масса 18,9984032 г/моль.
- Электронная конфигурация 1s22s22p5.
- Степень окисления -1.
- Плотность 1,7 г/л.
- Температура плавления 53,53 К.
- Температура кипения 85,03 К.
- Теплоемкость 31,34 Дж/(К·моль).
Источник
