Какие вещества содержатся в живых организмах

Для того чтобы понять, как устроены и как функционируют живые организмы, необходимо прежде всего знать, из каких веществ они построены, как эти вещества образуются и как молекулы этих веществ объединяются, чтобы образовать те или иные части живого организма. Эти вопросы изучает биохимия. Подробное изучение биохимии невозможно без знания химии, особенно органической и физической, и не входит в задачи школьного курса биологии. Мы рассмотрим здесь лишь наиболее важные группы веществ, входящих в состав живого, их функции в живых организмах и основные пути обмена этих веществ.
Клетки большинства живых организмов имеют сходный химический состав, но он существенно отличается от химического состава окружающей неживой среды. В первую очередь эти различия касаются структуры химических соединений, входящих в состав клеток. Кроме того, хотя в клетках можно обнаружить многие из 92 природных химических элементов, они представлены там в других пропорциях, чем в неживой природе.
Среди неорганического материала поверхностного слоя нашей планеты 98 % массы составляют кислород (О), кремний (Si), алюминий (Al), железо (Fe).
Однако в живой материи те же 98 % массы всех элементов составляют кислород (О), углерод (С), водород (Н), азот (N).
Сравнение состава земной коры и живых организмов приведено на рисунке.

Еще около 1,8 % составляют в сумме такие элементы. как фосфор (Р), сера (S), натрий (Na), калий (K), кальций (Ca), магний (Мg) и хлор (Сl). Все эти одиннадцать элементов относят к макроэлементам:
O, C, H, N, P, S — органогенные элементы + Na, K, Ca, Mg, Cl = макроэлементы.
Первые шесть элементов (водород, кислород, углерод, азот, фосфор и сера) входят в состав органических веществ и называются органогенными элементами. Они составляют основную массу органических веществ клетки — белков, углеводов, липидов и нуклеиновых кислот.
На долю всех макроэлементов приходится примерно 99,9 % массы тела человека.
Кроме того, два из них, водород и кислород, входят в состав воды — соединения, которое содержится в клетках в наибольшем количестве из всех (70–90 %) и без которого жизнь невозможна. Остальные макроэлементы (натрий, калий, кальций, магний, хлор) в основной своей массе находятся не в составе органических соединений, а присутствуют в организме в виде солей как в растворенном, так и в твердом состоянии.
Примерный элементный состав тела человека показан на рисунке.

Микроэлементы. Эти элементы составляют менее 0,01 % от сухой массы организмов. К этой группе элементов относят железо (Fe), цинк (Zn), медь (Сu), кобальт (Co), марганец (Mn), молибден (Mo), хром (Cr), йод (I) (йод), фтор (F). Каждый из них составляет менее сотой доли процента, а в сумме они представляют около 0,2 % массы живых клеток. Хотя содержание микроэлементов в клетке чрезвычайно мало, они необходимы для жизнедеятельности живых организмов.
Примеры функций микроэлементов
При недостаточном содержании или отсутствии этих элементов могут возникнуть тяжелые нарушения обмена веществ. Это связано с тем, что большая часть микроэлементов, в частности железо, цинк, медь, кобальт, марганец, являются кофакторами ферментов или входят в состав таких кофакторов, вследствие чего они необходимы для осуществления каталитической функции ферментов.
Например, железо является составной частью гема — органической молекулы небелковой природы, которая входит в состав цитохромов — компонентов цепи переноса электронов, и гемоглобина — белка, который обеспечивает транспорт кислорода от легких к тканям. Медь также обнаруживается в составе многих белков, среди которых важный компонент дыхательной цепи цитохромоксидаза, гемоцианин — белок, содержащийся в гемолимфе и переносящий кислород у многих моллюсков и членистоногих. Молибден вместе с железом представлен в активном центре фермента нитрогеназы, обеспечивающего фиксацию атмосферного азота у азотфиксирующих бактерий. Кобальт входит в состав витамина $B_12$ (цианокобаламин), который является коферментом белков, участвующих в синтезе гема.
Цинк обнаруживается в составе более 300 различных ферментов. Йод входит в состав гормонов щитовидной железы тироксина и трийодтиронина, поэтому нехватка йода приводит к возникновению заболеваний, связанных с недостаточностью этого гормона, таких как эндемичный зоб у взрослых и кретинизм у детей.
Ультрамикроэлементы. В состав этой группы входят элементы, содержание которых в организме крайне мало — менее $10^{-6}$% от сухой массы (иногда менее $10^{-12}$ %), но которые существенны для жизни. К этим элементам относятся селен (Se), бор (B), ванадий (V) и некоторые другие. Некоторые элементы этой группы, как и микроэлементы, входят в состав ферментов и существенны для проявления их активности. В частности, селен обнаружен в составе глутатионредуктазы — фермента, от которого зависит окислительно-восстановительные процессы в клетке.
Неорганические вещества
Хотя основу живых организмов составляют органические соединения, в ней также встречаются соединения, которые присутствуют в неживой природе. Из всех органических и неорганических веществ живые организмы в наибольшем количестве содержат воду. Ее содержание колеблется от 60 до 95 %. Оно зависит от вида и возраста организма, может быть различным в разных частях организма. Например, семена растений содержат лишь 10–15 % воды. В сердце человека вода составляет около 80 %, а медуза на 95 % состоит из воды. Вода важна для всех живых организмов по двум причинам. Во-первых, составляя основную массу организма, она является той средой, в которой существуют все другие компоненты живого. Во-вторых, вода участвует во многих биохимических реакциях, приводящих к образованию или распаду многих органических соединений. Кроме того, для многих организмов вода является средой обитания.
физико-химические свойства воды
Вода — полярная молекула: так как кислород более электроотрицателен, чем водород, и стягивает на себя электронную плотность, на атоме О имеется частичный отрицательный (δ–), а на атомах Н — частичный положительный (δ+) заряд.

Между О одной молекулы воды и Н другой молекулы воды возникает водородная связь. В жидкой воде водородные связи образуются между всеми молекулами, однако молекулы перемещаются, что может сопровождаться разрывом водородных связей и образованием новых.

Когда вода кипит, все водородные связи между молекулами воды должны быть разорваны, чтобы молекулы по отдельности «улетали» в пар. На разрыв водородных связей тратится энергия. Поэтому по сравнению с неполярными веществами примерно той же молекулярной массы, например метаном $CH_4$, вода имеет высокую температуру плавления и кипения, высокую теплоемкость.
Эти свойства важны для живых систем: благодаря высокой теплоемкости воды живые организмы, а также водоемы медленно нагреваются и медленно остывают, а внутри них тепло успевает равномерно распределяться по всему объему (все части нашего тела имеют близкую температуру).
В структуре льда молекулы воды также связаны водородными связями. Лед легче воды и плавает над ее поверхностью. Это защищает водоемы от полного промерзания зимой, так что организмы могут выживать подо льдом.
гидрофильность и гидрофобность
Вода играет в живых системах роль универсального растворителя. По принципу «подобное растворяется в подобном» в ней растворяются вещества полярной или ионной природы, так как частицы этих веществ содержат частичные или полные заряды и могут взаимодействовать с молекулами воды. Например, к ионам притягиваются противоположно заряженные части молекул воды, в результате чего ион гидратируется, приобретая гидратную оболочку — оболочку из молекул воды (см. рис.). Полярные молекулы, такие как этиловый спирт, тоже образуют водородные связи и гидратируются. На рисунке показано растворение поваренной соли NaCl в воде и гидратация соответствующих ионов.

Если полярные или ионные вещества не растворяются в воде, они ею тем не менее смачиваются (идет взаимодействие воды с поверхностью). Растворяющиеся в воде или смачиваемые ею вещества называются гидрофильными. Примеры гидрофильных веществ — соли, этанол, соляная и уксусная кислоты, сахары, растворимые белки и др.
Вещества, молекулы которых неполярны, плохо растворяются в воде и не смачиваются ею. Их молекулы не способны взаимодействовать с молекулами воды и образовывать водородные связи. Нахождение их молекул среди молекул воды энергетически невыгодно. Они как бы стремятся минимизировать площадь поверхности контакта с водой, то есть «избегают воды» — это гидрофобные вещества (от греч. «гидрос» — вода, «фобео» — боюсь). Эти вещества обычно образуют в воде отдельную фазу — взвесь капелек (эмульсию, например, молочный жир в молоке) или отдельный слой, который в зависимости от плотности тонет (например, фенол) или всплывает (например, растительное масло или бензин) в воде.
Поскольку разность электроотрицательностей углерода и водорода низка, к гидрофобным веществам относятся углеводороды — органические молекулы, построенные только из атомов С и Н, например парафин, бензин, керосин (это смеси природных углеводородов нефти).
Схема расслаивания эмульсии масла в воде приведена на рисунке.


ионы
Неорганические вещества в живых клетках помимо воды представлены в основном в виде растворенных солей. Их содержание в живых организмах составляет около 1 %. В наибольших количествах присутствуют катионы $mathrm{Na^+, K^+, Ca^{2+}, Mg^{2+}}$ и анионы хлорид $Cl^-$, фосфаты $mathrm{PO_4^{2-}}$, карбонаты $mathrm{CO_3^{2-}}$. Важно отметить, что содержание ионов в клетке и окружающей ее среде значительно различаются. Так, в клетках всегда значительно выше содержание калия, магния и ниже содержание натрия и кальция. Это обеспечивается активным переносом этих ионов через клеточную мембрану, который осуществляется специальными белками — ионными насосами. Многие катионы, особенно $mathrm{Mg^{2+}}$, находятся в клетке не в свободном состоянии, а в виде солей нуклеиновых кислот и нуклеотидов. Анионы фосфорной и угольной кислоты играют в живых организмах важную роль буферных систем, поддерживающих постоянное значение кислотности (концентрации ионов водорода $H^+$) в цитоплазме и внеклеточных жидкостях организма.
Определение
Кислотность — это концентрация ионов водорода ($H^+$). Чем больше ионов водорода, тем больше кислотность (тем более кислой считается среда).
Показателем кислотности является рН. рН чистой воды равен 7, кислых сред — меньше 7, щелочных — больше 7. Чем больше кислотность среды, тем больше в ней ионов $H^+$ и тем меньше рН. рН можно измерить при помощи индикаторной бумаги (на рисунке) или специального прибора — рН-метра.
Другие неорганические вещества образуют комплексы с белками, например входят в состав ферментов, играя важную роль в процессах катализа. В такой форме участвуют в жизнедеятельности клеток соединения железа, серы, марганца, меди, цинка, кальция, кобальта и др. Некоторые неорганические компоненты входят в состав важных органических веществ, например магний — в состав хлорофилла, а йод — в состав гормонов щитовидной железы. Особо следует отметить остатки фосфорной кислоты, входящие в состав нуклеотидов и нуклеиновых кислот и играющие важную роль в энергетических и генетических процессов в клетке.
Неорганические вещества содержатся в некоторых живых организмах в виде нерастворимых твердых веществ. Это прежде всего скелетные образования: кости позвоночных, состоящие в основном из фосфата кальция, раковины моллюсков и фораминифер, построенные из углекислого кальция, панцири диатомовых водорослей, образованные из окиси кремния. Кроме того, неорганические соли, главным образом кальциевые, входят в качестве компонентов, повышающих прочность и жесткость, в ряд структурных образований, построенных в основном из органических веществ, например в хитиновые покровы членистоногих, в межклеточное вещество растений.
Источник
Биологически значимые элементы (в противоположность биологически инертным элементам) — химические элементы, необходимые живым организмам для обеспечения нормальной жизнедеятельности.
Элементы, обеспечивающие жизнедеятельность организма, классифицируют по разным признакам — содержанию в организме, степени необходимости, биологической роли, тканевой специфичности и др[1]. По содержанию в теле человека и других млекопитающих элементы делят на
- макроэлементы (сотые доли процента и более);
- микроэлементы (от стотысячных до тысячных долей процента);
- ультрамикроэлементы (миллионные доли процента и менее)[1][2][3][4].
Некоторые авторы проводят границы между этими типами по другим значениям концентрации[5][6]. Иногда ультрамикроэлементы не отделяют от микроэлементов[5].
Макроэлементы[править | править код]
Эти элементы слагают основу плоти живых организмов.
Органогенные элементы[править | править код]
Основную долю массы клетки составляют 4 элемента[7] (указано их содержание в теле человека)[8]:
- Кислород — 65 %;
- Углерод — 18 %;
- Водород — 10 %;
- Азот — 3 %.
Эти макроэлементы называют органогенными элементами[комм. 1] или макронутриентами (англ. macronutrient)[комм. 2]. Преимущественно из них построены белки, жиры, углеводы, нуклеиновые кислоты и многие другие органические вещества. Иногда эти четыре элемента обозначают акронимом CHNO, состоящим из их обозначений в таблице Менделеева.
Другие макроэлементы[править | править код]
Ниже перечислены другие макроэлементы[1] и их содержание в теле человека[8].
- Калий — 0,35 %
- Кальций — 2 %
- Магний — 0,05 %
- Натрий — 0,15 %
- Сера — 0,25 %
- Фосфор — 1,1 %
- Хлор — 0,15 %
Микроэлементы[править | править код]
Термин «микроэлементы» получил особое распространение в медицинской, биологической и сельскохозяйственной научной литературе в середине XX века. В частности, для агрономов стало очевидным, что даже достаточное количество «макроэлементов» в удобрениях (троица NPK — азот, фосфор, калий) не обеспечивает нормального развития растений.
Содержание микроэлементов в организме мало, но они участвуют в биохимических процессах и необходимы живым организмам. Поддержание их содержания в тканях на физиологическом уровне необходимо для поддержания постоянства внутренней среды (гомеостаза) организма.
Основные микроэлементы[править | править код]
Необходимыми для жизнедеятельности растений, животных и человека считаются более 30 микроэлементов. Среди них (в алфавитном порядке):
Чем меньше концентрация элемента в организме, тем труднее установить его биологическую роль, идентифицировать соединения, в образовании которых он принимает участие. К числу несомненно важных относят бор, ванадий, кремний и др.
Биогенные элементы[править | править код]
Биогенными называют все элементы, постоянно присутствующие в живых организмах и играющие какую-либо биологическую роль, в первую очередь O, C, H, Ca, N, K, P, Mg, S, Cl, Na, Fe[12].
Совместимость[править | править код]
При усвоении организмом витаминов, микроэлементов и макроэлементов возможен антагонизм (отрицательное взаимодействие) или синергизм (положительное взаимодействие) между разными компонентами.
Недостаток минеральных веществ в организме[править | править код]
Основные причины, вызывающие недостаток минеральных веществ:
- Неправильное или однообразное питание, некачественная питьевая вода.
- Геологические особенности различных регионов Земли — эндемические (неблагоприятные) районы (см. Эндемические заболевания).
- Большая потеря минеральных веществ по причине кровотечений, болезнь Крона, язвенный колит.
- Употребление алкоголя и некоторых лекарственных средств, связывающих микроэлементы или вызывающих их потерю организмом.
Использование термина «минерал» по отношению к биологически значимым элементам[править | править код]
Микро- и макроэлементы попадают в организм главным образом с пищей. Для их обозначения в английском языке существует термин dietary mineral.
В конце XX века российские производители некоторых лекарственных препаратов и биологически активных добавок стали использовать для обозначения макро- и микроэлементов термин «минерал». С научной точки зрения такое употребление этого термина является неправильным, так как он означает только геологическое природное тело с кристаллической структурой. Тем не менее производители т. н. «биологических добавок» стали называть свою продукцию витаминно-минеральными комплексами, имея в виду минеральные добавки к витаминам.
См. также[править | править код]
- Химический состав клетки
- Рекомендуемая суточная норма потребления
- Незаменимые пищевые вещества
- Биофортификация
Примечания[править | править код]
Комментарии
- ↑ Иногда органогенными элементами (органогенами) называют только C, H, N, O[9], иногда — ещё и P и S[1], а иногда — все элементы, играющие какую-либо роль в жизни организмов[10].
- ↑ Иногда макронутриентами называют белки, жиры и углеводы[11].
Источники
- ↑ 1 2 3 4 Скальный А. В., Рудаков И. А. Биоэлементы в медицине. — Оникс 21 век, Мир, 2004. — С. 18—23. — 272 с. — ISBN 5-329-00930-8.
- ↑ Макроэлементы // Словарь ботанических терминов / И.А. Дудка. — Киев: Наукова Думка, 1984.
- ↑ Микроэлемент // Словарь ботанических терминов / И.А. Дудка. — Киев: Наукова Думка, 1984.
- ↑ Ультрамикроэлементы // Словарь ботанических терминов / И.А. Дудка. — Киев: Наукова Думка, 1984.
- ↑ 1 2 Авцын А. П., Жаворонков А. А., Риш М. А., Строчкова Л. С. Микроэлементозы человека. — М.: Медицина, 1991. — С. 16—17. — 496 с. — ISBN 5-225-02128-X.
- ↑ Кидин В.В., Торшин С.П. Агрохимия. Учебник. — Проспект, 2015. — 619 с. — ISBN 9785392187676.
- ↑ Билич Г. Л., Крыжановский В. А. Биология. Полный курс: В 4 т. — издание 5-е, дополненное и переработанное. — Оникс, 2009. — С. 20. — 864 с. — ISBN 978-5-488-02311-6.
- ↑ 1 2 Starr C., McMillan B. 2.1. Atoms and Elements // Human Biology. — 11 ed. — Cengage Learning, 2014. — P. 16. — 608 p. — ISBN 9781305445949.
- ↑ Органогенные элементы // Большая медицинская энциклопедия / гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1969—1978.
- ↑ Дедю И. И. Органогены // Экологический энциклопедический словарь. — Кишинев, 1989.
- ↑ Методические рекомендации 2.3.1.2432-08. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации.
- ↑ Биогенные элементы // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
Литература[править | править код]
- Ultratrace minerals. Authors: Nielsen, Forrest H. USDA, ARS Source: Modern nutrition in health and disease / editors, Maurice E. Shils … et al.. Baltimore: Williams & Wilkins, c 1999., p. 283—303. Issue Date: 1999.
- Авцын А. П., Жаворонков А. А., Риш М. А., Строчкова Л. С. Микроэлементозы человека. — М.: Медицина, 1991. — С. 16. — 496 с. — ISBN 5-225-02128-X.
- Скальный А. В., Рудаков И. А. Биоэлементы в медицине. — Оникс 21 век, Мир, 2004. — С. 18—19. — 272 с. — ISBN 5-329-00930-8.
Источник
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.


Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
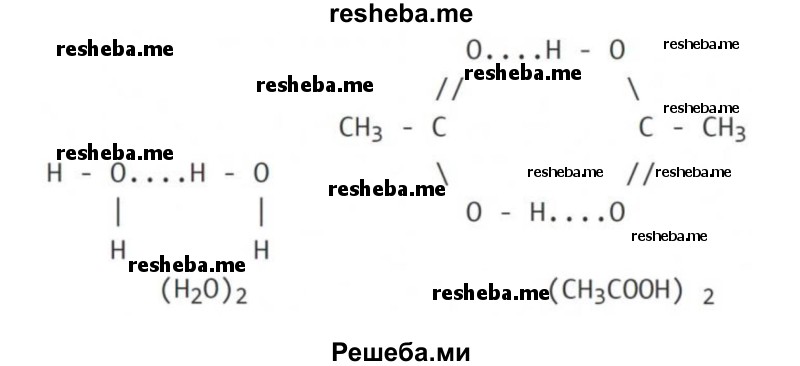
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Источник
