Каким способом можно узнать свойства вещества
Личностные УУД:
Самоопределение (оформлять свои наблюдения);
нравственно-этические (уметь наблюдать);
смысло-образование (называть наблюдаемые
предметы); воспринимать речь учителя
(одноклассников), непосредственно не обращенную
к учащемуся; выражать положительное отношение к
процессу познания: проявлять внимание,
удивление, желание больше узнать.
Регулятивные УУД:
Удерживать цель деятельности до получения ее
результата – оценивать уровень владения тем или
иным учебным действием.
Познавательные УУД:
Проверять информацию, находить дополнительную
информацию, используя микролабораторию
«Окружающий мир».
Коммуникативные УУД:
Описывать объект: передавать его внешние
характеристики, свойства
Метапредметные УУД:
Самоконтроль (сравнивать, анализировать, делать
выводы; работать с учебником, с
микролабораториями для начальной школы);
целеполагания (формировать и удерживать учебную
задачу
Предметные УУД:
Уметь группировать объекты по их признакам и
свойствам.
Цели урока:
- познакомить детей с понятиями тело, вещество и
частица; - провести опыты для определения свойств веществ
с помощью микролаборатории; - познакомить со строением веществ в разных
агрегатных состояниях; - проверить знания учащихся по пройденным темам;
- развивать память, мышление.
Оборудование:
- проектор, экран (презентация);
- переносная лаборатория «Окружающий мир»;
- для опыта: 2 стакана; чайная ложка, сахар-песок,
вода; соль пищевая, лейка, лоток ( под опыты),
штатив, пробирки 2 штуки, чашка Петри, лупа ручная; - модели веществ.
ХОД УРОКА
I. Организационный момент
II. Повторение изученного (тест)
– Начнем с повторения пройденного материала.
– Выбери правильный ответ (на экране):
(Презентация, слайд
2)
1. Солнце – это …
к) планета;
п) звезда;
м) спутник луны.
2. Самое глубокое озеро в мире – это…(Слайд 3)
р) Байкал
с) Каспийское
3. Что относится к неживой природе? (Слайд 4)
а) собака;
к) солнце;
и) самолет.
4. Какое животное нельзя увидеть в зоопарке?
(Слайд 5)
б) зебра;
в) белый тигр;
д) слон;
р) мамонт
5. Прибор для определения сторон
горизонта?(Слайд 6)
а) термометр;
и)барометр.
о) компас
6. Группа животных, у которых 6 ножек? (Слайд 7)
а) паукообразные
д) насекомые
г) звери
к) птицы
7. Океан у берегов Антарктиды? (Слайд 8)
д)Северный Ледовитый;
к) Тихий
а) Южный:
л) Индийский
(Дети читают слово “природа”.)
III. Сообщение темы и целей урока
– Ребята, выответили на все вопросы.
Посмотрите на буквы, которые получись, отвечая на
вопросы (Высказывания детей.)
– Получилось слово “ПРИРОДА”. Сегодня на уроке
мы приступимк изучению нового раздела “Эта
удивительная природа”. Этот раздел поможет
нам узнать еще больше о природе. (Слайд 9)
– Тема нашего нового урока “Тела, вещества,
частицы”. Сегодня вы познакомитесь с
понятием “тело” и узнаете, из чего оно
состоит.
IV.Беседа потеме “Тела”
– Когда вы читаете или слышите слово “тело”,
что вы представляете?
–Телами называют все предметы, окружающие
нас.Среди бесчисленных и разнообразных тел есть
тела природы илиестественные тела.(Слайд
10)
– А еще есть тела, сделанные человеком. Их
называютискусственные тела
– Назовите тела, которые относятся к первой
группе.(Паук, трава, роса, облако, бабочка и др.)
– Назовите тела, которые относятся ко второй
группе.(Стакан, пенал, машина, стол, шапка и
др.) (Слайд 11)
– Как вы считаете, являются ли Солнце, звезды,
Луна телами? (Это тела неживой природы)
– Верно, это тела естественные, а еще их называютнебеснымииликосмическимителами.
V. Физкультминутка
VI. Понятие “вещества”
– Все тела состоят из веществ. (Слайд 12)
– Тела могут быть образованы одним веществом или
несколькими веществами.
Очень сложный состав имеют живые существа.
Например, в растениях есть вода, сахар, крахмал и
другие вещества.
Веществами называют то, из чего состоят тела.
Вещества бываюттвердые, жидкие, газообразные (газ).
(Слайд 13)
(Экран временно выключается)
VII. Опыт «Свойства веществ. Частицы» Работа
с лабораториями «Окружающий мир»
Беседа о технике безопасности.
Опыты:
1 Любое вещество обладает определенными
свойствами
– У вас на столе на штативе две пробирки с
веществами. Эти вещества можно употребить в пищу.
– Рассмотрим первое вещество, пробирка под № 1. (Там
сахар-песок)
– Как вы думаете, что это за вещество, на что оно
похоже? (На соль, сахар)
– Что вы можете о нем сказать? Оно твердое, жидкое
или газообразное? (Твердое)
(Все свои выводы дети записывают в тетради)
– Оно (это вещество) имеет цвет? (Да, белый)
– Вытяните подставку-лоток в ваших лабораториях
для следующей работы по определению свойств
данного вещества.
– Достаньте из лаборатории чашку Петри
– Высыпьте из пробирки это вещество в чашку
Петри и посмотрите на нее под лупой. (Они похожи
на кристаллики)
(Такую же работу проводят с веществом – соль)
– Ученые установили, что вещества состоят из
мельчайших частиц, которые видны только под
микроскопом. Как же можно убедиться, что эти
частицы существуют? Давайте проведем опыт. Для
опыта берется тело, образованное одним веществом
– возьмем одно из белых веществ, которое у вас на
столе под №1 (сахар).
– Налейте в один из стаканов питьевой воды из
леечки.
Чайной ложкой это вещество кладем в стакан с
водой, и перемешиваем ложкой.
– Что можно сказать об этом веществе? (Сначала
оно хорошо видно, но постепенно становится
невидимым, т.е. растворился)
Вывод: Растворяется в воде.
– Во время проведения опытов, на вкус нельзя
ничего пробовать. Но ,т.к. сегодня у нас опыты с
пищевыми продуктами и я заранее подготовила воду
питьевую и тщательно промыла используемое
оборудование, я разрешаю вам попробовать воду на
вкус.
– Попробуйте воду на вкус. (Она сладкая.) Вывод:
это вещество – сахар. Значит, сахар не исчез, он
остался в стакане.
– Почему же мы не видим сахар?
– Потому, что кристаллики сахара распались на
мельчайшие частицы, из которых он состоял
(растворился). И эти частицы перемешались с
частицами воды. Этот опыт показывает, что
вещества, а значит и тела, состоят из частиц.
Дописывают к свойствам 1 вещества: сахар, имеет
вкус, растворяется в воде.
– Скажите, раствор сахара в воде – это вещество
или смесь веществ?(Смесь двух веществ: сахара и
воды.)
Такую же работу проводят с веществом №2 – солью.
– Каждое вещество состоит из особых частиц,
которые по размеру и форме отличаются от частиц
других веществ. Ученые установили, что между
частицами есть промежутки. В твердых телах эти
промежутки маленькие. В жидкостях промежутки
больше. А в газах – еще больше.
(Учитель показывает слайд).
– В любом теле все частицы находятся в
постоянном движении. Ещё в глубокой древности
учёные высказывали мысль о том, что тела состоят
из не видимых глазом частиц. Этим они объясняли
многие природные явления. Почему, например,
высыхает намокшая одежда? Потому что с неё
улетают частички воды, недоступные для нашего
глаза.
Сложные частицы состоят из простых. Одни и те же
простые частицы, по-разному соединяясь, могут
образовывать самые разные сложные частицы. Позже
учёные убедились в том, что это действительно
так. Сложные частицы назвали молекулами, а
простые – атомами.
(Учитель показывает образец сбора молекулы
кислорода)
Вывод:
– На моделях молекул мы видим разницу в
строении веществ в различных агрегатных
состояниях.
Вывод: У жидкости плотность частиц
больше чем у газов, а в твердых веществах больше
чем в жидкостях.
X. Закрепление изученного материала
Проверь с помощью учебника, верны ли
приведенные ниже утверждения:
– Любой предмет, любое живое существо можно
назвать телом.
– Вещества – это то, из чего состоят тела.
– Вещества состоят из мельчайших частиц,
невидимых глазом.
XI. Итог урока
Сегодня мы познакомились с новыми понятиями:
тела, вещества, частицы.
– На какие две группы делятся тела?
– На какие группы делятся вещества?
– Из чего состоит вещество?
Слайды 14-16
Учитель оценивает ответы детей.
XII. Домашнее задание
Прочитать текст в учебнике “Тела, вещества,
частицы”
Источник
28 марта 2012
Автор
КакПросто!
Химические свойства вещества – это способность изменять свой состав в ходе химических реакций. Реакция может протекать либо в виде саморазложения, либо при взаимодействии с другими веществами. Свойства вещества зависят не только от его состава, но и от структуры. Вот характерный пример: и этиловый спирт, и этиловый эфир имеют одинаковую эмпирическую формулу С2Н6О. Но химические свойства у них разные. Поскольку структурная формула спирта СН3–СН2-ОН, а эфира – СН3-О-СН3.
Инструкция
Есть два основных способа определения свойств: теоретический и практический. В первом случае представление о свойствах вещества делают, исходя из его эмпирической и структурной формулы.
Если это простое вещество, то есть состоящее из атомов только одного элемента, для ответа на этот вопрос достаточно посмотреть в таблицу Менделеева. Есть четкая закономерность: чем левее и ниже располагается элемент в таблице, тем сильнее у него выражены металлические свойства (достигая максимума у франция). Соответственно, чем правее и выше, тем сильнее неметаллические свойства (достигая максимума у фтора).
Если вещество относится к классу оксидов, его свойства зависят от того, с каким элементом соединен кислород. Бывают основные оксиды, образованные металлами. Соответственно, они проявляют свойства оснований: реагируют с кислотами, образуя соль и воду; с водородом, восстанавливаясь до металла. Если же основной оксид образован щелочным или щелочноземельным металлом, он вступает в реакцию с водой, образуя щелочь, или с кислотным оксидом, образуя соль. Например:СаО + Н2О = Са(ОН)2;К2О + СО2 = К2СО3.
Кислотные оксиды реагируют с водой, образуя кислоту. Например: SO2 + H2O = H2SO3. Также они реагируют с основаниями, образуя соль и воду:СО2 + 2NaOH = Na2CO3 + H2O.
Если же оксид образован амфотерным элементом (например, алюминием, германием и т.п.), он будет проявлять как основные, так и кислотные свойства.
В том случае, когда вещество более сложного строения, заключение о его свойствах делают, рассматривая целый ряд факторов. Прежде всего, исходя из наличия и количества функциональных групп, то есть тех участков молекулы, которая непосредственно образует химическую связь. Для оснований и спиртов, например, это гидроксил-группа – ОН, для альдегидов – СOH, для карбоновых кислот – СООН, для кетонов – СО и т.д.
Практический же способ, как легко понять из самого названия, заключается в проверке химических свойств вещества опытным путем. Его подвергают взаимодействию с определенными реагентами при различных условиях (температуре, давлении, в присутствии катализаторов и т.п.) и смотрят, какой будет результат.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google
Privacy Policy and
Terms of Service apply.
Источник
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
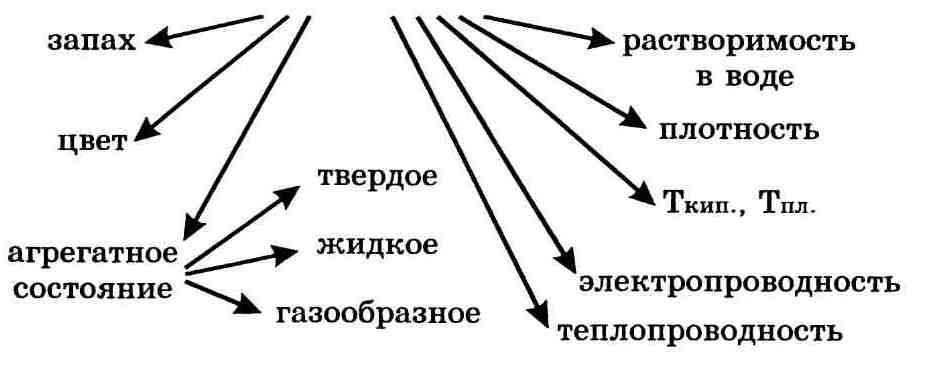
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
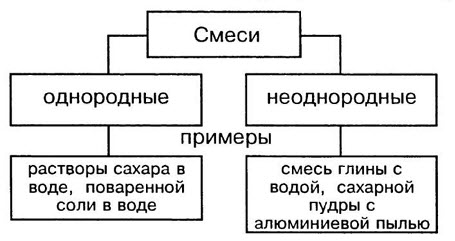
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.

Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
