Какими физическими свойствами обладает этилен
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление
этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150 C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Яркий представитель непредельных углеводородов — этен (этилен). Физические свойства: бесцветный горючий газ, взрывоопасный в смеси с кислородом и воздухом. В значительных количествах этилен получают из нефти для последующего синтеза ценных органических веществ (одноатомных и двухатомных спиртов, полимеров, уксусной кислоты и других соединений).
Гомологический ряд этилена, sp2-гибридизация
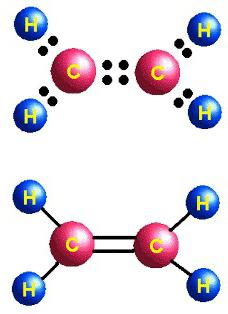
Углеводороды, сходные по строению и свойствам с этеном, называются алкенами. Исторически закрепился еще один термин для этой группы — олефины. Общая формула CnH2n отражает состав всего класса веществ. Первый его представитель — этилен, в молекуле которого атомы углерода образуют не три, а всего две õ-связи с водородом. Алкены — непредельные или ненасыщенные соединения, их формула C2H4. Смешиваются по форме и энергии только 2 p- и 1 s-электронное облако атома углерода, всего формируются три õ-связи. Это состояние называется sp2-гибридизацией. Четвертая валентность углерода сохраняется, в молекуле возникает π-связь. В структурной формуле особенность строения находит отражение. Но символы для обозначения разных типов связи на схемах обычно используются одинаковые — черточки или точки. Строение этилена определяет его активное взаимодействие с веществами разных классов. Присоединение воды и других частиц происходит благодаря разрыву непрочной π-связи. Освободившиеся валентности насыщаются за счет электронов кислорода, водорода, галогенов.
Этилен: физические свойства вещества
Этен при обычных условиях (нормальном атмосферном давлении и температуре 18°C) — бесцветный газ. Он обладает сладким (эфирным) запахом, его вдыхание оказывает наркотическое действие на человека. Затвердевает при –169,5°C, плавится при таких же температурных условиях. Кипит этен при –103,8°C. Воспламеняется при нагревании до 540°C. Газ хорошо горит, пламя светящееся, со слабой копотью. Этилен растворяется в эфире и ацетоне, значительно меньше — в воде и спирте. Округленная молярная масса вещества — 28 г/моль. Третий и четвертый представители гомологического ряда этена — тоже газообразные вещества. Физические свойства пятого и следующих алкенов отличаются, они являются жидкостями и твердыми телами.
Получение и свойства этилена
Немецкий химик Иоган Бехер случайно использовал этиловый спирт в опытах с концентрированной серной кислотой. Так впервые был получен этен в лабораторных условиях (1680 год). В середине XIX века А.М. Бутлеров дал соединению название этилен. Физические свойства и химические реакции также были описаны известным русским химиком. Бутлеров предложил структурную формулу, отражающую строение вещества. Способы его получения в лаборатории:
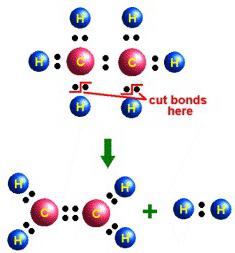
- Каталитическое гидрирование ацетилена.
- Дегидрогалогенирование хлорэтана в реакции с концентрированным спиртовым раствором сильного основания (щелочи) при нагревании.
- Отщепление воды от молекул этилового спирта (дегидратация). Проходит реакция в присутствии серной кислоты. Ее уравнение: Н2С–СН2–OH → Н2С=СН2 + Н2О
Промышленное получение:
- переработка нефти — крекинг и пиролиз углеводородного сырья;
- дегидрирование этана в присутствии катализатора. H3C–CH3 → H2C=CH2 + H2
Строение этилена объясняет его типичные химические реакции — присоединение частиц атомами C, которые находятся при кратной связи:
- Галогенирование и гидрогалогенирование. Продуктами этих реакций являются галогенопроизводные.
- Гидрирование (насыщение водородом), получение этана.
- Окисление до двухатомного спирта этиленгликоля. Его формула: OH–H2C–CH2–OH.
- Полимеризация по схеме: n(H2C=CH2) → n(-H2C–CH2-).
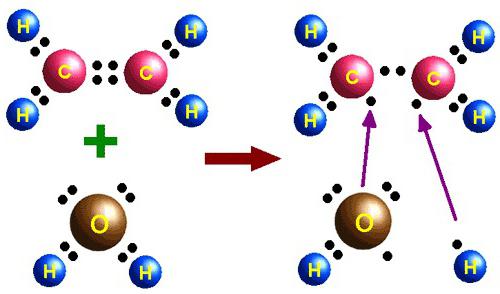
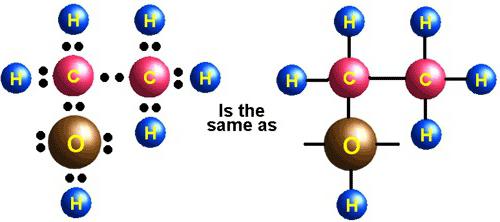
Области применения этилена
При фракционной перегонке нефти в больших объемах получают этилен. Физические свойства, строение, химическая природа вещества позволяют использовать его в производстве этилового спирта, галогенопроизводных, спиртов, оксида, уксусной кислоты и других соединений. Этен — мономер полиэтилена, а также исходное соединение для полистирола.
Дихлорэтан, который получают из этена и хлора, является хорошим растворителем, используется в производстве поливинилхлорида (ПВХ). Из полиэтилена низкого и высокого давления изготавливают пленку, трубы, посуду, из полистирола — футляры для CD-дисков и другие детали. ПВХ — это основа линолеума, непромокаемых плащей. В сельском хозяйстве этеном обрабатываются плоды перед уборкой урожая для ускорения созревания.
Источник
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Сырье для полиэтилена и не только
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. Выход этилена – около 30%. Одновременно образуется пропилен и ряд жидких продуктов (в том числе ароматических углеводородов).
При хлорировании этилена получается 1,2-дихлорэтан, гидратация приводит к этиловому спирту, взаимодействие с HCl – к этилхлориду. При окислении этилена кислородом воздуха в присутствии катализатора образуется окись этилена. При жидкофазном каталитическом окислении кислородом получается ацетальдегид, в тех же условиях в присутствии уксусной кислоты – винилацетат. Этилен является алкилирующим агентом , например, в условиях реакции Фриделя-Крафтса способен алкилировать бензол и другие ароматические соединения. Этилен способен полимеризоваться в присутствии катализаторов как самостоятельно, так и выступать в роли сомономера, образуя обширный ряд полимеров с различными свойствами.
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
В высоких концентрациях этилен оказывает на человека и животных наркотическое действие.
Источник
Продолжение. Начало см. в № 9/2009.
Л е к ц и я 3.
Непредельные углеводороды ряда этилена, общая
формула состава. Электронное и пространственное
строение, химические свойства этилена
Непредельные углеводороды ряда этилена, или
алкены, – это углеводороды с общей формулой CnH2n,
молекулы которых содержат одну двойную связь.
Атомы C, связанные двойной связью, находятся в
состоянии sp2-гибридизации, двойная
связь является сочетанием – и -связей. По своей природе -связь резко отличается от -связи; -связь менее прочная
вследствие перекрывания электронных облаков вне
плоскости молекулы.
Простейшим алкеном является этилен.
Структурная и электронная формулы этилена имеют
вид:
В молекуле этилена подвергаются гибридизации
одна s– и две p-орбитали атомов C (sp2-гибридизация).
Таким образом, каждый атом C имеет по три
гибридных орбитали и по одной негибридной p-орбитали.
Две из гибридных орбиталей атомов C взаимно
перекрываются и образуют между атомами C -связь. Остальные
четыре гибридных орбитали атомов C перекрываются
в той же плоскости с четырьмя s-орбиталями
атомов H и также образуют четыре -связи. Две негибридные p-орбитали
атомов C взаимно перекрываются в плоскости,
которая расположена перпендикулярно плоскости -связей, т.е.
образуется одна -связь.
Под действием реагентов -связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов
расположены в одной плоскости и валентные углы
близки к 120°; расстояние между центрами атомов C
равно 0,134 нм.
Если атомы соединены двойной связью, то их
вращение невозможно без того, чтобы электронные
облака -связи не
разомкнулись.
Этилен – первый член гомологического ряда
алкенов.
Но молекула бутена-2 может находиться в виде
двух пространственных форм – цис- и транс-:
Цис- и трансизомеры, имея различное
расположение атомов в пространстве, отличаются
многими физическими и химическими свойствами.
Таким образом, для алкенов возможны два вида структурной
изомерии: изомерия углеродной цепи и изомерия
положения двойной связи. Возможна также геометрическая
изомерия.
Этилен (этен) – бесцветный газ с очень слабым
сладковатым запахом, немного легче воздуха,
малорастворим в воде.
По химическим свойствам этилен резко
отличается от этана, что обусловлено электронным
строением его молекулы. Имея в молекуле двойную
связь, состоящую из – и -связей,
этилен способен присоединять два одновалентных
атома или радикала за счет разрыва -связи.
• Способность к реакциям присоединения
характерна для всех алкенов.
1. Присоединение водорода (реакция
гидрирования):
2. Присоединение галогенов (реакция
галогенирования):
При добавлении к алкену брома (в виде бромной
воды) бурая окраска брома быстро исчезает. Эта
реакция является качественной на двойную связь.
3. Присоединение галогеноводородов
(реакция гидрогалогенирования):
Если исходный алкен несимметричен, то реакция
протекает по правилу Марковникова.
Присоединение галогеноводородов к
непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция
гидратации):
Этой реакцией пользуются для получения
этилового спирта в промышленности.
• Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной
температуре, например при действии перманганата
калия. Если этилен пропускать через водный
раствор перманганата калия KMnO4, то
характерная фиолетовая окраска последнего
исчезает, происходит окисление этилена (реакция
гидроксилирования) перманганатом калия
(качественная реакция на двойную связь):
2. Этилен горит светящимся пламенем с
образованием оксида углерода(IV) и воды:
C2H4 + 3O2 —> 2CO2 + 2H2O.
3. Большое промышленное значение имеет
частичное окисление этилена кислородом воздуха:
• Для этилена, как и для всех непредельных
углеводородов, характерны реакции полимеризации.
Они протекают при повышенной температуре,
давлении и в присутствии катализаторов:
Полимеризация – это последовательное
соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов
характерны реакции присоединения, окисления и
полимеризации.
Л е к ц и я 4.
Ацетилен – представитель углеводородов с
тройной связью в молекуле.
Химические свойства, получение и применение
ацетилена в органическом синтезе
Алкины – это углеводороды с общей
формулой CnH2n–2, молекулы
которых содержат одну тройную связь.
Ацетилен – первый член гомологического
ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2.
Структурная формула ацетилена H–C=C–H.
Электронная формула:
H : С : : : С : Н.
Углеродные атомы ацетилена, связанные тройной
связью, находятся в состоянии sp-гибридизации.
При образовании молекулы ацетилена у каждого
атома С гибридизуются по одной s– и p-орбитали.
В результате этого каждый атом С приобретает по
две гибридных орбитали, а две p-орбитали
остаются негибридными. Две гибридных орбитали
взаимно перекрываются, и между атомами С
образуется -связь.
Остальные две гибридных орбитали перекрываются
с s-орбиталями атомов H, и между ними и атомами
С тоже образуются -связи. Четыре негибридных p-орбитали
размещены взаимно перпендикулярно и
перпендикулярно направлениям -связей. В этих плоскостях p-орбитали
взаимно перекрываются, и образуются две -связи, которые
относительно непрочные и в химических реакциях
легко разрываются.
Таким образом, в молекуле ацетилена имеются три
-связи (одна
связь C–C и две связи C–H) и две -связи между двумя С атомами.
Тройная связь в алкинах – не утроенная
простая, а комбинированная, состоящая из трех
связей: одной –
и двух -связей.
Молекула ацетилена имеет линейное строение.
Появление третьей связи вызывает дальнейшее
сближение атомов С: расстояние между их центрами
составляет 0,120 нм.
Физические свойства. Ацетилен –
бесцветный газ, легче воздуха, мало растворим в
воде, в чистом виде почти без запаха.
Химические свойства. По химическим
свойствам ацетилен во многом аналогичен этилену.
Для него характерны реакции присоединения,
окисления и полимеризации.
• Реакции присоединения. Алкины
присоединяют не одну, а две молекулы реагента.
Тройная связь вначале переходит в двойную, а
затем – в простую связь (-связь).
1. Присоединение водорода (реакция
гидрирования) происходит при нагревании в
присутствии катализатора. Реакция протекает в
две стадии, сначала образуется этилен, а
затем – этан:
2. Присоединение галогенов (реакция
галогенирования) протекает очень легко (также в
две стадии):
Бромная вода при этом обесцвечивается.
Обесцвечивание бромной воды служит качественной
реакцией на ацетилен, как и на все непредельные
углеводороды.
3. Присоединение галогеноводородов (реакция
гидрогалогенирования). Важное значение имеет
реакция присоединения хлороводорода:
Из винилхлорида получают полимер –
поливинилхлорид.
4. Присоединение воды (реакция
гидратации) протекает в присутствии солей
ртути(II) – HgSO4, Hg(NO3)2 – с
образованием уксусного альдегида:
Эта реакция носит имя русского ученого Михаила
Григорьевича Кучерова (1881).
• Реакции окисления. Ацетилен очень
чувствителен к окислителям.
1. При пропускании через раствор
перманганата калия ацетилен легко окисляется, а
раствор KMnO4 обесцвечивается:
Обесцвечивание перманганата калия может быть
использовано как качественная реакция на
тройную связь.
При окислении обычно происходит расщепление
тройной связи и образуются карбоновые кислоты:
R–C=C–R’ + 3[O] + H2O —> R–COOH
+ R’–COOH.
Ацетилен при полном сгорании образует оксид
углерода(IV) и воду:
2C2H2 + 5O2 —> 4CO2 +
2H2O.
На воздухе ацетилен горит сильно коптящим
пламенем.
• Реакции полимеризации. В
определенных условиях ацетилен способен
полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над
активированным углем при 450–500 °С происходит
тримеризация ацетилена с образованием бензола
(Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl
ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной
способностью; присоединяя хлороводород, он
образует хлоропрен, используемый для получения
искусственного каучука:
Получение ацетилена. В лаборатории и в
промышленности ацетилен получают
взаимодействием карбида кальция с водой
(карбидный способ):
Карбид кальция получают в электропечах при
нагревании кокса с негашеной известью:
На получение CaC2 затрачивается много
электроэнергии, поэтому карбидный метод не может
удовлетворить потребности в ацетилене.
В промышленности ацетилен получают в
результате высокотемпературного крекинга
метана:
Применение ацетилена в органическом синтезе.
Ацетилен широко применяют в органическом
синтезе. Он является одним из исходных веществ
при производстве синтетических каучуков,
поливинилхлорида и других полимеров. Из
ацетилена получают уксусную кислоту,
растворители (1,1,2,2-тетрахлорэтан и
1,1,2-трихлорэтен). При сжигании ацетилена в
кислороде температура пламени достигает
3150 °С, поэтому его используют при сварке и
резке металлов.
Примеры промышленного использования
ацетилена:
Л е к ц и я 5.
Диеновые углеводороды, их строение, свойства,
получение и практическое значение
Диеновые углеводороды, или алкадиены, – это
углеводороды, содержащие в углеродной цепи две
двойные связи. Их состав может быть выражен общей
формулой CnH2n–2. Они изомерны
ацетиленовым углеводородам.
Большое применение имеют алкадиены, в
молекулах которых двойные связи разделены
простой связью (сопряженные двойные связи) –
это
которые являются исходными веществами для
получения каучуков.
Для образования двух двойных связей в одной
молекуле необходимо по крайней мере три атома С.
Простейшим представителем алкадиенов является
пропадиен CH2=C=CH2.
Диеновые углеводороды могут различаться
положением двойной связи в углеродной цепи:
Также возможна изомерия углеродной цепи.
Бутадиен-1,3 является простейшим сопряженным
алкадиеном. В бутадиене-1,3 все четыре атома С
находятся в состоянии sp2-гибридизации.
Они лежат в одной плоскости и образуют скелет
молекулы. Негибридные p-орбитали каждого
атома С перпендикулярны плоскости скелета и
параллельны друг другу, что создает условия для
их взаимного перекрывания. Перекрывание
происходит не только между атомами С1–С2,
С3–С4, но и частично между атомами С2–С3.
При перекрывании четырех p-орбиталей
происходит образование единого -электронного облака, т.е.
сопряжение двух двойных связей (, -сопряжение).
Физические свойства. Бутадиен-1,3 при
нормальных условиях – газ, который сжижается
при t = 4,5 °С; 2-метилбутадиен-1,3 – летучая
жидкость, кипящая при t = 34,1 °С.
Химические свойства. Диеновые углеводороды
с сопряженными двойными связями обладают
высокой химической активностью.
• Они легко вступают в реакции присоединения,
реагируя с водородом, галогенами,
галогеноводородами и т.д.
Обычно присоединение происходит по концам
молекул диенов. Так, при взаимодействии с бромом
двойные связи разрываются, к крайним атомам С
присоединяются атомы брома, а свободные
валентности образуют двойную связь, т.е. в
результате присоединения происходит
перемещение двойной связи:
При избытке брома может быть присоединена еще
одна его молекула по месту оставшейся двойной
связи.
У алкадиенов реакции присоединения могут
протекать по двум направлениям:
1) по месту разрыва одной двойной связи
(1,2-присоединение):
2) с присоединением к концам молекулы и разрывом
двух двойных связей (1,4-присоединение):
Преимущественное протекание реакции по тому
или иному пути зависит от конкретных условий.
• Вследствие наличия двойных связей диеновые
углеводороды довольно легко полимеризуются.
Продуктом полимеризации 2-метилбутадиена-1,3
(изопрена) является полиизопрен – аналог
натурального каучука:
Получение. Каталитический способ получения
бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем
Васильевичем Лебедевым. По способу Лебедева
бутадиен-1,3 получается в результате
одновременного дегидрирования и дегидратации
этанола в присутствии катализаторов на основе ZnO
и Al2O3:
Но более перспективным методом получения
бутадиена является дегидрирование бутана,
содержащегося в нефтяных газах. При t = 600 °С
происходит ступенчатое дегидрирование бутана
при наличии катализатора:
Каталитическим дегидрированием изопентана
получается изопрен:
Практическое значение. Диеновые
углеводороды в основном применяются для синтеза
каучуков:
Реакция полимеризации бутадиена-1,3:
Печатается с
продолжением
Л.И.ПОПОВА,
учитель химии
(г. Новоуральск, Свердловская обл.)
Источник
