Какими химическими свойствами обладает углерод
Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия углерода
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Углерод в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома углерода
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
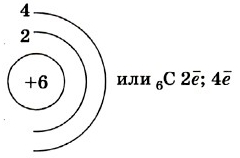
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства углерода
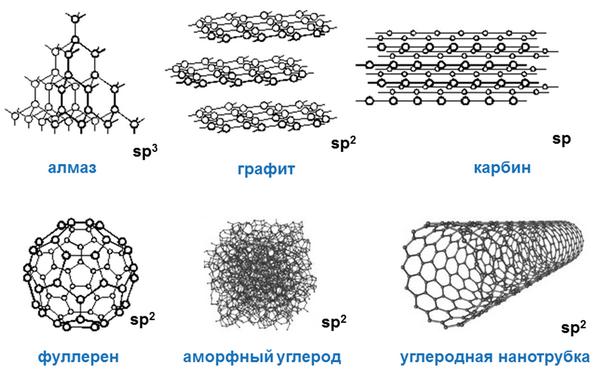
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства углерода
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
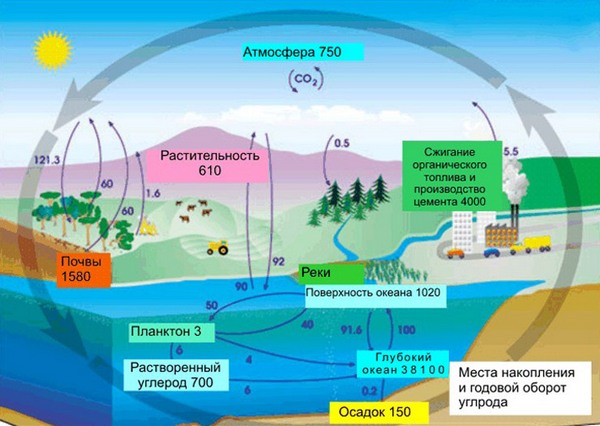
Углерод в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
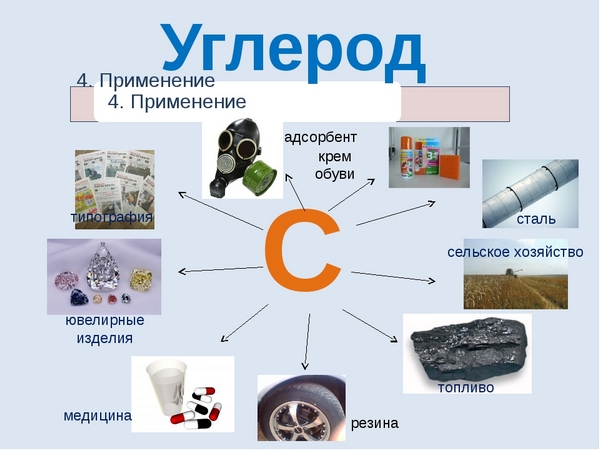
Применение углерода
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Углерод, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Источник
Углерод
Углерод – неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец – металлы.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C – 2s22p2
- Si – 3s23p2
- Ge – 4s24p2
- Sn – 5s25p2
- Pb – 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций – графит, алмаз, фуллерен
- MgCO3 – магнезит
- CaCO3 – кальцит (мел, мрамор)
- CaCO3*MgCO3 – доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз – нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ – продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ – продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод – хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца – крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II – СO
Оксид углерода II – продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов – чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV – CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние – карбонаты (при избытке основания),
кислые – гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание – кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание – кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается “закипанием” – появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа –
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) – кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 – ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты – на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
