Какими химическими свойствами обладает вода
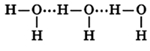
Оксид водорода (H2O), гораздо более известный всем нам под названием “вода”, без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом – в виде льда, в жикдом, собственно вода, в газообразном – в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. – это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода – хороший растворитель.
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода – положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры – чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода “охотно” вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑ - с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества – в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества – в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды – такой “слоеный пирог” называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Источник
СОДЕРЖАНИЕ:
- Строение молекулы воды
- Какие связи имеет H2O?
- Физические свойства H2O
- Химические свойства H2O
- Круговорот воды в природе
- Почему не кончается вода на Земле?
- Виды воды
СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ
Молекула представляет собой совокупность атомных ядер и электронов , что является достаточно устойчивым , чтобы обладать наблюдаемыми свойствами — и есть несколько молекул , которые являются более стабильными и трудно разлагаются , чем H 2 O.
В воде, каждое ядро водорода связаны с центральным атомом кислорода парой электронов, которые делятся между ними. Химики называют эту общую электронную пару ковалентной химической связью. В H 2О, только два из шести электронов кислорода внешней оболочки используются для этой цели, оставляя четыре электрона, которые организованы в две несвязывающие пары.
Четыре электронные пары, окружающие кислород, имеют тенденцию располагаться как можно дальше друг от друга, чтобы минимизировать отталкивания между этими облаками отрицательного заряда. Это обычно приводит к тетраэдрической геометрии, в которой угол между электронными парами (и, следовательно, угол связи HOH ) составляет 109,5 °.
Однако, поскольку две несвязывающие пары остаются ближе к атому кислорода, они оказывают более сильное отталкивание на две пары ковалентных связей, эффективно сближая два атома водорода. Результатом является искаженное тетраэдрическое расположение, в котором угол Н-О-Н составляет 104,5 °.
Хотя молекула воды не несет чистого электрического заряда, ее восемь электронов распределены неравномерно. Немного более отрицательный заряд (фиолетовый) на кислородном конце молекулы и компенсирующий положительный заряд (зеленый) на водородном конце. Получающаяся полярность в значительной степени ответственна за уникальные свойства воды.
Поскольку молекулы меньше световых волн, их нельзя наблюдать непосредственно, и их необходимо «визуализировать» альтернативными способами. Внешняя оболочка показывает эффективную «поверхность» молекулы, определяемую протяженностью облака отрицательного электрического заряда, созданного восемью электронами.
КАКИЕ СВЯЗИ ИМЕЕТ H2O2
Молекула H 2 O электрически нейтральна, но положительные и отрицательные заряды распределены неравномерно. Это иллюстрируется градацией цвета на схематической диаграмме здесь. Электронный (отрицательный) заряд концентрируется на кислородном конце молекулы, отчасти благодаря несвязывающимся электронам (сплошные синие кружки) и высокому заряду ядра кислорода, который оказывает сильное притяжение на электроны.
Это смещение заряда представляет собой электрический диполь , представленный стрелкой внизу; Вы можете думать об этом диполе как о электрическом «образе» молекулы воды.
Как все мы узнали в школе, противоположные заряды притягиваются, поэтому частично положительный атом водорода на одной молекуле воды электростатически притягивается к частично отрицательному кислороду на соседней молекуле. Этот процесс называется (несколько обманчиво) водородной связью.
Обратите внимание, что водородная связь длиннее, чем ковалентная связь О-Н. Это означает, что он значительно слабее. На самом деле он настолько слаб, что данная водородная связь не может существовать дольше, чем крошечная доля секунды.
ФИЗИЧЕСКИЕ СВОЙСТВА H2O2
Давно известно, что вода обладает многими физическими свойствами, которые отличают ее от других небольших молекул сопоставимой массы. Химики называют их «аномальными» свойствами воды, но они ни в коем случае не являются загадочными. Все они являются полностью предсказуемыми последствиями того, как размер и заряд ядра атома кислорода способствуют искажению облаков электронного заряда атомов других элементов, когда они химически связаны с кислородом. Вода является одним из немногих известных веществ, чья твердая форма менее плотная, чем жидкость.
Расширение между –4 ° и 0 ° обусловлено образованием более крупных агрегатов с водородными связями. Выше 4 ° начинается тепловое расширение, поскольку колебания связей О — Н становятся более энергичными, что приводит к выталкиванию молекул дальше друг от друга.
Другое широко цитируемое аномальное свойство воды — ее высокая температура кипения. Как показывает этот график, молекула, столь же легкая, как H 2 O, «должна» кипеть при температуре около –90 ° C. То есть, он существовал бы в мире в виде газа, а не жидкости, если бы не было водородных связей. Обратите внимание, что Н-связь также наблюдается с фтором и азотом.
ХИМИЧЕСКИЕ СВОЙСТВА H2O2
Соленость воды может быть определена как концентрация всех катионов, в значительной степени Na + , K + , Mg ++ и Ca ++, а также анионов CO 3 = и SO 4 = и галогенидов, причем все HCO 3 — превращаются в CO = 3. Приведенный выше средний состав пресной воды соответствует среднему речному водоснабжению. В мягких водах Ca ++ и CO = 3 могут быть значительно снижены. В кислых водах сульфат может быть доминирующим.
КРУГОВОРОТ ВОДЫ В ПРИРОДЕ
Что происходит в естественном круговороте воды?
В естественном круговороте воды используются физические процессы для перемещения воды с поверхности земли в атмосферу и обратно.
Испарение — это когда солнце светит на воду и нагревает ее, превращая в газ, называемый водяным паром, который поднимается в воздух.
Транспирация — это когда солнце согревает людей, растения и животных, и они выпускают водяной пар в воздух.
Конденсация — это когда водяной пар в воздухе охлаждается и превращается в жидкость, образуя крошечные капельки воды в небе.
Осадки — это когда капли воды падают с неба в виде дождя, снега или града.
Сток — это когда вода течет по земле и впадает в ручьи, реки и океаны.
Инфильтрация — это когда вода падает на землю и впитывается в почву.
Перколяция — это когда вода все глубже проникает в крошечные места в почве и камне.
ПОЧЕМУ НЕ КОНЧАЕТСЯ ВОДА НА ЗЕМЛЕ
Земля содержит огромное количество воды:
- в океанах;
- озерах;
- реках;
- атмосфере;
- в скалах внутренней Земли.
В течение миллионов лет большая часть этой воды рециркулируется между внутренней Землей, океанами и реками и атмосферой. Этот циклический процесс означает, что пресная вода постоянно поступает на поверхность Земли, где мы все живем.
Вулканы выпускают огромное количество воды из внутренней Земли в атмосферу.
Наша планета также очень эффективно удерживает эту воду. Вода, будучи паром в нашей атмосфере, потенциально может сбежать в космос с Земли. Но вода не вытекает, потому что некоторые области атмосферы очень холодные. (Например, на высоте 15 километров температура атмосферы составляет всего -60 ° С!). При этой холодной температуре вода образует твердые кристаллы, которые падают обратно на поверхность Земли.
Хотя на нашей планете в целом никогда не кончится вода, важно помнить, что чистая пресная вода не всегда доступна там, где и когда она нужна людям. Фактически, половина пресной воды в мире может быть найдена только в шести странах. Более миллиарда человек живут без достаточного количества чистой воды.
Кроме того, каждая капля воды, которую мы используем, продолжается в круговороте воды. Вещи, которые мы кладем в канализацию, попадают в чью-то воду. Мы можем помочь защитить качество пресной воды на нашей планете, используя ее более разумно.
ВИДЫ ВОДЫ
«Чистая вода»
Для химика термин «чистый» имеет значение только в контексте конкретного применения или процесса. Дистиллированная или деионизированная вода, которую мы используем в лаборатории, содержит растворенные атмосферные газы и иногда немного кремнезема, но их небольшое количество и относительная инертность делают эти примеси незначительными для большинства целей.
Когда для определенных типов точных измерений требуется вода с наивысшей достижимой чистотой, ее обычно фильтруют, деионизируют и подвергают тройной вакуумной дистилляции. Но даже эта «химически чистая» вода представляет собой смесь изотопных частиц: есть два стабильных изотопа водорода (H 1 и H 2 , последний часто обозначается как D) и кислорода (O 16 и O 18 ), которые вызывают комбинации, такие как H 2O 18 , HDO 16 и т. Д. Они легко идентифицируются в инфракрасных спектрах водяного пара.
И вдобавок ко всему, два атома водорода в воде содержат протоны, магнитные моменты которых могут быть параллельными или антипараллельными, что приводит к орто- и пара- воде соответственно. Две формы обычно присутствуют в соотношении о / п 3: 1.
Количество редких изотопов кислорода и водорода в воде достаточно разнится от места к месту, поэтому теперь можно с некоторой точностью определить возраст и источник конкретного образца воды. Эти различия отражены в изотопных профилях H и O организмов. Таким образом, изотопный анализ волос человека может быть полезным инструментом для расследования преступлений и антропологических исследований.
Питьевая вода
Наша обычная питьевая вода, напротив, никогда не бывает химически чистой, особенно если она контактировала с отложениями. Подземные воды (из родников или колодцев) всегда содержат ионы кальция и магния, а также часто железо и марганец; положительные заряды этих ионов уравновешиваются отрицательными ионами карбонат / бикарбонат, а иногда и некоторым количеством хлорида и сульфата. В некоторых регионах подземные воды содержат недопустимо высокие концентрации естественных токсичных элементов, таких как селен и мышьяк.
Можно подумать, что дождь или снег будут освобождены от загрязнения, но когда водяной пар конденсируется из атмосферы, это всегда происходит на частице пыли, которая выделяет вещества в воду, и даже самый чистый воздух содержит углекислый газ, который растворяется с образованием углекислота За исключением сильно загрязненных атмосфер, примеси, улавливаемые снегом и дождем, слишком малы, чтобы вызывать беспокойство.
Различные правительства установили верхние пределы количества загрязняющих веществ, допустимых в питьевой воде; самые известные из них — Стандарты питьевой воды EPA США.
Безионная вода
Иногда можно услышать, что не содержащая минералов вода и особенно дистиллированная вода вредны для здоровья, потому что они «вымывают» необходимые минералы из организма. Дело в том, что минеральные ионы не проходят через клеточные стенки при обычной осмотической диффузии, а скорее переносятся метаболическими процессами.
Обширное исследование 2008 года не подтвердило более ранние сообщения о том, что низкий уровень кальция / магния в питьевой воде коррелирует с сердечно-сосудистыми заболеваниями. Любая сбалансированная диета должна содержать все необходимые нам минеральные вещества.
Хорошо известно, что люди, которые занимаются тяжелой физической активностью или находятся в очень жаркой среде, должны избегать употребления большого количества даже обычной воды. Чтобы предотвратить серьезные проблемы с электролитным дисбалансом, необходимо компенсировать потери солей при потливости. Это может быть достигнуто путем приема соленых продуктов или напитков (включая «спортивные напитки») или соленых таблеток.
Статью проверил и отредактировал Papa Vlada.
Первоисточник статьи опубликован на сайте про воду.
Источник
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть. Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования). Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение. Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической. Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть). Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой. Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость. И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна. Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты. Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов. Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
Источник
