Какими химическими свойствами обладают галогены

Химические свойства галогенов
Ключевые слова конспекта: химические свойства галогенов, реакция галогенов с металлами, реакции с неметаллами, реакции галогенов с водой, со щелочами, с солями-галогенидами.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
1. Реакция с металлами.
Галогены реагируют практически со всеми металлами (кроме благородных металлов) с образованием галогенидов. Например, натрий горит в хлоре: 2Na + Cl2 = 2NaCl
Со фтором реакции идут очень бурно, с йодом – только при нагревании, часто требуется вода как катализатор.
Окислительная активность галогенов снижается от фтора к йоду. Это можно продемонстрировать на примере окисления железа (обратите внимание на его степень окисления в галогенидах):
В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В реакции с йодом I2 при температуре 500 °С образуется Fel2:
Фтор, хлор и бром окисляют железо глубже (до Fe3+), чем йод.
2. Реакции с неметаллами.
Окислительную способность галогенов можно сопоставить и в реакциях с неметаллами. Галогены реагируют со многими неметаллами (исключением являются благородные газы, азот N2, кислород O2).
Галогены реагируют с водородом, при этом условия проведения реакции зависят от того, с каким из галогенов проводится реакция:
Со фтором реакция может начинаться даже при t° = –250 °С, с хлором реакция идёт при сгорании водорода в хлоре или даже при комнатной t° на свету. С бромом и йодом реакция идёт при температуре 350–500 °С или при наличии катализатора платины Pt. Реакция образования йодоводорода HI обратима. Таким образом, по мере увеличения относительной молекулярной массы галогена от фтора F2 к иоду I2 условия проведения реакции должны быть более жёсткими.
Галогены реагируют с серой. Фтор взаимодействует с серой даже при температуре жидкого воздуха, окисляя её до высшей степени окисления:![]()
Реакция серы с хлором приводит к образованию либо SCl2, либо S2Cl2:
Обратите внимание: здесь встретилась сравнительно редкая для серы степень окисления +2.
С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора.
Галогены реагируют с фосфором. Красный и белый фосфор уже при комнатной температуре самовоспламеняется во фторе и хлоре, реагирует с жидким бромом. При этом в реакции со фтором происходит более глубокое окисление фосфора:
В реакциях фосфора с хлором и бромом могут образоваться РCl3 и РВг3, но по мере повышения температуры в результате окисления фосфора глубина окисления возрастает – образуются РCl5 и РВг5.
Фтор реагирует с графитом при температуре выше 900 °С:
Остальные галогены не реагируют с простыми веществами, образованными углеродом (алмазом, графитом).
3. Реакции с водой.
Рассмотрим реакции галогенов со сложными веществами. Галогены взаимодействуют с водой. При этом фтор окисляет кислород воды. Пары воды горят в атмосфере F2:
Хлор обратимо реагирует с водой, но при этом не происходит окисление кислорода. В этой реакции хлор сам является как окислителем, так и восстановителем (такие реакции называют реакциями диспропорционирования):
4. Реакции со щелочами.
Хлор, бром и йод реагируют со щелочами, в ходе реакции хлор является и окислителем, и восстановителем:
5. Реакции галогенов с солями-галогенидами.
Галогены способны вытеснять друг друга из солей-галогенидов и из галогеноводородов. Фтор F2 вытесняет все остальные галогены из галогеноводородов и галогенидов (в растворах параллельно идёт реакция окисления воды). Хлор Cl2 вытесняет бром и йод из НВг, бромидов, HI и иодидов. Бром Вг2 вытесняет йод из йодидов и йодоводорода. Йод I2 не вытесняет другие галогены:
![]()
Признаком данной реакции в растворе является изменение окраски с бесцветной на жёлтую.



Конспект урока по химии «Химические свойства галогенов». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
Источник
Галогены (греч. hals – соль + genes – рождающий) – химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством
других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

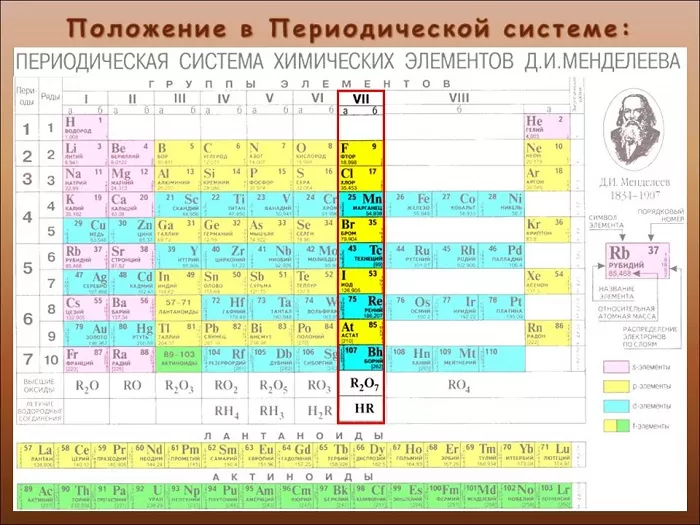
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F – 2s22p5
- Cl – 3s23p5
- Br – 4s24p5
- I – 5s25p5
- At – 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов
в возбужденном состоянии.

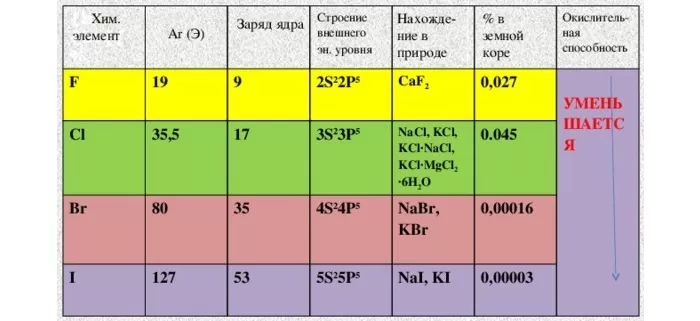
Природные соединения
- NaCl – галит (каменная соль)
- CaF2 – флюорит, плавиковый шпат
- NaCl*KCl – сильвинит
- 3Ca3(PO4)2*CaF2 – фторапатит
- MgCl2*6H2O – бишофит
- KCl*MgCl2*6H2O – карналлит

Простые вещества – F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте – HF – был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром – F-)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод – Br-)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду – смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами – только при
нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF – фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl – хлороводород (газ), соляная кислота (жидкость)
- HBr – бромоводород, бромоводородная кислота
- HI – йодоводород, йодоводородная кислота
- HAt – астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI – газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF – является слабой кислотой, HCl, HBr, HI – сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить
водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)

Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HCl + H2SO4 → Cl2 + SO2 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
Приведём примеры:
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов

С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Зато точно известен общий принцип построения наружного энергетического уровня: ns2np5. Под «n» понимается период расположения элемента.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
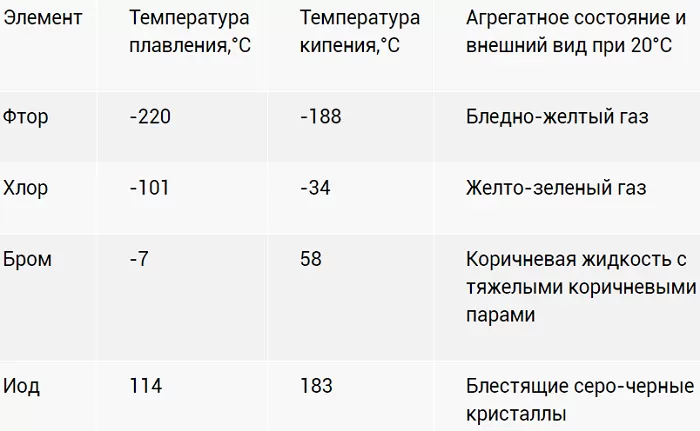
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Галогены (Hal) – мощные окислители, а фтор агрессивен настолько, что вступает в реакцию с собратьями. Происходит это при подогреве. Степень окисления «пострадавших» оказывается +1.
Общее уравнение:
![]()
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
![]()
Остальные элементы ряда не взаимодействуют с:
O;
N;
С (в модификации алмаза);
Pt, Au;
Xe, Kr.
С неметаллами
Водород окисляет фтор при любых условиях, со взрывом. Cl с подсветкой УФ или подогревом. Но тоже громко. Остальные только с нагреванием. Но уравнение едино:
![]()
С фосфором взаимодействуют совершенно по-разному:
∗ F до получения пентафторида. Единственный, без нагревания:
![]()
∗ хлор и бром, в зависимости от концентрации:
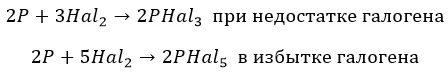
∗ йод – недостаточно мощный окислитель:
![]()
∗ с серой также не все очевидно. Но только не с фтором. Окисление максимально, но с нагревом:
![]()
∗ бром и хлор реагируют нетипично и «неохотно»:
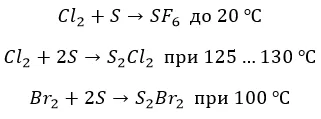
С металлами
Перед фтором ничто не устоит. Даже благородный класс, хоть и с нагревом:
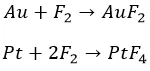
Остальные металлы прочим галогенам по силам. Не без подогрева:
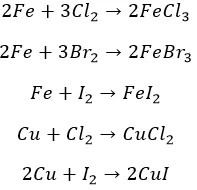
Реакции замещения
Агрессивные вытесняют «тяжелых» соседей по группе:
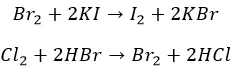
И с неметаллами не церемонятся:
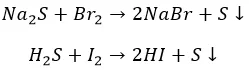
Хлор, как более активный, ведет себя несколько по-другому:
![]()
С водой
Фтор в своем репертуаре. Вода будет пылать синим пламенем и норовить плюнуть плавиковой кислотой:
![]()
Хлор с бромом гораздо спокойнее. Да и процессы нестабильны, обратимы:
![]()
Йод с водой в видимые взаимодействия не вступает.
С растворами щелочей
И в этом случае фтор проявляется как резкий окислитель:
![]()
Остальные ведут себя, как с водой. Но процесс при разных температурах проходит по разным сценариям:
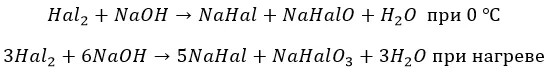
Йод реагирует только по второму варианту.
Получение
Выделить вещество настолько активное, что норовит прореагировать со всем окружающим, не так просто.
Фтор
Обычно получают из сложных солей. При интенсивном нагреве (термолиз) провоцируется распад на более простые и нужный газ.

Или электролизом KF*3HF. Аналогичный метод применяется в промышленности.
Хлор
Из соляной кислоты. Неприятно и опасно даже в условиях лаборатории:
![]()
Индустриально добывают из распространенной поваренной соли при помощи электролиза:
![]()
Бром и йод
«На коленке» – из солей. Окислителями, в кислом же окружении:
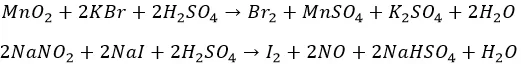
Химзаводам за сырьем ходить не надо. Морская вода, скважные жидкости. Остатки сожженных океанских/морских водорослей – настоящая йодная руда.
Применение галогенов
Как уже упоминалось, фтор применяется в лечебных и профилактических средствах. Соединения необходимы для изготовления алюминия.

Основная часть производимого хлора используется для синтеза соляной кислоты. Необходим в химической индустрии. Для сельскохозяйственных, бытовых ядохимикатов, чистящих средств, отбеливателей. Для очистителей воды.
Бром и йод применяются для медикаментов и в химической отрасли.
Заключение
О свойствах галогенов можно писать бесконечно. В данной статье не затрагивались темы взаимодействий с органическими веществами, например.
А ведь без них невозможен, скажем, фотосинтез. Одна из основ жизни. Без соляной кислоты невозможно пищеварение высших животных. Об этом мы расскажем в следующих публикациях.
Источник
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом. Молекулы галогенов двухатомны: F2, Cl2, Br2, I2.
Химические свойства галогенов
С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
Br2 + 2HI = I2 + 2HBr;
Cl2 + 2KBr = Br2 + 2KCl.
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H2O + 2F2 = 4HF + O2↑.
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
2Fe + Cl2 = 2FeCl3;
2P + 5Cl2 = 2PCl5.
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl2 + H2O↔HCl +HClO.
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O.
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl2 + 6KOH = 5KCl +KClO3+3H2O.
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Физические свойства галогенов
При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом. Ядовит. Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорошо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав).
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O;
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7H2O;
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8H2O +2KCl.
Применение галогенов
Галогены используют в качестве сырья для получения различных продуктов. Так, фтор и хлор используют для синтеза различных полимерных материалов, хлор также является сырьем при производстве соляной кислоты. Бром и йод нашли широкое применение в медицине, бром также используется лакокрасочной промышленности.
Примеры решения задач
Источник
