Какими химическими свойствами обладают этилен и его гомологи

АЛКЕНЫ
Углеводородами ряда этилена, или
этиленовыми углеводородами (олефинами
или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной
двойной связи между углеродными атомами, т.е. – группировки
>C=C<.
Этиленовые углеводороды образуют
гомологический ряд, состав каждого члена которого выражается общей эмпирической
формулой CnH2n.
Родоначальником этого ряда является углеводород этилен состава С2Н4,
строение которого может быть представлено следующей структурной и упрощенной
структурной формулами:

Гомологический
рядалкенов
СnH2n алкен | Названия, |
C2Н4 | этен, этилен |
C3H6 | пропен |
C4H8 | бутен |
C5H10 | пентен |
C6H12 | гексен |
Тренажёр – Гомологический ряд этилена
Физические
свойства
С2 – С4 (газы)
С5 – С18 (жидкости)
С19 … – (твёрдые)
- Алкены не
растворяются в воде, растворимы в органических растворителях (бензин,
бензол и др.) - Легче воды
- С увеличением Mr температуры плавления и кипения
увеличиваются - ЭТИЛЕН – в природе этилен
практически не встречается. Это бесцветный горючий газ со слабым запахом.
Химические
свойства
В отличие от насыщенных углеводородов
для углеводородов ряда этилена характерны разнообразные реакции присоединения по месту двойной связи; при этом они
значительно легче вступают во взаимодействие с различными реагентами.

Благодаря двойной связи
молекулы алкенов могут соединяться между собой, т.е. полимеризоваться.
Как и предельные
углеводороды, алкены горят на воздухе:
C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя
ярко светящее)
Применение
Этилен является
одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек
синтеза. Основное направление использования этилена — в качестве мономера
при получении полиэтилена

Этилен – исходное соединение для получения полиэтилена
высокого и низкого давления и олигомеров этилена, являющихся основой ряда
синтетических смазочных масел.

Этилен применяют
как исходный материал для производства ацетальдегида и синтетического
этилового спирта. Также он используется для синтеза этилацетата, стирола,
винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого
этила.

Этилен
используют для ускорения созревания плодов — например, помидоров, дынь,
апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения
предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к
материнским растениям, что облегчает механизированную уборку урожая.

АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные)
углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2.
Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H.
Алкины – это
непредельные углеводороды с одной тройной углерод-углеродной связью в цепи и
общей формулой СnH2n-2
Физические
свойства
С2Н2 – газ без
цвета и почти без запаха, технический ацетилен обладает неприятным запахом,
легче воздуха, мало растворим в воде
Свойства гомологов изменяются аналогично
алкенам.
Получение в лаборатории: из карбида
кальция гидролизом (взаимодействие с водой)
CaC2 + 2H2O →
Ca(OH)2 + H-C≡C-H
Получение в промышленности:термическим разложением метана (пиролиз)
2CH4 1500˚С→ HC≡CH + 3H2
Применение
Из всех ацетиленовых углеводородов
серьёзное промышленное значение имеет только ацетилен, который является
важнейшим химическим сырьём. При горении ацетилена выделяется много
тепла, что используется для резки и сварки металлов в ацетилен-кислородной
сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века
широкой популярностью пользовались многочисленные ацетиленовые светильники
(источником ацетилена служил дешевый карбид кальция), используемые на
железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на
то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их
выпуск и потребление не прекратились. Они производятся в небольших количествах
как походное снаряжение
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Диеновые углеводороды или алкадиены – это
непредельные углеводороды, содержащие две двойные углерод – углеродные связи.
Общая формула алкадиенов CnH2n-2.Наибольший интерес представляют
углеводороды с сопряженными двойными связями, их используют для производства
синтетических каучуков.
Бутадиен -1,3 – легко сжижающийся газ, с неприятным
запахом

Изопрен – легкокипящая жидкость

Наиболее массовое применение
каучуков — это производство резин для автомобильных, авиационных и
велосипедных шин.
Из каучуков изготавливаются специальные
резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо-
гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной
технике, в гидравлической, пневматической и вакуумной технике.


Каучуки применяют для электроизоляции,
производства медицинских приборов.
ЦИКЛОАЛКАНЫ
(ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов,
характеризующихся наличием открытых углеродных цепей, существуют углеводороды с
замкнутыми цепями (циклами). По своим свойствам они напоминают обычные
предельные углеводороды алканы (парафины), отсюда и произошло их название –
циклоалканы (циклопарафины). Общая формула гомологического ряда циклоалканов CnH2n,
то есть циклоалканы изомерны этиленовым углеводородам. В природе встречаются в
составе нефти.
Представителями этого ряда соединений
являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют
циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а
также в качестве растворителя. Циклопропан используется в медицинской практике
в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических
углеводородов являются производные бензола, т.е. такие карбоциклические
соединения, в молекулах которых имеется особая циклическая группировка из шести
атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических
углеводородов CnH2n-6.
·
С6H6 – бензол, родоначальник гомологического ряда
аренов

·
С6H5 – CH3– толуол (метилбензол)

·
С6H5 – CH=СH2 – стирол (винилбензол)
Физические
свойства:
1. Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не
растворяется в воде
2. Внимание! Бензол – яд, действует на
почки, изменяет формулу крови (при длительном воздействии), может нарушать
структуру хромосом.
3. Большинство
ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические
углеводороды являются важным сырьем для производства различных синтетических
материалов, красителей, физиологически активных веществ. Так, бензол – продукт
для получения красителей, медикаментов, средств защиты растений и др. Толуол
используется как сырье в производстве взрывчатых веществ, фармацевтических
препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется
для получения полимерного материала – полистирола.
Применение УГЛЕВОДОРОДОВ
Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Источник
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300![]() С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
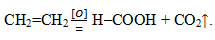
Окисление
этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150![]() C) или пропускании его паров над катализатором
C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Непредельные углеводороды, алкены
Таблица 2. Гомологический ряд алкенов.
| Название химического соединения | Структурная формула |
|---|---|
Этен (этилен) | C2H4 (СH2=CH2) |
Пропен (пропилен) | C3H6 (СH2=CH-CH3) |
Бутен | C4H8 |
Пентен | C5H10 |
Гексен | C6H12 |
Гептен | C7H14 |
Октен | C8H16 |
Нонен | C9H18 |
Декен | C10H20 |
Углеводородные радикалы, образованные от алкенов: — CH=CH2 – винил и –СН2 -СН=СН2 – аллил.
Изомерия
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
CH2=CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
CH2=CH-CH2-CH3 (бутен-1)
CH3-C=CH-CH3 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
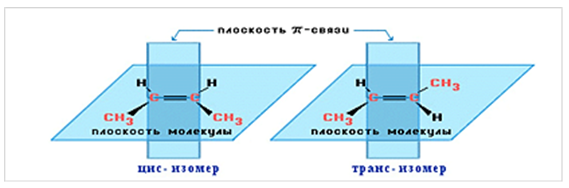
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Строение алкенов
Атомы углерода в молекулах алкенов находятся в sp2-гибридицациии: 3σ-связи располагаются в одной плоскости под углом 120![]() друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-CHBr-CH3 + KOH = CH3-CH=CH-CH3 + KBr + H2O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH=CH-CH3
— дегидратация спиртов при их нагревании с серной кислотой (t >150![]() C) или пропускании паров спирта над катализатором
C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 = CH3-CH=CH2 + H2O
— дегидрирование алканов при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 = CH3-CH=CH2 + H2
Химические свойства
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
CH3-CH=CH2 + HCl = CH3-CHCl-CH3
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
CH3-C(CH3)=CH2 + H2O = CH3-C(CH3)OH-CH3
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
CH2=CH2 + Br2 = BrCH2-CH2Br
При нагревании смеси алкена с галогеном до 500![]() С возможно замещение атома водорода алкена по радикальному механизму:
С возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH=CH2 + Cl2 = Cl-CH2-CH=CH2 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализоторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2=CH2 + H2 = CH3-CH3
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3CH2=CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоноы, карбоновых кислот или углекислого газа:
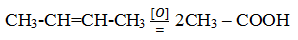
Окисление этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2=CH2 +1/2O2 = CH3-CH=O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2=CH2 = -(-CH2-CH2-)n—
Примеры решения задач
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
Гомологический ряд алкенов
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
sp2-гибридизация
При образовании σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
Сигма-связь
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
пи-Связь
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 градусов друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Например.
Изомеры с различным углеродным скелетом и с формулой С4Н8 – бутен-1 и метилпропен
Бутен-1
Метилпропен
Межклассовые изомеры – это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов – CnH2n.
Например.
Межклассовые изомеры с общей формулой С3Н6 – пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Например.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 – бутен-1 и бутен-2.
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Например.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере – по разные стороны.
цис-транс-Изомерия
цис-транс-Бутен-2
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Например.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода).
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название метилпропен.
Метилпропен
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Тривиальные названия алкенов
Радикалы, содержащие двойную связь, также носят тривиальные названия:
Названия радикалов алкенов
Источник
