Какими химическими свойствами обладают этилен и его гомологи ответ подтвердите уравнениями

Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление
этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150 C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Непредельные углеводороды, алкены
Таблица 2. Гомологический ряд алкенов.
| Название химического соединения | Структурная формула |
|---|---|
Этен (этилен) | C2H4 (СH2=CH2) |
Пропен (пропилен) | C3H6 (СH2=CH-CH3) |
Бутен | C4H8 |
Пентен | C5H10 |
Гексен | C6H12 |
Гептен | C7H14 |
Октен | C8H16 |
Нонен | C9H18 |
Декен | C10H20 |
Углеводородные радикалы, образованные от алкенов: — CH=CH2 – винил и –СН2 -СН=СН2 – аллил.
Изомерия
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
CH2=CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
CH2=CH-CH2-CH3 (бутен-1)
CH3-C=CH-CH3 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
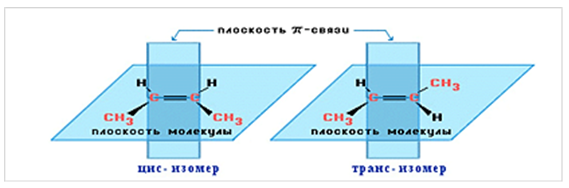
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Строение алкенов
Атомы углерода в молекулах алкенов находятся в sp2-гибридицациии: 3σ-связи располагаются в одной плоскости под углом 120 друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-CHBr-CH3 + KOH = CH3-CH=CH-CH3 + KBr + H2O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH=CH-CH3
— дегидратация спиртов при их нагревании с серной кислотой (t >150 C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 = CH3-CH=CH2 + H2O
— дегидрирование алканов при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 = CH3-CH=CH2 + H2
Химические свойства
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
CH3-CH=CH2 + HCl = CH3-CHCl-CH3
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
CH3-C(CH3)=CH2 + H2O = CH3-C(CH3)OH-CH3
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
CH2=CH2 + Br2 = BrCH2-CH2Br
При нагревании смеси алкена с галогеном до 500С возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH=CH2 + Cl2 = Cl-CH2-CH=CH2 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализоторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2=CH2 + H2 = CH3-CH3
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3CH2=CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоноы, карбоновых кислот или углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2=CH2 +1/2O2 = CH3-CH=O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2=CH2 = -(-CH2-CH2-)n—
Примеры решения задач
Источник
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Раздел 16.
УГЛЕВОДОРОДЫ
§
16.6. Этилен и его гомологи
Свойства. Этилен — первый член
гомологического ряда — бесцветный газ с очень слабым сладковатым запахом, немного
легче воздуха, малорастворим в воде.
За
химическим свойствам этилен резко отличается от метана, что обусловлено
электронному строению его молекулы. Имея в молекуле двойную связь,
состоит из σ – и-связи,
этилен способен присоединять два одновалентных атома или радикалы за счет
разрыва -связи.
Способность к реакциям присоединения
характерная для всех алкенов. Рассмотрим типичные из них.
1. Присоединение водорода. Эта реакция
происходит при наличии катализатора — тонкоизмельченного никеля, платины или
палладия — при комнатной температуре:
Pt
CH2=CH2 + H2 −> СН3—СН3.
Присоединение водорода к веществу называется
реакцией гидрирования или гидрогенизации.
При гидрогенизации олефины
превращаются в насыщенные углеводороды.
2. Присоединение галогенов.
Реакция происходит при обычных условиях. Например:
СН2=СН2 + Сl2 -> lСН2—СНСl.
Дихлорэтан
Дихлорэтан
— жидкость, хорошо растворяет органические вещества.
СН2=СН2 + r2 −> r- СН2—СН2Вr.
Диброметан
Реакция присоединения брома является качественной
реакцией на непредельные углеводороды. Наличие последних свидетельствует обесцвечивание
красно-бурой бромной воды.
3. Присоединение галогеноводородов:
СН2=СН2 + Н —
Сl −>СН3—СН2Сl.
Легко прийти к выводу, что
галогенпроизводные углеводородов, например хлористый этил СН3—СН2Сl, можно добыть двумя способами: или
присоединением к этилену хлороводорода, либо замещением водорода в этане на хлор.
Присоединение галогеноводородов к
гомологов этилена происходит по правилу В. В. Марковникова: атом водорода
присоединяется к наиболее гидрогенизированного атома углерода, а атом галогена — к
наименее гидрогенизированного. Например:
4.
Присоединение воды (реакция гидратации). Реакция происходит при наличии
катализатора — серной кислоты:
H2SO4
CH2=CH2+ Н2O -> CH3—СН2ОН.
Это суммарное уравнение реакции.
Фактически реакция проходит в две стадии. Сначала происходит присоединение серной
кислоты к этилену в месте разрыва двойной связи с образованием етилсірчаної
кислоты:
СН2=СН2 + H-O-SO2-OH
-> CH3-CH2-O-SO2-OH.
Далее етилсірчана кислота,
взаимодействуя с водой, образует спирт и кислоту:
СН3—СН2—O—SO2—ОН + Н—ОН −> СН3—СН2ОН
+ HO—SO2—ОН.
Сейчас реакцию присоединения воды к
этилена при наличии твердых катализаторов применяют для промышленного
извлечения этилового спирта из непредельных углеводородов, содержащихся в газах
крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством
этилена и его гомологов является способность легко окиснюватися уже при обычной
температуры. При этом окисление подлежат оба атома углерода, соединенные
двойной связью. Если этилен пропускать через водный раствор перманганата
калия КМnО4,
то характерная фиолетовая окраска последнего исчезает, происходит окисление
этилена перманганатом калия:
ЗСН2=СН2 + 2КМnO4 + 4Н2O -> ЗНОН2С—СН2ОН
+ 2МnO2 + 2КOН.
Этиленгликоль
Эту реакцию используют для
установка ненасыщенности органического вещества — наличия в ней двойных или
тройных связей.
Этилен горит светящимся пламенем с
образованием оксида углерода(IV)
и воды:
С2Н4 + 3O2 −> 2O2 + 2Н2О.
Для этилена, как и для всех ненасыщенных
углеводородов, характерны реакции полимеризации (см. § 16.7).
Добывания.
В лабораторных условиях этилен получают при нагревании этилового спирта с
водовідбираючими вещес нами (концентрированной серной кислотой, оксидом фосфора (V):
H2SO4, нагрев
С2Н5ОН
» СН2=СН2 + Н2O.
Это — процесс, обратный добыче
спирта из этилена (см. выше). Его можно представить так. Сначала спирт взаимодействует
с серной кислотой, образуя етилсірчану кислоту и воду:
Далее етилсірчана кислота при
температуре 180-200 °С разлагается на серную кислоту и этилен:
Олефины получают также при
нагревании галогенпроизводных с концентрированным спиртовым раствором щелочи:

В промышленных условиях этилен и его
гомологи выделяют из газов крекинга нефти. Очень важен способ их добывания —
дегидрирование соответствующих насыщенных углеводородов над никелевым катализатором:
Ni
СН3—СН3−>
СН2=СН2 + Н2;
Ni
СН3—СН2—СН3
−> СН2=СН-СН3 + Н2.
Применение. Этилен применяют
для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов
(помидоров, цитрусовых и др) при введении небольших количеств его в воздух
теплиц. Этилен и его гомологи используются как химическое сырье для синтеза
многих органических веществ.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 6497831
Мари Умняшка
более месяца назад
Просмотров : 8
Ответов : 1
Лучший ответ:
Онтонио Веселко
comment
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Пармезан Черница
С какой силой выталкивается керосином кусок стекла объемом 1 см3? С какой силой выталкивается керосином кусок стекла объемом 1 см3?
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Энджелл
Подумайте, почему стало возможным появление в начале XVII в. самозванцев. Чем объяснить веру в них народа? Подумайте, почему стало возможным появление в начале XVII в. самозванцев. Чем объяснить веру в них народа?
более месяца назад
Смотреть ответ
Просмотров : 20
Ответов : 1
Таня Масян
Назовите причины «смутного времени». Назовите причины «смутного времени».
более месяца назад
Смотреть ответ
Просмотров : 16
Ответов : 2
Онтонио Веселко
Сочинение Большая маленькая радость Сочинение Большая маленькая радость
более месяца назад
Смотреть ответ
Просмотров : 11
Ответов : 1
Мари Умняшка
Сочинение Волшебные слова Сочинение Волшебные слова
более месяца назад
Смотреть ответ
Просмотров : 20
Ответов : 1
Источник
