Какими общими химическими свойствами обладают металлы главных подгрупп
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
В предыдущих частях мы, во-первых, ввели понятие атомного радиуса, к которому не раз сегодня обратимся. Во-вторых, ввели понятие о металлических и неметаллических свойствах. И, в-третьих, научились отличать металлы от неметаллов по таблице Менделеева.
Сегодня поговорим о том, какие закономерности можно выделить в рамках таблицы Менделеева благодаря всем вышеперечисленным знаниям.
Обо всём по порядку
Напомню:
Атомный радиус – условная величина, характеризующая удалённость электронов на внешнем энергетическом уровне от ядра атома.
Условное изображение атомного радиуса атома не примере атома углерода
Металлические свойства – способность атомов химических элементов отдавать электроны
Неметаллические свойства – способность атомов химических элементов эти электроны принимать.
Выделять закономерности в пределах таблицы Менделеева мы будем в двух направлениях:
В пределах подгруппы (сверху – вниз)
Сделаю акцент на том, что работать мы будем исключительно в пределах главных подгрупп
О том, почему атомный радиус в пределах подгруппы (сверху вниз) возрастает, мы говорили здесь.
- А почему же в пределах подгруппы (сверху вниз) усиливаются металлические свойства?
Дело в том, что с в пределах подгруппы с увеличением атомного радиуса возрастает удалённость электронов на внешнем энергетическом уровне от ядра, а чем более электроны удалены от ядра, тем выше запас их свободной энергии, тем менее прочно они связаны с ядром (об этом здесь) – это значит, что тем проще эти электроны будет отдать! А металлические свойства как раз-таки характеризуют способность атомов химических элементов отдавать электроны.
Ещё раз. Чем больше электроны удалены от ядра, тем менее прочно они связаны с ядром, тем проще их оказывается отдать. Я думаю, Вы интуитивно чувствуете эту простую логику, согласно которой прочность связи обратно пропорциональна расстоянию.
- Почему же в пределах подгруппы (сверху вниз) неметаллические свойства ослабевают?
Всё очень просто, неметаллические свойства – прямо противоположное понятие металлическим свойствам, и если одно усиливается, то другое ослабевает.
Как можно проследить данные закономерности? Посмотрим в таблицу Менделеева, а именно в главную подгруппу четвёртой группы.
Белый, зелёный – металлы, красный – неметаллы.
В пределах главной подгруппы четвёртой группы мы видим, как неметаллы углерод (C) и кремний (Si) в какой-то момент сменяет металл германий (Ge), и это неслучайно! Мы знаем, что металлические свойства в пределах подгруппы усиливаются, а неметаллические – ослабевают, и именно поэтому в какой-то момент при движении в пределах подгруппы сверху вниз металлические свойства усилились настолько, а неметаллические свойства ослабли настолько, что неметаллы в какой-то момент уступают место металлам.
И данную закономерность Вы можете пронаблюдать в пределах главной подгруппы любой группы!
Почему именно главные подгруппы? Дело в том, что классический вариант таблицы Менделеева, с которым мы чаще всего и работаем, в угоду компактности размещает элементы побочных подгрупп, которые, мы знаем, являются исключительно металлами, таким образом, что они, кажется, игнорируют рассматриваемые нами закономерности, то есть, попросту говоря оказываются исключениями. Ради интереса можете посмотреть на развёрнутый вариант таблицы.
В пределах периода (слева – направо)
Здесь попроще. здесь никаких подгрупп.
Итак, мы знаем, что в пределах периода (слева направо) атомный радиус убывает (об этом здесь). Так что же из этого вытекает?
А то, что металлические свойства будут убывать, а неметаллические – возрастать! Судите сами:
чем меньше атомный радиус, тем ближе электроны на внешнем энергетическом уровне оказываются к ядру, то есть тем более прочно эти электроны оказываются связаны с ядром и тем труднее их оказывается отдать, то есть тем менее выражены оказываются металлические свойства и более выражены неметаллические.
Мы легко можем проследить данную закономерность по таблице Менделеева, пользуясь тем же способом размышления, что и выше:
Белый, зелёный – металлы, красный – неметаллы.
В переделах любого периода (слева – направо) металлы закономерно начинают сменяться неметаллами, так как металлические свойства ослабевают, а неметаллические – возрастают.
Осталось сделать последний штрих – ввести понятие электроотрицательности.
Электроотрицательность – способность атомов химических элементов оттягивать на себя электронную плотность.
Электроотрицательность – понятие тождественное по смыслу неметаллическим свойствам и используется для характеристики неметаллических свойств атома. Оно даже изменяется в пределах таблицы Менделеева аналогичным образом! То есть, в пределах подгруппы (сверху вниз) убывает, а в пределах периода (слева – направо) возрастает.
Таблица электроотрицательности по Полингу
А на этом у меня всё. В следующий раз продолжим обозревать типы химической связи. Спасибо. Пока.
Источник
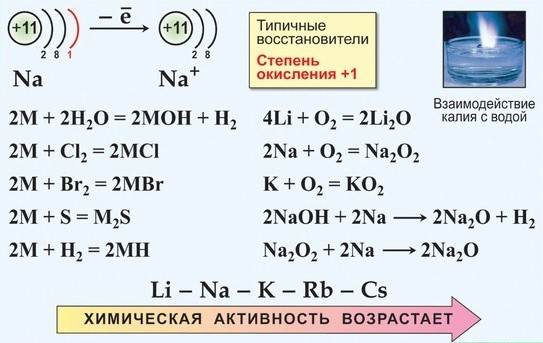
Металлы главной подгруппы I группы
6 элементов этой подгруппы принято называть щелочными металлами. Это название сложилось исторически, так как Na и К впервые были получены при электролизе щелочей
3Li | 1s2 2s1 |
11Na | [Ne] 3s1 |
19К | [Ar] 4s1 |
37Rb | [Кг] 5s1 |
55Cs | [Xe] 6s1 |
87Fr | [Rn] 7s1 |
все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
— атомы всех элементов на предвнешнем электронном слое имеют устойчивые 8-электронные конфигурации соответствующего благородного газа (у Li — оболочка Не);
— все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me+;
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).

Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
При повышении Т все металлы сгорают с образованием ослепительного пламени.
Все щелочные металлы очень химически активны, сильные восстановители:
Me – 1e- → Me+
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
а) только Li при горении образует нормальный оксид:
4Li + О2 → 2 Li2O
б) Na при горении образует бесцветный или слегка желтоватый пероксид
2Na + O2 → Na2O2
в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
К + O3= КO3
г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
К + O3= КO3
Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
2Na + F2 = 2NaF;
2Na + Cl2 = 2NaCl;
2K + Br2 = 2KBr
а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
2Na + S = Na2S сульфид натрия
3Na + Р = Na3Р фосфид натрия
б) с углеродом и кремнием реагирует непосредственно только литий:
2Li + 2С = Li2C2 карбид лития
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
2Li + Н2 = 2LiH
2Me + 2Н20 —> Н2 + 2МеОН
Реакции протекают очень энергично, даже со слабыми кислотами.
1) реакции с кислотами за счет восстановления ионов Н+:
6Na + 2Н3РО4 = 2Na3P04 + 3H2
2Na + 2HCl = 2NaCl + H2
2) реакции с кислотами за счет восстановления анионов:
8Na + IOHNO3 = 8NaNO3 + NH4NO3 + 3H2O
3) реакции с органическими кислотами:
2 Na + 2СН3СООН → 2 CH3COONa + H2
2Na + 2С2Н5ОН → 2C2H5ONa + H2
2Na + 2С6Н5ОН → 2C6H5ONa + H2
CH3Cl + 2Na + ClCH3 → CH3-CH3 + 2NaCI
а) реакции с аммиаком расплавленных щелочных металлов:
2Na + 2NH3 = 2NaNH2 + H2
амид натрия
б) реакции с ацетиленом и некоторыми его гомологами
2 Na + НС=СН → NaC =CNa + Н2
ацетиленид натрия
2NaCI = 2Na + Cl2 (аналогично получают Li , К)
4КОН = 4К + O2 + 2Н2O
Выделение металлов происходит на ртутном, свинцовом или стальном катоде
Металлы восстанавливают из расплавов их солей активными металлами:
KCl + Na = К + NaCl
2CsCl + Са → 2Cs + CaCl2
Источник
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.
В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
с серой металлы образуют сульфиды – соли сероводородной кислоты;
с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1;
с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия – пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой: Ca +2H2O=Ca(OH)2+H2
Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:
Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
Металлы средней активности окисляются водой при нагревании до оксида:
Неактивные металлы (Au, Ag, Pt) – не реагируют с водой.
2Na+ 2H2O=2NaOH+H2 активные металлы (до Al)
Zn+ H2O=ZnO+H2 среднеактивные металлы (от Al до H), только при нагревании
неактивные металлы не взаимодействуют с водой (после Н)
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода: Mg + H Cl = Mg Cl2 +H2
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему “Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металла с оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде.
Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо, CuSO4 + Fe = FeSO4 + Cu
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
|---|---|---|
| с простыми веществами – неметаллами | ||
| с кислородом | ||
4Li + O2 = 2Li2 O | оксиды | |
2Na + O2 = Na2 O2 | пероксиды | только натрий |
K+ O2 = KO2 | надпероксиды | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
Ca + + H2 = CaH2 | гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы – при нагревании |
| с галогенами | ||
2Fe +3 Cl2 =2 FeCl3 | хлориды и др. | при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
Fe + S = FeS | сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фосфором | ||
3Mg + N2 = Mg3N2 | нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
3Ca +2 P = Ca3 P2 | фосфиды | |
| с углеродом | ||
Ca + 2C = CaC2 | карбиды | |
| с водой | ||
Ca +2H2O = Ca(OH)2+H2 | Основание + H2 | щелочные металлы |
Zn+ H2O = ZnO+H2 | Оксид + H2 | среднеактивные металлы, при нагревании |
Au, Ag, Pt, | не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| 2Al + 3ZnO = Al2 O3 + 3Zn | др оксид + др.металл | |
| с солями менее активных металлов | ||
CuSO4 + Fe = FeSO4 + Cu | Др. соль + др. металл |
|
| Cu + Al Cl3 | не реагируют | |
| с кислотами | ||
Fe + 2H Cl = Fe Cl2 + H2 | Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме ) |
Cu + H3PO4 не реагируют | ||
Источник
Тема: Металлы главных подгрупп периодической системы химических элементов
Цель: познакомиться со свойствами металлов главных подгрупп периодической системы химических элементов; рассмотреть общие свойства и закономерности щелочных и щелочноземельных элементов, изучить по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений рассмотреть такое понятие, как жесткость воды. Познакомиться с алюминием, его свойствами и сплавами.
Оборудование: ПСХЭ
Ход урока
Организационный момент
Актуализация опорных знаний:
Расскажите, каким образом располагаются металлы в ПСХЭ.
Каких элементов больше: металлических или неметаллических?
Какими общими свойствами обладают металлы?
Изучение нового материала:
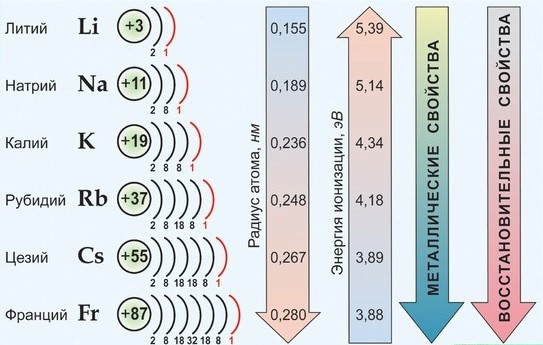
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
2. Щелочные металлы
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с пл. 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S Na2S
2Na + H2 2NaH
3Na + P Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3H2O → 3LiOH + NH3↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
NaOH | Едкий натр (каустическая сода) |
NaCl | Поваренная соль |
NaNO3 | Чилийская селитра |
Na2SO4∙10H2O | Глауберова соль |
Na2CO3∙10H2O | Сода кристаллическая |
KOH | Едкое кали |
KCl | Хлорид калия (сильвин) |
KNO3 | Индийская селитра |
K2CO3 | Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S СaS
Сa + H2 СaH2
3Сa + 2P Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
СaO + H2O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4- ,Cl-, NO3- и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
4. Алюминий
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2 2AlI3
2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2 2Al2O3 + Q . При этом может развиваться температура до 35000С.
3. Реакция с неметаллами
2Al + 3S Al2S3
2Al + N2 2AlN
4Al + 3С Al4С3
4. Взаимодействует с водой
2Al + 6H2O → 2Al(OH)3 +3H2↑ Если снять амальгамированием или механически пленку.
Амальгамирование – это нанесение на поверхность небольшого количества ртути.
5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
6. Взаимодействует с кислотами-неокислителями
2Al + 6HCl →2AlCl3 + 3H2↑
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (амфотерные свойства).
Al2O3 + 2NaOH = 2NaAlO2 + H2O
8. Реагирует с растворами солей
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Применение алюминия
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия. Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов. Используется как конструкционный материал в авиа- и машиностроении.
5. Смеси, регенерирующие кислород
Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
Na2O2 + CO2 → Na2CO3 + 1/2O2
KO2 + CO2 → K2CO3 + 3/2O2
Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды. Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Домашнее задание
Рефлексия: Я могу…Я знаю… Я буду…
Источник
