Какими сходствами и отличительными свойствами обладают следующие вещества

Со школьной скамьи мы помним задания на уроках химии — сравнить свойства разных веществ: кристаллов, жидкостей и т.д. Сегодня мы совершим путешествие во времени. Вернемся назад в школу и проведем сравнительный анализ обыкновенной воды и уксусной кислоты. С этими жидкостями мы сталкиваемся не так уж и редко. Особенно с водой. Что касается уксуса, то в хозяйстве всегда должна быть бутылка этого вещества. Попробуем сравнить их…
Для начала уточним терминологию
Как мы знаем из курса химии, характеристики того или иного вещества зависят не только от химического состава. Большую роль играют концентрация элементов и наличие примесей. Например, уксусная кислота неоднородна по составу: бывает столовый уксус 3,6 и 9%, уксусная эссенция и т.д. Эти вещества хоть и относятся к одному химическому классу, но имеют существенные различия.
Рассмотрим подробнее:
- Уксусная кислота — это продукт окисления этилового спирта или же перегонки биологического сырья. К такому сырью относят переспелые фрукты, забродившие соки и вина. 100% уксус относится к категории слабых кислот, хорошо смешивается с водой, спиртом, бензолом и эфиром. При смешивании с Н2О получают уксусную эссенцию с концентрацией 70-80%.
- Столовый уксус — этот незаменимый в кулинарии и быту продукт получают разбавлением уксусной эссенции. Если исходное вещество имеет концентрацию 70-80%, то столовый уксус, обильно заправленный водой — всего 3, 6 или 9%. Получить из эссенции столовый уксус несложно. Достаточно правильно рассчитать объемы жидкостей.
Мы определили, что уксус имеет различную концентрацию, которая и определяет свойства, назначение и название раствора. Приступим к сравнению воды и уксусной кислоты.
Что важно при сравнительном анализе жидкостей?
В лаборатории, как правило, изучают физические и химические показатели веществ.
В первом случае определяют:
- Оптические характеристики — мутность/прозрачность, поглощение световых лучей.
- Вкус, запах.
- Температуру газообразование или плавления.
- Теплопроводность и теплоемкость.
- Плотность.
- Электропроводимость и другие свойства.
Химические показатели — это способность вещества вступать в реакции с другими химическими соединениями.
Итак, вода и уксусная кислота — прозрачные субстанции, которые при небольших объемах не имеют цвета. Температура кипения воды и уксуса примерно равные: вода — 100 градусов, а уксусная кислота — 118 градусов Цельсия. Уксус несколько плотнее воды, примерно на 1,05 кг/м3.
Физические отличия воды и уксуса:
- Чистая вода не обладает вкусом и запахом, тогда как уксусная кислота имеет характерный кисловатый привкус и резкий запах.
- Поверхностное натяжение воды выше в 3 раза и составляет 72,86 мН/м против 27,8 мН/м уксуса.
- При охлаждении вода превращается в кристаллы, а уксус в льдистую массу.
- Теплоемкость воды также выше в 2 раза — 4,1 Дж/г·K против 2,01 Дж/г·K уксуса.
Кроме того, различия уксуса и воды вызваны и химическими свойствами. В частности кислота имеет куда более сложную формулу — CH3COOH и представляет собой органическое вещество. Вода же — это неорганика и её формула проста — Н2О.
Общие химические показатели:
- Вода и уксус взаимодействуют с активными металлами — натрием, кальцием, калием и другими. Результат реакции — водород.
- Взаимодействуют с хлором и щелочными оксидами.
Отличительные характеристики:
- Вода имеет рН около 7, тогда как уксус — это кислота с рН равным 3.
- Вода — растворитель, тогда как уксус — окислитель.
- Н2О реагирует с солями слабых кислот — гидролиз, а уксус нет.
- Вода разлагается на молекулярные составляющие под воздействием электротока и высоких температур. Подобная реакция для уксусной кислоты потребует больших затрат энергии и наличие вещества-катализатора.
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Получи самые интересные публикации
Вы можете отписаться в любой момент
Спасибо за подписку на нашу рассылку
Источник
На уроках химии часто дают задание сравнить свойства различных веществ – жидкостей, кристаллов. Сегодня мы постараемся разобраться, в чем сходства и различия уксусной кислоты и воды. С этими жидкостями мы сталкиваемся практически каждый день, и, чтобы не навредить себе, необходимо четко понимать разницу между ними.
Разберемся с терминами
В первую очередь нужно разъяснить некоторые моменты. Свойства определенного вещества зависят не только от его химической природы, но и от концентрации и наличия примесей. Существуют такие понятия, как уксусная кислота, уксусная эссенция и столовый уксус. Многие из нас эти понятия не различают. Сейчас мы расскажем, каковы сходные и отличительные свойства уксуса и воды.
Уксусная кислота – это чистый продукт, который получают путем окисления этилового спирта или перегонки биологического материала.

Сырьем могут служить спелые фрукты, соки или вина. В результате этого процесса получают 100% кислоту. Если вещество разбавить некоторым количеством чистой воды, получают уксусную эссенцию. Ее концентрация может составлять от 30 до 80%, но чаще всего встречается 70–80% раствор.
Столовый уксус получают путем разбавления уксусной эссенции большим количеством воды. Обычно концентрация такого продукта составляет 3, 6 или 9%. Именно такой уксус чаще всего встречается на прилавках наших магазинов и используется хозяйками в кулинарных целях. Превратить эссенцию в столовый уксус может любой, прежде математически рассчитав необходимые объемы жидкостей (методом креста).
Мы с вами выяснили, что уксус может иметь разную концентрацию, от которой и зависит название раствора. Далее рассмотрим свойства уксусной кислоты и воды, выделяя их сходства и отличия.
Показатели
Сравнивая различные жидкости, обращают внимание на основные физические и химические показатели. К физическим относятся:
- оптические показатели (прозрачность, поглощение света);
- наличие запаха и вкуса;
- температура плавления и газообразования;
- теплоемкость и теплопроводность;
- электропроводимость;
- плотность и др.
Химические характеристики показывают способность вещества реагировать с теми или иными химическими соединениями.
Физические характеристики
Оба наши предмета сравнения – прозрачные жидкости, которые при малом объеме не имеют цвета. Также вещества имеют близкие значения температуры плавления (вода – 0 °C, уксус – 16 °C) и газообразования (100 и 118 °C соответственно). Плотность уксуса относительно воды составляет 1,05 (вода – 1 кг/м3). На этом общие физические признаки заканчиваются.
Отличительные черты:
- Чистая вода не имеет ни вкуса, ни запаха, в то время как уксус отличается кислым вкусом и характерным резким запахом.
- Поверхностное натяжение кислоты при нормальных условиях равно 27,8 мН/м, тогда как у воды это значение намного выше (72,86 мН/м) и уступает только ртути.
- При замерзании вода превращается в кристаллы льда, а уксусная кислота – в льдовидную массу.
- Удельная теплоемкость кислоты составляет 2,01 Дж/г·K, а у воды данное значение выше – 4, 187 Дж/г·K. Это связано с тем, что при испарении H2O нужно много энергии для разрыва водородных связей.
Химические свойства
Сходства и различия уксуса и воды связаны с их химической природой.
Уксусная кислота имеет формулу CH3COOH и является органическим веществом, а вода – неорганическое соединение с формулой H2O.
Общие признаки:
- Взаимодействие с активными металлами: калием, кальцием, натрием и др. В результате реакций образуется водород.
- Дают реакцию со щелочными оксидами. Отличие заключается в выходных продуктах.
- Взаимодействуют с хлором, только в ходе реакции с водой образуется хлорная кислота, а с уксусом – хлоруксусная.
- Иногда H2O рассматривают как основание и кислоту одновременно.
Отличительные свойства:
- H2O плохо диссоциирует, а также имеет нейтральное значение pH (7), CH3COOH – слабая и легко диссоциирующая кислота со значением pH около 3.
- Вода чаще всего выступает в роли сильнополярного растворителя, а уксус – окислителя.
- H2O реагирует с солями слабых кислот и оснований, в результате чего происходит их полный гидролиз.
- Вода способна разлагаться на молекулярные составляющие под действием электрического тока и высоких температур. Разложение CH3COOH требует много энергии и наличие катализатора.
Изучение свойств уксусной кислоты: Видео
Оценка статьи:
(Пока оценок нет)
Загрузка…
Источник
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.


Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
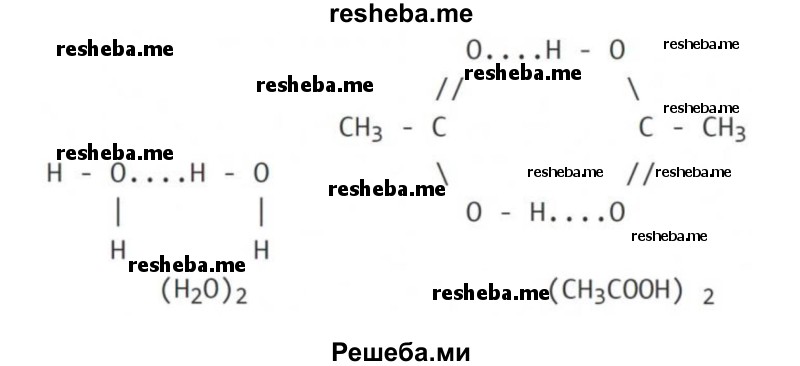
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Источник
