Какими специфическими свойствами обладают ферменты
Ферменты, витамины и гормоны – органические вещества, жизненно важные для организма человека, поэтому их называют биологически активными веществами. Об этих веществах вам известно их курса биологии человека.
Ферменты – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Сейчас известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов.
Ферменты обладают уникальными свойствами, которые выделяют их на фоне обычных химических катализаторов.
Специфические свойства ферментов: большая относительная молекулярная масса, селективность (избирательность), действие в определённом температурном интервале и при определённой Рн среды, высокая каталитическая активность, специфичность действия.
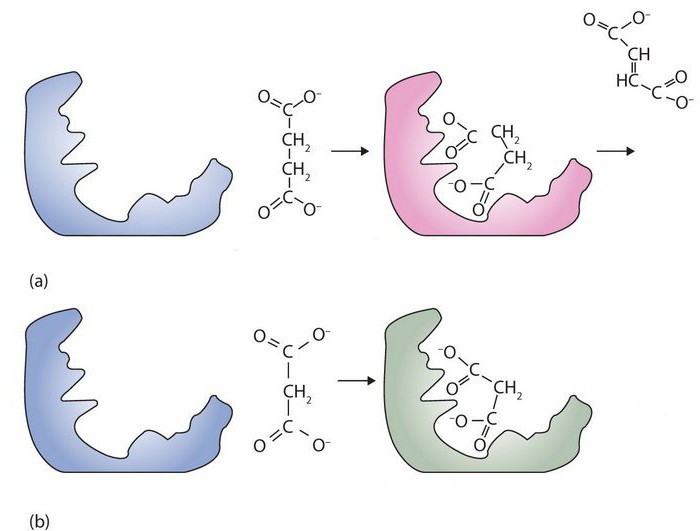
Так, добавка незначительной концентрации фермента (10-9 –10-7 М) ускоряет превращение субстратав108 –1012 раз. Другое не менее важное свойство ферментов – специфичность (избирательность)их действия в отношении структуры субстрата, типа реакции и условий ее проведения. Специфичность определяется способностью фермента превращать только данный тип субстратов в определенных реакциях и условиях. Механизм заключается в образовании комплекса фермент-субстрат. Образовавшийся комплекс вступает в реакцию, при этом энергия активации реакции снижается. Превращение субстрата происходит в активном центре фермента. Для многих ферментов, состоящих из субъединиц, характерно наличие регуляторного участка, который взаимодействует с веществами, влияющими на активность фермента (активаторами, ингибиторами). Для каждого фермента существует свой оптимум рН, при котором его каталитическое действие максимально. При резком изменении рН среды ферменты могут инактивироваться в результате необратимой денатурации.
Большинство ферментов обладает очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз выше скорости реакций, протекающих в их отсутствие. Высокая эффективность ферментов объясняется быстрым восстановлением (регенерацией) молекул в процессе «работы». Типичная молекула фермента может регенерировать миллионы раз за минуту. Например, широко используемый в сыроделии фермент реннин способен вызывать коагуляцию (свёртывание) белков молока в количествах, в миллионы раз превышающих его собственную массу. Этот фермент вырабатывается слизистой оболочкой особого отдела желудка жвачных животных — сычуга.
А вот ещё один пример высокой эффективности «работы» фермента, хорошо знакомого вам из курса химии 8 класса, — каталазы. За одну секунду при температуре, близкой к точке замерзания воды, одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода:
Каталаза понижает энергию активации в этой реакции от 75 до 21 кДж/моль. Для сравнения укажем, что применяемая для ускорения этой реакции платина в коллоидном состоянии понижает энергию активации только до 50 кДж/моль.
В простейшем случае уравнение реакции с участием фермента имеет вид:
где Е — фермент, S — субстрат, ES — фермент-субстратный комплекс (комплекс Михаэлиса), Р — продукт реакции.
И.П.Павлов назвал ферменты «возбудителями жизни». Без их участия не проходит ни одна биохимическая реакция. В каждой клетке имеются сотни различных ферментов. Реакции при помощи ферментов идут с большой скоростью при температурах, подходящих для данного организма, то есть в пределах от 5° до 40°С. Вся работа клетки строится таким образом, чтобы избежать любых изменений в нормальных условиях ее существования. Ферментативные реакции подразделяются на:
· анаболические (реакции синтеза) и
· катаболические (реакции распада).
Читайте также:
Рекомендуемые страницы:
©2015-2021 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-04-20
Нарушение авторских прав и Нарушение персональных данных
Источник
1. Размер молекул. Относительная молекулярная масса ферментов имеет значения в интервале от 105 до 107. Размер молекул ферментов позволяет отнести их к коллоидным частицам. Поэтому процессы ферментного катализа выделяют в специальный класс, не относя их ни к гомогенному, ни к гетерогенному катализу.
2. Селективность. Как правило очень высокая – каждый фермент катализирует одну специфическую реакцию или реакции одного типа. Ферменты отличаются чрезвычайно высокой избирательностью воздействия (селективностью) по отношению к химическому составу реагентов. В организме человека находится около 30 000 различных ферментов, каждый из которых служит эффективным катализатором соответствующей реакции. Так слюна содержит фермент птиалин, который ускоряет превращение крахмала в сахар. Фермент, имеющийся в желудке, — пепсин — катализирует расщепление белков.
3. Эффективность. Очень высокая. Например, фермент ренин (выделяется из сычуга жвачных животных) способен вызывать коагуляцию белков молока в количествах, в миллионы раз превышающих его массу.
4. Зависимость от температуры. Наибольшая эффективность проявляется при температуре приблизительно 370С. При повышении температуры до 50-600С ферменты разрушаются.
5. Стойкость к каталитическим ядам. Малая. Например, процесс сбраживания сахаров в спирт прекращается при достижении в сусле массовой доли спирта 15,5% из-за отравления ферментов дрожжей.
Ферменты в качестве биологических катализаторов применяются в различных отраслях промышленности – пищевой, текстильной, фармацевтической, кожевенной, в медицине, сельском хозяйстве, в тонком органическом синтезе и т.д. Более широкое использование ферментов в биотехнологии до последнего времени сдерживалось вследствие ряда причин, а именно:
1) трудоемкости отделения ферментов от исходных реагентов и продуктов реакции; 2) нестабильности ферментов при хранении и при действии различных факторов; 3) высокой стоимости чистых ферментных препаратов.
Создание биокатализаторов нового поколения – иммобилизованных, т.е. связанных ферментов открыло перед прикладной энзимологией новые перспективы. Иммобилизация фермента – это включение молекул биокатализатора в какую либо фазу, отделенную от фазы рабочего раствора, но способную обмениваться с ней молекулами. В качестве такой фазы может применяться, например, уголь.
Иммобилизованные ферменты легко отделимы от реакционной среды. Это дает возможность остановить реакцию в любой момент, получить продукт, незагрязненный катализатором, и использовать ферментный препарат многократно. Иммобилизованные ферменты технологичны, что определяется возможностью вести биотехнологический процесс непрерывно и регулировать скорость катализируемой реакции и выход продукта путем изменения скорости протока. Подбором соответствующих носителей и методов иммобилизации можно целенаправленно модифицировать такие свойства ферментов, как специфичность, рН- температурозависимость, а также стабильность фермента при денатурирующих воздействиях.
Успешное использование иммобилизованных ферментов в значительной мере определяется выбором подходящего сочетания носителя и метода иммобилизации, а также знанием кинетики реакций с участием таких катализаторов.
Иммобилизованные ферменты можно использовать, главным образом, в трех направлениях:
1. Анализ различных веществ,
2. В качестве лечебных средств
3. В качестве биокатализаторов для использования в биотехнологических производствах.
Например, лечебные средства на основе иммобилизованных ферментов применяются в том случае, когда необходимый фермент отсутствует в тканях, вследствие генетических или других нарушений, либо в качестве агентов, разрушающих нежелательные компоненты, например, мочевину. Использование чужеродных (бактериальных) ферментов зачастую нежелательно, вследствие того, что они могут стать причиной аллергических реакций и, кроме того, они крайне неустойчивы. Иммобилизация позволяет обойти эти барьеры, так как она повышает стабильность фермента и препятствует его взаимодействию с иммунной системой макроорганизма.
Например, в аппарате “искусственная почка”, предназначенном для освобождения крови от различных шлаков, в том числе и мочевины, путем ультрафильтрации, используется колонка с иммобилизованной уреазой. Ферменты применяют в лечебных целях и тогда, когда они необходимы, но по причине различных патологических процессов отсутствуют, например, для растворения кровяных тромбов.
Источник
14 января 2021
- Ферменты — это…
- Их особенности
- Какими свойствами они обладают
- Классификация ферментов
- Практическая значимость энзимов
Здравствуйте, уважаемые читатели блога KtoNaNovenkogo.ru. Ферменты (или энзимы) относятся к особому глобулярному классу белков, выполняющих функции биологических катализаторов.
Все биологические и химические процессы в клетках, благодаря ферментам, происходят при огромной скорости реакций. При этом сам фермент в этих процессах остается неизменным.
Ферменты — это…
Прежде чем приступить к лекции по теме ферментов, преподаватель одного из ВУЗов предложил студентам, для большего восприятия, послушать небольшую старинную притчу.
Перед смертью арабский старец разделил стадо из 17 верблюдов с чудесной белой шерстью на части, и в качестве наследства распределил между сыновьями. Старшему из сыновей завещал половину стада, средний — получал треть стада, младший сын получил – девятую часть.
После смерти отца перед сыновьями возникла проблема, как же разделить это количество верблюдов согласно завещанию, ведь число 17 нельзя поделить на 2 части, 3, либо 9 частей.
В это время по пустыне шел нищий, но мудрый монах (дервиш), ведя на поводке старого, черного, тощего верблюда. Заметив грустных братьев, поинтересовался чем те озабочены. И когда братья рассказали о полученном наследстве, которое не могут поделить, дервиш решил подарить им своего старого верблюда.
Когда верблюдов стало 18, их легко разделили. Старшему досталось – 9, средний получил – 6, а младший – 2. Черный верблюд дервиша остался лишним, и братья вернули его хозяину.
В этом случае роль ферментативного катализатора сыграл черный верблюд, но остался в прежнем статусе – собственностью дервиша.
Ферменты, либо энзимы, это молекулы белка, синтезируемые клетками организма. В составе каждой клетки имеется более сотни разновидностей энзимов.
При их помощи, в различных показателях температуры (5-40 градусов), характерных для определенного живого организма, реакции биохимических процессов протекают с очень большой скоростью.
Чтобы эти же процессы протекали не в живом организме, понадобились бы иные условия и критически высокая температура. Наши клетки бы в таких условиях погибли, так как для обеспечения их жизнедеятельности недопустимы какие-либо изменения в условиях их физиологического существования.
Благодаря своим свойствам ферменты получили статус биокатализаторов, веществ, ускоряющих процессы биохимических реакций в клетках, без которых они протекали бы в сотни, а то и в миллионы раз медленней.
Особенности и свойства ферментов
Сам термин «fermentum» означает – закваска. Его предложил голландский ученый В.Гельмонд еще в 17 веке.
Почти все белки в клетках, за исключением небольших фракций, являются энзимами, но это выявилось не сразу. Чтобы белковая «родословная» ферментов была признана на основе доказательной базы, необходимо было выделить их кристаллическую форму.
Первым это сделал в средине 20-х годов прошлого столетия американский ученый Д.Самнер, выделив кристаллы энзима, разлагающего мочевину – уреазу.
Лишь спустя десятилетия, пройдя длительный путь эволюции (что это?), удалось получить несколько разновидностей кристаллических ферментов и доказать их белковую природу.
Какими же свойствами обладают ферменты?
Несмотря на их огромное разнообразие, все ферменты на основании строения молекулярной кристаллической решетки разделяют на группы простых и сложных белков.
В основе сложной формы энзимов, кроме белковой фракции, присутствует так называемый кофактор, в виде добавочной небелковой группы происхождения, к примеру – различные варианты витамин.
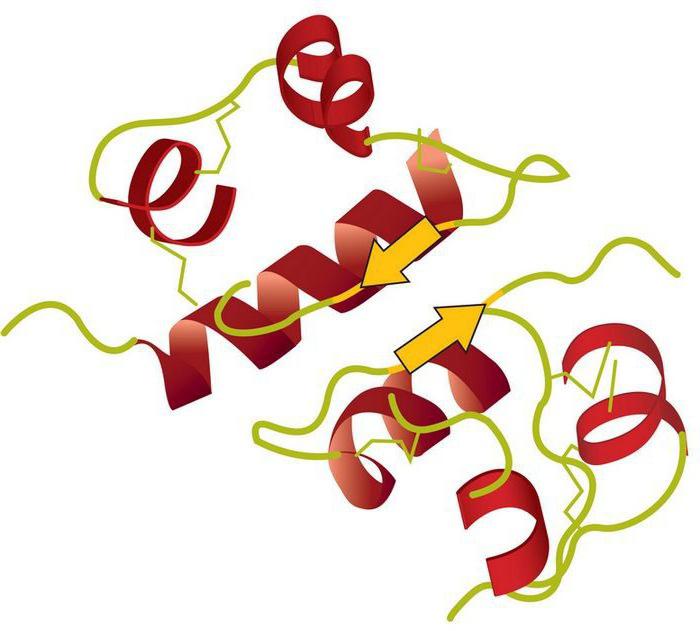
В молекулярном составе простых белков (однокомпонентных) выделяется особая молекулярная часть энзимов, называемая активным центром. Он обеспечивает специфичность и каталитическую функцию фермента, благодаря уникальному сочетанию аминокислотных остатков.
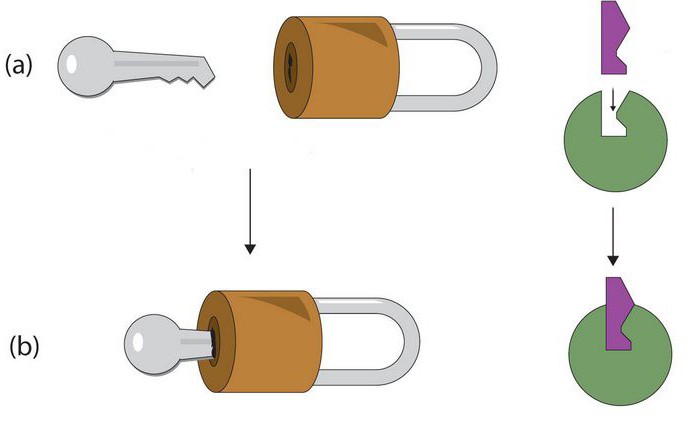
Вступая в контакт с субстратом, реакция образует своеобразный комплекс с последующим его распадом на энзимы и вещества, образуемые после процессов реакции. По пространственной конфигурации субстрата и активного ферментативного центра они имеют точное соответствие, подобно тому как ключ подходит к отверстию в замке.
Наиболее эффективная активность ферментов, как, впрочем, и всех белков, отмечается лишь в нормальных естественных условиях и зависит от конкретных обстоятельств.
- Температуры — многие из ферментов проявляют активность лишь при определенных температурных показателях. К примеру, каталитическая активность (при среднем значении повышенной температуры до 50 С) увеличивается вдвое при каждом повышении температуры на 10 С. Но если температура превысит среднестатистическое значение, молекулярная структура белка нарушается и активность ферментативных реакций снижается.
- Определенного значения водородного показателя (рН), который индивидуален для каждого энзима и обеспечивает развитие его максимальной активности.
- Концентрации. Зависимости ферментативной реакции от количественной концентрации фермента и субстрата.
- Специфичности. Все энзимы специфичны к своему конкретному субстрату и катализируют, как правило, лишь одну определенную реакцию.
Именно ферментативная специфичность и тип катализирующей реакции лежат в основе классификации ферментов.
Классификация ферментов
Изначально многие ферменты носили упрощенные названия, не связанные часто с типом катализируемых реакций. Лишь в середине прошлого столетия была разработана и предложена систематическая номенклатура (что это такое?) и классификация ферментов на шесть главных классов.
Почти 3000 ферментов были распределены с учетом реакционной и субстратной составляющей и принципа катализирующего действия.
- Ферменты, входящие в класс оксидоредуктазы, катализируют различные окислительно-восстановительные реакции.
- Энзимы класса трансферазы ускоряют процессы переноса большинства функциональных кислотных группировок.
- Принадлежность к классу гидролазы характеризуется способностью расщепления веществ, состоящих из атомов различных химических соединений посредством обязательного наличия воды.
- Катализаторы группы лиазы расщепляют вещества без наличия жидкости, участвуют в процессах разрыва или присоединения веществ с кратными связями.
- Ферменты, относящиеся к группе изомеразы, обладают способностью превращения одних веществ в другие.
- Белковые фракции лигазы способны ускорять синтез различных сложных веществ (неорганических и органических групп) из простых веществ.
Для удобства пользования длинные названия ферментов заменили на более короткое рабочее обозначение, с опознавательным окончанием – аза, включающее название субстрата и тип ускоряемой реакции. Всем ферментам был присвоен классификационный шифр – КФ, включающий 4 цифры.
Первая – обозначает принадлежность к классу. Две последующих определяют тип подкласса и подподкласса. Последняя – порядковый номер элемента в определенном подклассе (к примеру, дегидрогеназа – КФ 1.3 99.3).
Практическая значимость энзимов
Практическую значимость ферментов трудно переоценить. Они применяются практически везде.
Используются для изготовления колбас, консервов, сыров и копченостей. Применяются для обработки зерновых культур и приготовления кормов. В кожевенной промышленности смягчают кожу. Являются составляющим компонентом чистящих средств, участвуют в огромном количестве химических процессов в различных производственных областях.
В медицине служат своеобразным диагностическим маркером развития патологических процессов – дисбаланс и признаки активности энзимов способствуют распознаванию природы различных заболеваний в организме.
Существование всего живого на земле обеспечивают процессы биохимических реакций с участием ферментативного катализа. Ферменты по праву считают основным источником здоровья и жизни любых живых организмов.
Автор статьи: детский врач-хирург Ситченко Виктория Михайловна
Удачи вам! До скорых встреч на страницах блога KtoNaNovenkogo.ru
Комментарии и отзывы (1)
Тяжело все это для восприятия, но вот одно я понял, мы состоим из совокупности элементарных организмов. Есть одноклеточные, а мы состоим из огромного числа клеток, а если бы не существовали ферменты, то химия не перешла бы в биологию и никакой жизни бы не было.
Источник
Слово “фермент” имеет латинские корни. В переводе оно означает “закваска”. В английском языке применяется понятие “энзим”, произошедшее от греческого термина, означающего то же самое. Ферментами называют специализированные белки. Они формируются в клетках и имеют способность ускорять течение биохимических процессов. Другими словами, они выступают в качестве биологических катализаторов. Рассмотрим далее, что собой представляет специфичность действия ферментов. Виды специфичности также будут описаны в статье.
Общая характеристика
Проявление каталитической активности некоторых ферментов обуславливается присутствием ряда соединений небелковой природы. Их именуют кофакторами. Они разделены на 2 группы: ионы металлов и ряд неорганических веществ, а также коферменты (органические соединения).
Механизм активности
По своей химической природе ферменты относятся к группе белков. Однако, в отличие от последних, рассматриваемые элементы содержат активный центр. Он представляет собой уникальный комплекс функциональных групп остатков аминокислот. Они строго ориентированы в пространстве благодаря третичной либо четвертичной структуре фермента. В активном центре выделяют каталитический и субстратный участки. Последний – это то, чем обусловлена специфичность ферментов. Субстрат представляет собой то вещество, на которое действует белок. Ранее считалось, что их взаимодействие осуществляется по принципу “ключ к замку”. Другими словами, активный центр должен четко соответствовать субстрату. В настоящее время господствует иная гипотеза. Считается, что точное соответствие изначально отсутствует, однако оно появляется в ходе взаимодействия веществ. Второй – каталитический – участок влияет на специфичность действия. Другими словами, он определяет характер ускоряемой реакции.

Строение
Все ферменты разделяются на одно- и двухкомпонентные. Первые имеют строение, аналогичное структуре простых белков. Они содержат исключительно аминокислоты. Вторая группа – протеиды – включает в себя белковую и небелковую части. Последней выступает кофермент, первой – апофермент. Последний определяет субстратную специфичность фермента. То есть он выполняет функцию субстратного участка в активном центре. Кофермент, соответственно, выступает как каталитическая область. С ним связана специфичность действия. В качестве коферментов могут выступать витамины, металлы, прочие низкомолекулярные соединения.
Катализ
Возникновение любой химической реакции связано со столкновением молекул взаимодействующих веществ. Их движение в системе определяется наличием потенциальной свободной энергии. Для химической реакции нужно, чтобы молекулы приняли переходное состояние. Другими словами, у них должно быть достаточно силы для прохождения энергетического барьера. Он представляет собой минимальный объем энергии для придания всем молекулам реакционной способности. Все катализаторы, ферменты в том числе, способны снижать энергетический барьер. Это способствует ускоренному течению реакции.
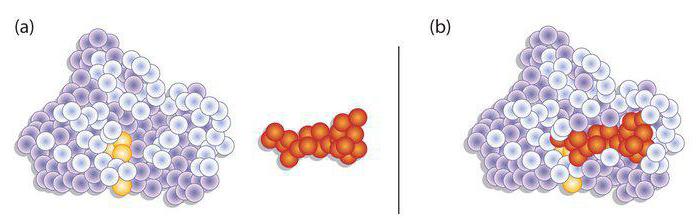
В чем проявляется специфичность ферментов?
Эта способность выражается в ускорении только определенной реакции. Ферменты могут влиять на один и тот же субстрат. Однако каждый из них будет ускорять только конкретную реакцию. Реактивную специфичность фермента можно проследить на примере пируватдегидрогеназного комплекса. В него входят белки, влияющие на ПВК. В качестве основных выступают: пируватдегидрогеназа, пируватдекарбоксилаза, ацетилтрансфераза. Сама реакция именуется окислительным декарбоксилированием ПВК. В качестве ее продукта выступает уксусная активная кислота.
Классификация
Существуют следующие виды специфичности ферментов:
- Стереохимическая. Она выражается в способности вещества влиять на один из возможных субстратных стереоизомеров. К примеру, фумаратгидротаза способна действовать на фумарат. При этом она не влияет на цис-изомер – малеиновую кислоту.
- Абсолютная. Специфичность ферментов этого типа выражается в способности вещества влиять только на конкретный субстрат. К примеру, сахараза реагирует исключительно с сахарозой, аргиназа – с аргинином и так далее.
- Относительная. Специфичность ферментов в этом случае выражена в способности вещества влиять на группу субстратов, имеющих связь одинакового типа. К примеру, альфа-амилаза реагирует с гликогеном и крахмалом. Они имеют связь гликозидного типа. Трипсин, пепсин, химотрипсин влияют на многие белки пептидной группы.
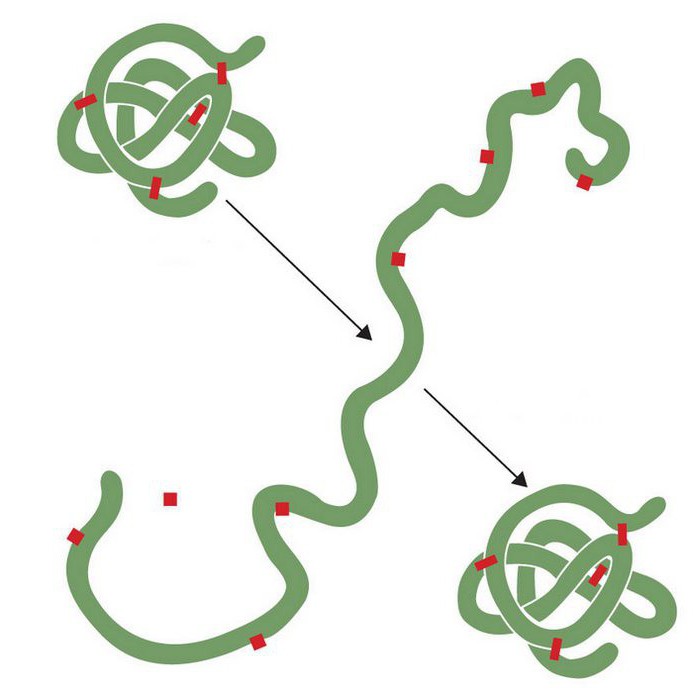
Температура
Ферменты обладают специфичностью в определенных условиях. Для большинства из них в качестве оптимальной принимают температуру +35…+45 град. При помещении вещества в условия с более низкими показателями, активность его будет снижаться. Это состояние именуется обратимой инактивацией. При повышении температуры его способности восстановятся. Стоит сказать, что при помещении в условия, где t будет выше указанных значений, также произойдет инактивация. Однако в этом случае она будет необратимой, поскольку не восстановится при понижении температуры. Это связано с денатурацией молекулы.
Влияние рН
От кислотности зависит заряд молекулы. Соответственно, рН влияет на деятельность активного центра и специфичность фермента. Оптимальный показатель кислотности для каждого вещества свой. Однако в большинстве случаев она составляет 4-7. К примеру, для альфа-амилазы слюны оптимальная кислотность составляет 6.8. Между тем есть и ряд исключений. Оптимальная кислотность пепсина, к примеру, 1.5-2.0, химотрипсина и трипсина – 8-9.
Концентрация
Чем больше будет присутствовать фермента, тем выше скорость реакции. Аналогичный вывод можно сделать и относительно концентрации субстрата. Однако теоретически для каждого вещества определено насыщающее содержание мишени. При ней все активные центры будут заняты имеющимся субстратом. При этом специфичность фермента будет максимальной, вне зависимости от последующего добавления мишеней.
Вещества-регуляторы
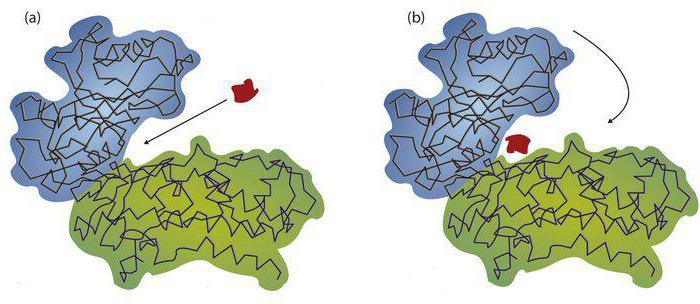
Их можно разделить на ингибиторы и активаторы. Обе этих категории разделяются на неспецифические и специфические. К автиваторам последнего типа относят желчнокислые соли (для липазы в поджелужочной железе), хлорные ионы (для альфа-амилазы), соляную кислоту (для пепсина). Неспецифическими активаторами являются ионы магния, влияющие на киназы и фосфатазы, а специфическими ингибиторами – концевые пептиды проферментов. Последние представляют собой неактивные формы веществ. Они активируются при отщеплении концевых пептидов. Их определенные типы соответствуют каждому отдельному проферменту. К примеру, в неактивном виде трипсин вырабатывается в виде трипсиногена. Его активный центр закрывается концевым гексапептидом, который является специфическим ингибитором. В процессе активации происходит его отщепление. Активный центр трипсина в результате этого становится открытым. Неспецифическими ингибиторами являются соли от тяжелых металлов. К примеру, сульфат меди. Они провоцируют денатурацию соединений.
Ингибирование
Оно может быть конкурентным. Такое явление выражается в возникновении структурного сходства между ингибитором и субстратом. Они вступают в борьбу за связь с активным центром. Если содержание ингибитора выше, чем субстрата, формируется коплексфермент-ингибитор. При добавлении вещества-мишени соотношение поменяется. В результате ингибитор будет вытеснен. К примеру, сукцинат для сукцинатдегидрогеназы выступает как субстрат. Ингибиторами являются оксалоацетат или малонат. Конкурентными считаются влияния продуктами реакции. Зачастую они похожи на субстраты. К примеру, для глюкозо-6-фосфат продуктом является глюкоза. Субстратом же будет выступать глюкозо-6 фосфат. Неконкурентное ингибирование не предполагает структурного сходства между веществами. Ингибитор и субстрат одновременно могут связываться с ферментом. При этом идет образование нового соединения. Им является комплексфермент-субстрат-ингибитор. В ходе взаимодействия происходит блокирование активного центра. Это обуславливается связыванием ингибитора с каталитическим участком АЦ. Примером может служить цитохромоксидаза. Для этого фермента в качестве субстрата выступает кислород. Ингибиторами цитохромоксидазы являются соли синильной кислоты.
Аллостерическая регуляция
В некоторых случаях, кроме активного центра, определяющего специфичность фермента, присутствует еще одно звено. В качестве него выступает аллостерический компонент. Если с ним связывается одноименный активатор, действенность фермента повышается. Если же в реакцию с аллостерическим центром вступает ингибитор, то активность вещества, соответственно, снижается. К примеру, аденилатциклаза и гуанилатциклаза относятся к ферментам с регуляцией аллостерического типа.
Источник
