Какими способами можно собирать водород в пробирку на каких свойствах

Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения – приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту – безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда – халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:

На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:

Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой

Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы

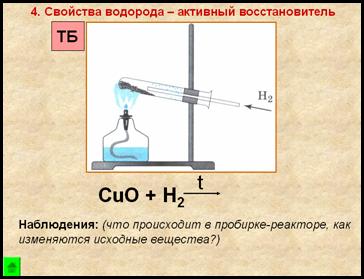
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
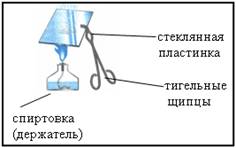
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
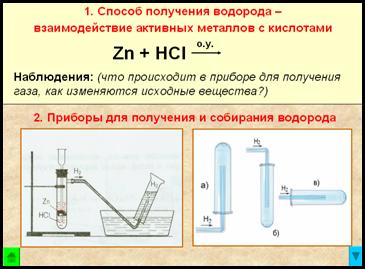
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q – при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
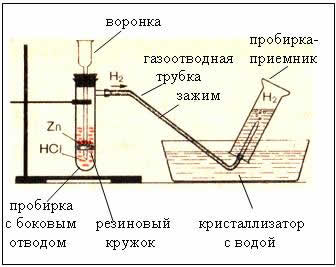
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
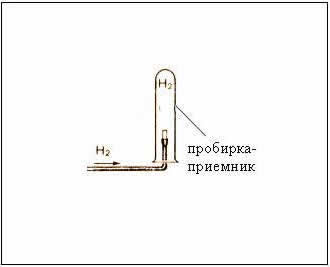
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
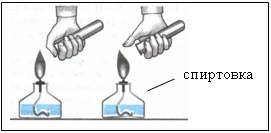
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
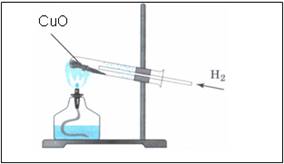
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Источник
Вариант 1
Опыт 1
Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1-2 гранулы цинка и прилейте в неё 1-2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 76) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если “лающий” звук – водород собран в смеси с воздухом, т. е. в пробирке собран “гремучий газ”.
Вопросы и задания:
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Опыт 2
Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 168, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте её пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстая!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Сначала 2-3 движениями пламени прогрейте всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревайте только в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем, погрузите пробирку отверстием вниз в сосуд с водой и освободите отверстие пробирки. Что вы наблюдаете? Почему вода в пробирке поднялась? Закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Переверните пробирку и добавьте в неё 2-3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания:
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Вариант 2
Опыт 1
Получение, собирание и распознавание кислорода.
Соберите прибор, как показано на рисунке 109, и проверьте его на герметичность. Пробирку примерно на ¼ объёма заполните перманганатом калия KMnO4, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода.
Сначала 2-3 движениями пламени прогрейте всю пробирку с KMnO4, а затем нагревайте только в том месте, где находится вещество.
Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
Вопросы и задания:
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Опыт 2
Получение, собирание и распознавание оксида углерода (IV).
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1-2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2-3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания:
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте её характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведённую реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, каким способом вы распознавали оксид углерода (IV).
Ответ
Вариант 1
Опыт 1
1) При взаимодействии цинка с соляной кислотой выделяется газ:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Реакция замещения, экзотермическая, необратимая, гетерогенная, некаталитическая, окислительно-восстановительная.
| 2) Zn + 2HCl ⟶ ZnCl2 + H2↑ | ||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Zn0 – 2ē ⟶ Zn+2 | 1 | восстановитель (окисление) |
3) Водород при нормальных условиях – газ, не имеющий цвета и запаха, который легче воздуха.
4) Распознать водород можно по звуку горения в пробирке, если в пробирке находится чистый водород, то раздастся глухой хлопок, если “лающий” звук – водород собран в смеси с воздухом, т. е. в пробирке собран “гремучий газ”.
Опыт 2
1) При взаимодействии хлорида аммония и гидроксида кальция образуется аммиак:
2NH4Cl + Ca(OH)2 ⟶ CaCl2 + 2NH3↑ + 2H2O
2NH4+ + 2Cl- + Ca2+ + 2OH- ⟶ Ca2+ + 2Cl- + 2NH3↑ + 2H2O
NH4+ + OH- ⟶ NH3↑ + H2O
2) Аммиак при нормальных условиях – газ, который легче воздуха, не имеющий цвета, обладающий резким запахом.
3) Распознать аммиак можно по запаху и с помощью раствора фенолфталеина, в при растворении аммиак окрасит его в малиновый цвет.
Вариант 2
Опыт 1
1) При нагревании перманганата калия он разлагается с образованием кислорода:
2KMnO4 t ⟶ K2MnO4 + MnO2 + O2↑
Реакция разложения, эндотермическая, необратимая, гетерогенная, некаталитическая, окислительно-восстановительная.
| 2) 2KMnO4 t ⟶ K2MnO4 + MnO2 + O2↑ | ||
| Mn+7 + 3ē ⟶ Mn+4 | 1 | окислитель (восстановление) |
| Mn+7 + 1ē ⟶ Mn+6 | ||
| 2O-2 – 4ē ⟶ O20 | 1 | восстановитель (окисление) |
3) Кислород при нормальных условиях – газ, не имеющий цвета и запаха, который тяжелее воздуха.
4) Наличие кислорода в сосуде подтвердили с помощью тлеющей лучинкой, она вспыхнула.
Опыт 2
1) При взаимодействии мела с соляной кислотой выделяется углекислый газ:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
Реакция обмена, экзотермическая, необратимая, гетерогенная, некаталитическая, не окислительно-восстановительная.
2) CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
3) Оксид углерода (IV) при нормальных условиях – газ, не имеющий цвета и запаха, который тяжелее воздуха.
4) Распознали оксид углерода (IV) с помощью известковой воды, в результате реакции образовался осадок белого цвета:
CO2 + Ca(OH)2 ⟶ CaCO3 + H2O
Источник
- Главная
- Вопросы & Ответы
- Вопрос 4201449
Зачетный Опарыш
более месяца назад
Просмотров : 12
Ответов : 1
Лучший ответ:
Мари Умняшка
1)Вытеснением воздуха, пробирка вверх дном, так как Н2 легче воздуха
2) вытеснением воды, так как Н2почти не растворяется в воде
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Онтонио Веселко
С какими из перечисленных веществ взаимодействует гидроксид натрия: серная кислота, гидроксид кальция, оксид карбона (VI), хлорид калия, нитрат ферума (II). Запишите уравнения возможных реакций.
более месяца назад
Смотреть ответ
Просмотров : 23
Ответов : 1
Мари Умняшка
Косинус и синус вообще не понимаю…определения все знаю, но применять не умею, кому не сложно объяснените
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Главный Попко
(а-в) (а+в) осы формуламен есептер шыгару
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
Пармезан Черница
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
Энджелл
Какое уравнение называется линейным? приведите пример линейного уравнения.
более месяца назад
Смотреть ответ
Просмотров : 21
Ответов : 1
Источник
