Какими свойствами будет обладать полипептид
1. Запишите формулу дипептида, образованного двумя молекулами аминокислот.
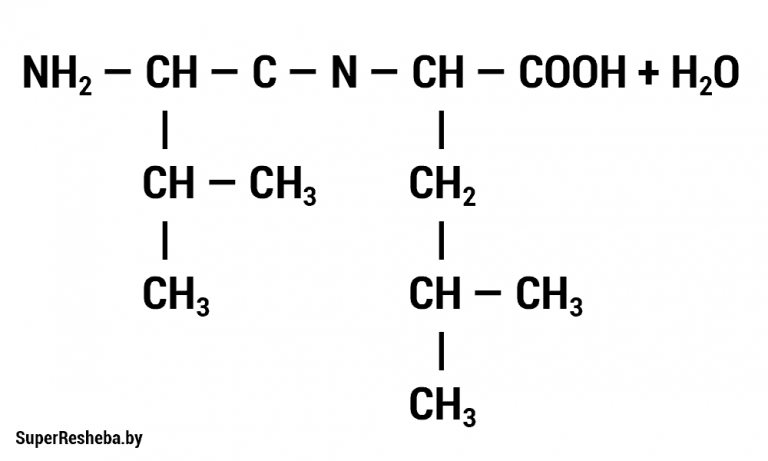
2. В состав полипептида входят следующие аминокислоты: аланин, лизин, глутаминовая кислота. Какими свойствами будет обладать полипептид — гидрофильными или гидрофобными? Ответ поясните. Формулы данных аминокислот приведены в учебнике (с. 19, рис. 6).
Полипептид будет гидрофильным.
3. Альбумин сыворотки крови человека имеет относительную молекулярную массу 68 400. Определите количество аминокислотных остатков в молекуле этого белка, принимая во внимание, что средняя относительная молекулярная масса одной аминокислоты равна 120.
$dfrac{68400}{120} = 570$ (аминокислотных остатков).
4. Определите, сколько остатков глюкозы содержится в моле- куле гликогена, если его относительная молекулярная масса составляет примерно $1.62 · 10^6.$
$1.62 · dfrac{10^6}{162} = 10 000$ (остатков глюкозы).
5. Рассчитайте, сколько граммов глицерина было израсходовано клетками организма на синтез жира, если известно, что при этом было затрачено 21 моль высших карбоновых кислот.
На 1 моль глицерина приходится 3 моль кислот. Было использовано 7 моль глицерина. $M(mathrm{C_3H_8O_3}) = 92$ г/моль.
6. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 20 %. Определите процентное содержание остальных нуклеотидов в этой ДНК.
Гуаниловых кислот — 20 %; адениловых — 30 %; тимидиловых — 30 %.
7. Фрагмент молекулы ДНК содержит 280 остатков цитидиловых нуклеотидов, что составляет 14 % от общего количества нуклеотидов. Определите длину данного фрагмента молекулы ДНК.
Ц + Г = $560;$ А + Т = $72 % = 1440;$ $dfrac{560 + 1440}{2} = 1000;$ длина фрагмента равна $340$ нм.
8. Фрагмент молекулы ДНК состоит из 5760 нуклеотидов, из них 1125 тимидиловых нуклеотидов. Определите количество адениловых, гуаниловых и цитидиловых нуклеотидов в данном фрагменте молекулы ДНК.
А = Т = $1125;$ $5760 – 1125 – 1125 = 3510;$ Г = Ц = $dfrac{3510}{2} = 1755.$
9. Длина фрагмента молекулы ДНК равна 68 нм, что составляет 10 % от длины всей молекулы. На долю адениловых нуклеотидов в данной молекуле ДНК приходится 12 %. Определите относительную молекулярную массу фрагмента молекулы ДНК, принимая во внимание, что относительная молекулярная масса одного нуклеотида равна 354, и число всех видов нуклеотидов в данной молекуле ДНК.
$dfrac{68,нм}{0.34,нм} = 200;$ $200 · 354 = 70 800.$
10. У исследователя есть три молекулы ДНК одинаковой длины. Известно, что содержание тимидиловых нуклеотидов (Т) в первом образце составляет 20 % от общего числа нуклеотидов, во втором — 36 %, в третьем — 8 %. Исследователь начал нагревать данные молекулы ДНК, постепенно повышая температуру. При этом происходило отделение комплементарных цепей друг от друга — так называемое плавление ДНК. Какой образец начал плавиться первым, а какой расплавился в последнюю очередь? Почему?
Поскольку во втором образце содержится меньше Г–Ц (потому как больше тимидиловых нуклеотидов), он начал плавится первым, а в последнюю очередь расплавился третий, где содержание Г–Ц наибольшее (тимидиловых нуклеотидов наименьшее).
Источник
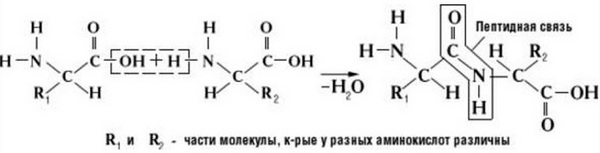
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
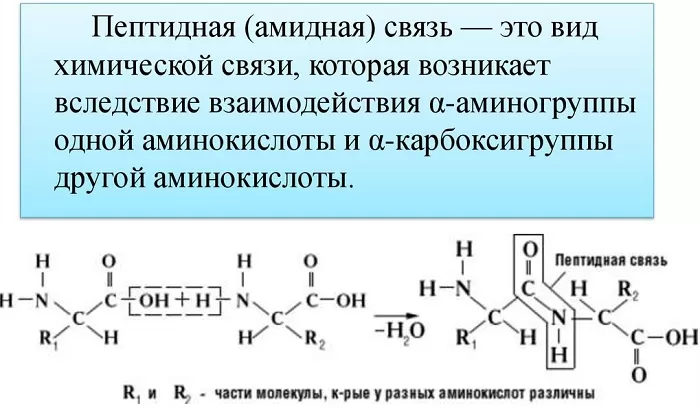
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами – строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
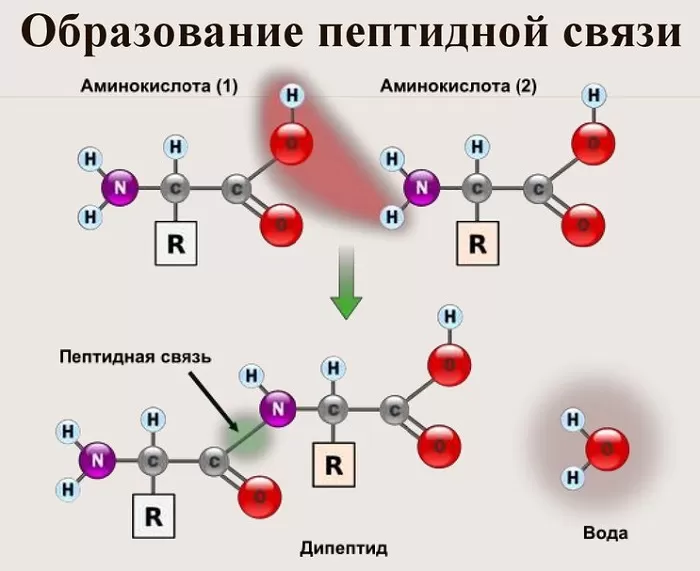
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Свойства:
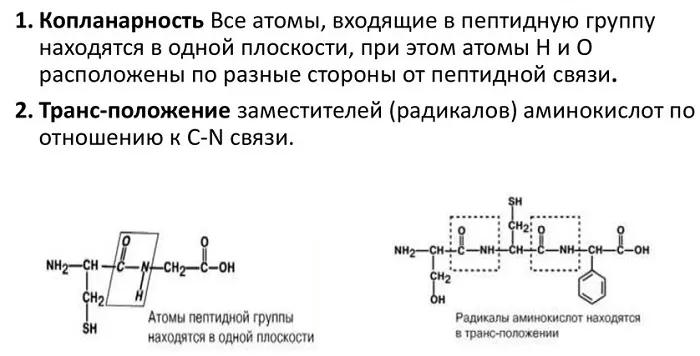
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
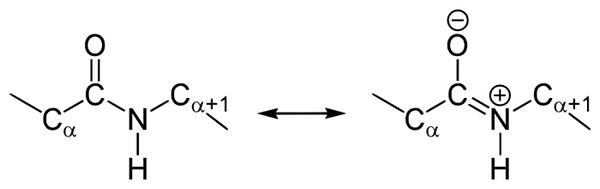
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
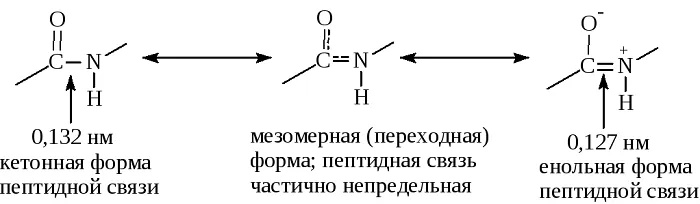
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
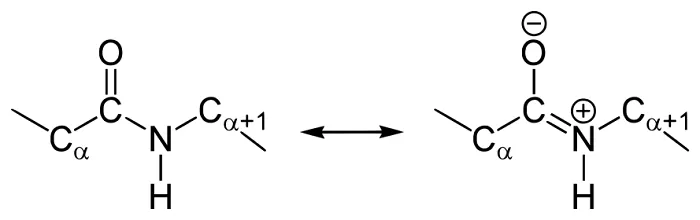
Строение пептидной связи
В амидной группе -СО-NH- углеродный атом существует в форме sp2-гибридизации. Неподеленная пара электронов атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом.
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
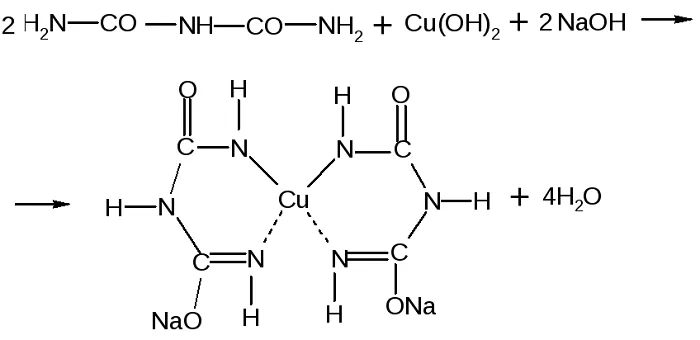
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Источник
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Что такое пептидная связь?
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование пептидной связи
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
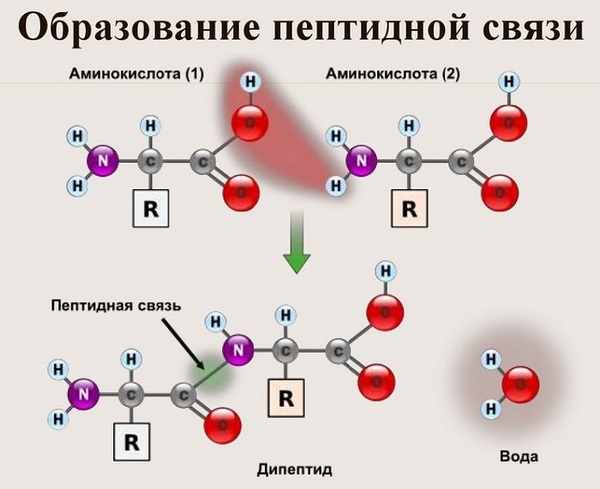
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение пептидной связи
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp2-гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения пептидных связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
- Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983″. European Journal of Biochemistry. 138 (1): 9–37. 1984. doi:10.1111/j.1432-1033.1984.tb07877.x. ISSN 0014-2956.
- Muller, P (1994-01-01). “Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. ISSN 1365-3075.
- Watson J, Hopkins N, Roberts J, Agetsinger Steitz J, Weiner A (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- Miller BR, Gulick AM (2016). “Structural Biology of Nonribosomal Peptide Synthetases”. Methods in Molecular Biology. 1401: 3–29. doi:10.1007/978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
- Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.
Пептидная связь, видео

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Тема: Аминокислоты, пептиды, белки.
Цели урока:
- Обобщить и закрепить знания учащихся о
химической организации клетки, строении и
функциях белков и пептидов, роли водородных
связей в образовании белков. - Продолжить формирование умения проводить опыт
и делать соответствующие выводы с привлечением
знаний, полученных на предшествующих уроках. - Углубить и расширить представления учащихся о
функциях белков, их биологической значимости для
живых организмов. - Закреплять навыки выполнения тестовых заданий
уровня А, В, С.
Оборудование: таблицы «Аминокислоты»,
«Структура белков», плакаты «Структурная
классификация аминокислот», штатив, пробирки,
колбы, раствор яичного белка, реактивы Na OH, CuSO4,
HNO3,медный купорос, ацетат свинца, капельница,
пипетка, сухое горючее или грелка.
Основные понятия:
План урока
I. Фронтальный опрос по теме «Пептиды,
аминокислоты, белки»
- Индивидуальные задания по дидактическим
карточкам (2–3 человека письменно) - Индивидуальная работа у доски «Решение задач» (2
человека письменно) - Работа с плакатом «Функции белков». Найти
соответствие, убрать «лишнее» (письменно) - Коллективная работа по вопросам с применением
опорных конспектов, основных понятий и
демонстрацией опытов (устно)
II. Самостоятельная работа. Тест с уровнем
знаний А, В, С
III. Сообщения учащихся
- Болезни, обусловленные нарушением синтеза
функционирования белков - Протеомика
- Белковая инженерия
- Белковое питание и здоровье
IV. Заключение. Резюме
V. Подведение итогов
Оцениваются:
4–5 человек за индивидуальную работу
2 – за решение задач
3–4 – за сообщение
2–4 – за демонстрацию опытов
Все за тестовые задания.
ХОД УРОКА
Учитель: Белки являются
важными химическими соединениями, входящими в
состав всех живых клеток и живых организмов с
функционированием белков связано формирование
признаков, характерных для всех клеток и всего
организма. Нарушение строения и
функционирования белков может привести к
заболеваниям. Цель нашего урока – обобщить,
повторить материал по теме «Пептиды и белки», так
как в ЕГЭ встречается много вопросов по данной
теме, и выявить пробелы. Работаем индивидуально,
попарно, коллективно по желанию.
1. Индивидуальное задание по дидактическим
карточкам (письменно)
Карточка №1
Карточка №2
| Рассмотрите общую формулу и строение некоторых аминокислот. а) Какими свойствами б) В чем сходство и отличие в строении | Ответ учащегося: 1. 2. Отличаются аминокислоты по радикалу, 3. Уникальность свойств аминокислот |
2. Индивидуальная работа у доски. Решение
задач
Задание №1
| Молекулярная масса белка 100000. Определить длину гена. | Решение учащихся: Мм Ответ: длина гена 1020 нм |
Задание №2
| Участок молекулы ДНК кодирующий часть полипептидной цепи имеет строение Ц–А–Т–Т–Т–Т–Г–А–Т. Определить какими аминокислотами закодирована цепь ДНК | Решение учащихся: Одна Ответ: вал-лиз-лей |
3. Работа с плакатом «Функции белков» на
магнитной доске.
Определить группу белков по выполняющей
функции и исключить лишнее
| Ответ учащихся: | |||
| Белок | Функции | Лишнее | |
| 1. коллаген 2. мукопротеин 3. гемоглобин 4. эластин 5. кератин 6. тубулин 7. флагелин 8. актин 9. меозин 10. альбулин 11. оксин 12. фитохром 13. гликопротеины 14. цитохромы | 15. интерферон 16. антитела 17.. тромбопластин 18..тромбин 19. гемоцианин 20. инсулин 21. самотропин 22. миоглобин 23. нейропептиды 24. каталаза 25. амилаза 26. пепсин 27. ферритин 28. трипсин | 1. Строительная или структурная: 1,2,4,5 2. Двигательная: 6,7,8,9 3. Реципторная: 11,12,13 4. Защитная: 15,16,17,18 5. Регуляторная: 20,21,23 6. Ферментативная: 24,25,26,28 | Транспортная – 3 Запасающая транспортная – 10 Транспортная – 14 Транспортная – 19 Запасающая – 22 Запасающая – 27 |
В это время остальные дети работают
коллективно по вопросам.
4. Фронтальная работа по вопросам
(вопрос – ответ)
1. Что такое пептиды и белки?
Ответ учащегося: Линейные полимеры,
состоящие из остатков аминокислот, соединенных
друг с другом пептидными связями. Цепи из
небольшого числа аминокислотных остатков –
пептиды, а цепи состоящие более чем из 10
аминокислотных остатков называются полипептиды
или белки.
2. Как вы понимаете простые и сложные
белки?
Ответ учащегося: Простые содержат
только аминокислотные остатки. Сложные содержат
еще и неаминокислотные компоненты: производные
витаминов, углеводные и липидные компоненты..
3. Полипептид глюкагон состоит из 29
аминокислотных остатков.
На доске представлен фрагмент белка глюкагона.
Проанализируйте и ответьте на вопрос: От чего
зависит структура и физикохимические свойства
белков и пептидов?
Ответ учащегося: От числа, химической
структуры и порядкового расположения
аминокислотных остатков.
4. Какие функциональные группы входят
в состав аминокислот? (использование таблицы)
Ответ учащегося Аминная группа NH2,
карбоксильная группа СООН, радикал. Все они
соединены с а-углеродным атомом. В природе
существует около 300 аминокислот, в природные
белки входят 20 аминокислот.
5. Какими свойствами обладают
аминокислоты?
Ответ учащегося: амфотерными, т.к.
аминогруппа придает аминокислоте основные
свойства, а карбоксильная группа – кислотные
свойства. По радикалу все аминокислоты
отличаются друг от друга, т.к. радикал может
содержать СН3, СООН, NH2 и другие
химические группировки.
6. Как опытным путем доказать, что в
белке имеются циклические аминокислоты, радикал
которых содержит бензольные кольца.
Учащийся показывает опыт.
Опыт №1. С помощью ксантопротеиновой
реакции (греч. Хаntos – желтый). К 5 каплям 1%
раствора яичного белка добавляем 3 капли
концентрированной азотной кислоты (осторожно!) и
нагреваем. Появился осадок желтого цвета. После
охлаждения в пробирку добавляем 5–10 капель 10%
раствора едкого натра до появления оранжевого
окрашивания (связано с образованием натриевой
соли этих нитросоединений).
7. На какие три группы можно
классифицировать аминокислоты?
Ответ учащегося: структурную,
электрохимическую, биологическую.
8. Используя таблицу, ответьте на
вопрос: На чем основана каждая классификация
а) структурная – на особенностях строения
радикала выделяют алифатические незамещенные,
амифатические замещенные, циклические
аминокислоты (Приложение 2.
Таблица №1)
б) электрохимическая классификация строится по
кислотно-основным свойствам радикала
аминокислот (Приложение 2.
Таблица № 2)
1. Кислые аминокислоты в радикале имеют
дополнительную группу СООН–, ОН–, НS–
2. Основные аминоркислоты имеют в радикале
дополнительную группу NH2, гуанидиновую или
имидазольную.
3. Нейтральные аминокислоты имеют радикал не
проявляющий ни те ни другие свойства. Кислые и
основные аминокислоты объединяются в группу
полярных (гидрофильных) аминокислот. Сюда же
входят нейтральные аминокислоты, радикалы
которых полярны и образуют водородные связи с
молекулой Н2О (связь С–О; С–N, О–Н, S–Н),
остальные неполярные или гидрофобные.
в) биологическая классификация распределяет
аминокислоты на группы по степени незаменимости
их для организма человека (Приложение
2. Таблица №3).
1. Незаменимые не могут синтезироваться
организмом, у животных и человека 8 аминокислот, у
крыс и мышей добавляется еще гистидин, а у кур –
аргинин, гистидин, тирозин;
2. Частично заменимые, синтезируются сложным
путем в организме;
3. Условно заменимые для синтеза необходимы
незаменимые кислоты. Например, для синтеза
тирозина требуется фенилаланин, цестина –
метионин;
4. Заменимые синтезируются в организме.
Углеродный скелет аминокислот образуется из
глюкозы, а универсальным донором аминогруппы
служит глутаминовая кислота.
Учитель. Кроме 20 стандартных
аминокислот в белках живых организмов
встречается необычная кислота – селеноцистеин.
Она похожа на цистеин, но вместо атома серы в ее
радикале расположен атом селена.
Селеноцистеин обнаружен у разных
организмов от древнейших бактерий до человека.
Он входит в состав ферментов и в последние годы
рассматривается как 21 белковая кислота,
шифруется в ДНК и РНК. В РНК кодируется триплетом
УГА. Этот триплет означает окончание трансляции,
но если он окружен особыми сочетаниями
триплетов, то в рибосоме с этим триплетом
взаимодействует транспортная РНК. Так же в
организме животных и человека встречаются
аминокислоты, которые не входят в состав белков,
но имеют важное биологическое значение.
Например, тироксин, гормон щитовидной железы
является производным тирозина, -аминомаляная кислота (ГАМК) одним
из нейромедиаторов.
9. Физические свойства аминокислот?
– Легко растворяются в полярных растворителях
(вода, этанол).
– Не растворяются в неполярных растворителях
(эфир, бензол, гексан).
– Имеют высокую температуре плавления > 200оС.
– Не поглощают свет в видимой области спектора,
поэтому бесцветны.
10. Какие уровни организации белков
имеются в природе и какими связями обусловлены?
– Первичная, вторичная, четверичная структуры
связи: пептидные, водородные, гидрофобные,
ионные, дисульфидные, глобулярные.
11. Каким опытным путем доказать
пептидную связь?
– Биуретовая реакция на определение пептидной
связи. Метод основан на способности пептидной
связи в щелочной среде образовывать с сульфидом
меди окрашенные комплексные соединения.
Опыт 2 (учащийся)
В пробирке вносим 5 капель 1% раствора яичного
белка (вначале профильтровали через марлю и
развели с дистиллированной водой 1:10), три капли 10%
раствора гидрооксида натрия и 1 каплю сульфата
меди, все перемешиваем. Содержимое приобретает
фиолетовое окрашивание.
Раствор белка + NaОН + СuSО4 ––> фиолетовое
окрашивание. Пептидная связь по своей природе
является прочной ковалентной связью между
атомом углерода карбоксильной
–СО – NH –, или ,
располагаются в одной плоскости. Пептидная связь
характерна для первичной структуры белка, где
аминокислоты белков располагаются линейно. I –
структура отличается количеством аминокислот,
последовательностью и соотношением радикалов.
При записи последовательности N конец
записывается слева, а С конец справа.
12. Что собой представляет вторичная
структурна белка?
– II структура полипептидная цепь уложенная
определенным образом с многочисленными
водородными связями между атомами пептидных
групп.
Различают 2 вида структур: -спираль, -складчатый
слой.
-спираль имеет спиральную
конфигурацию (жесткого цилиндра) образуется
водородными связями, в связях участвуют все
пептидные группы СО и NH, радикалы не участвуют в
образовании спирали. Спираль устойчива, высота
одного витка 0,54 нм, в один виток входит 3,6 – 4
аминокислот.
-складчатый
слой имеет вид изогнутой цепи, формируется с
помощью водородных связей между водородом NH и
кислородом СО-групп двух аминокислотных
остатков, находящихся на большом расстоянии друг
от друга. Радикалы могут располагаться как с
наружной так и внутренней сторон.
13. Что собой представляет третичная и
четвертичная структура белка?
– III структура – спираль, уложенная в глобу
(шарик). Связи возникают между радикалами. Они
могут быть разными:
а) гидрофобными – неполярные радикалы
собираются в группы, оттесненные молекулами воды
(связь водородная между молекулами воды);
б) ионные или солевые – между полярными
радикалами;
в) дисульфидные – между радикалами, содержащими
серу (цистеин). Это прочные связи по природе
ковалентные;
г) Ван-дер-Ваальсовы силы – взаимодействие
электрически нейтральных молекул или атомов.
– IV структура – агрегат, состоящий из 2-х или
более полипептидных цепей, связанных между собой
нековалентными связями.
14. Приведите примеры белков III и IV
структур, относящихся к разным классам.
– III структура:
1) фибриллярные белки – вытянутые в виде
волокна, например, фиброин – белок
натуральногошелка;
2) мембранные белки – расположенные в мембране,
например, рецепторы гармонов, натриевые и
калиевые каналы, порин, родопсин;
3) глобулярные – растворимые в воде, шаровидные.
Миозин – заканчивается глобой.
– IV структура – гемоглобин
15. Какими свойствами обладают белки?
– Белки
1) амфотерные – проявляют и кислые и основные
свойства
2) гидрофобные и гидрофильные
3) обладают буферностью – поддерживают
концентрацию ионов водорода на постоянном
уровне
4) белки способны к самосборке
5) стабильность характерна белкам
6) спецефичность характерна белкам
7) способны к обратным конформационным
изменениям
8) денатурация – разрушение II, III, IV структур под
действием физических и хзимических факторов с
сохранением первичной структуры
9) ренатурация – восстановление
пространственной структуры и биологической
активности, если не нарушена I структура белка.
Опыт 3. Денатурация белка
Куриный белок растворяем в 150 мл воды. Наливаем
в пробирку 4–5 мл раствора и нагреваем на горелке
до кипения. Раствор помутнел, т.к. белок
денатурировал. Получившийся осадок при
нагревании не растворяется при охлаждении и
разбавленный водой, значит обратного процесса –
ренатурации не происходит, т.к. разрушена I
структура белка.
16. Какие функции в клетке выполняют
белки? Приведите примеры.
1. Двигательная – актин, миозин, белок мышц;
тубулин образованы микротрубочкой клеток;
флагмин – в состав жгутиков бактерий;
динеин, кинезин – молекулярные двигатели.
2. Транспортная – гемоглобин – перенос О2
и Н2О;
ферритин – транспортирует ионы железа;
транспортные белки мембран образуют ионные
каналы для перемещения Na+, К+.
3. Рецепторная – рецептор инсулина, глюкагон,
т.е. белковые гормоны.
4. Защитная – антитела, протромбин, фибриноген;
лизоцим – содержащийся в слюне;
муцин – в слюне и желудке.
5. Структурная – кератин, белок, волос, перьев
птиц, когтей пресмыкающихся и зверей.
Коллаген – входит в состав сухожилий.
Гистоны – белки ДНК.
6. Энергетическая – 1 г белка – 17,6 кДж.
7. Ферментативная – не всегда белки ферменты, но
все ферменты – белки.
Ферменты – биологические катализаторы
17. Какими свойствами обладают белки и
при каких условиях функционируют?
1) высокая эффективность действия
2) специфичность действия
3) способность к регуляции
Ферменты функционируют при строго определенных
условиях в определенном диапазоне температуры,
кислотности среды, концентрации ионов и т.д.
18. В каких случаях белок применяется
как противоядие?
– При отравлении солями тяжелых металлов.
Опыт 4. В две пробирки наливаем по 1–2
капли раствора белка и медленно при встряхивании
по каплям добавляем в 1 пробирку насыщенный
раствор медного купороса, а в другую – ацетата
свинца. В пробирке образовалось
труднорастворимое солеобразное соединение
белка. Данный опыт иллюстрирует применение
белка, как противоядие при отравлении солями
тяжелых металлов.
II. Самоятоятельная работа. Тест с
заданиями уровня А, В, С (проверить можно
взаимопроверкой или индивидуально) (Приложение 4)
III. Сообщения учащихся (Приложение
1)
1. Болезни, обусловленные нарушением синтеза
функционирования белков.
2. Протеомика.
3. Белковая инженерия.
IV. Заключение. Резюме
Белки являются важнейшими химическими
соединениями, функционирующими в клетке и
организме. Благодаря уникальным особенностям
