Какими свойствами характеризуется молекула качественным составом
2.3. Молекулы. Химические формулы.
Молекулярные массы. Элементный состав веществ
Атомы
могут соединяться друг с другом. В результате этого соединения обычно
образуются более сложные частицы – молекулы. Например:
Эти
примеры показывают, что соединяться друг с другом могут атомы одного элемента и
атомы разных элементов. Число атомов, которые соединяются друг с другом, может
быть различным.
Состав
любой молекулы можно выразить химической
формулой.
Так,
молекула водорода имеет формулу Н2
. Число «2» в этой формуле показывает число атомов водорода в
молекуле водорода.
Числа
в химических формулах, которые показывают, сколько атомов данного элемента
входит в состав молекулы, называются индексами.
Молекула
хлороводорода
имеет формулу НСl, так как
она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет
формулу Н2О. Эта формула
показывает, что молекула воды состоит из двух атомов водорода и одного атома
кислорода.
Таким
образом, химические формулы показывают качественный и количественный состав
молекулы.
Согласно
закону постоянства состава (Ж.
Пруст, Франция, 1808 г.):
Каждое чистое
вещество имеет постоянный качественный и количественный состав, который не
зависит от способа получения вещества.
Так
как вещество состоит из одинаковых молекул, то состав молекулы определяет
состав всего вещества. Различия в химических свойствах веществ обусловлены
различиями в составе и строении молекул, из которых состоят эти вещества.
Поэтому можно сделать вывод:
Молекула – это
наименьшая частица вещества, которая сохраняет его химические свойства.
Масса
любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы
молекулы используются относительные атомные массы, то получается относительная
молекулярная масса, которая обозначается символом Мr.
Например,
относительная молекулярная масса воды Н2О равна:
Относительная
молекулярная масса сульфата железа (III)равна:
Относительная
молекулярная масса вещества Мr – это число,
которое показывает, во сколько раз абсолютная масса молекулы данного вещества
больше 1/12 части абсолютной массы атома углерода С.
Например,
относительная молекулярная масса воды Мr
(Н2О)= 18. Это значит, что масса молекулы воды в 18 раз больше 1/12
части массы атома углерода.
Относительные
молекулярные массы, как и относительные атомные массы, являются величинами
безразмерными.
По
формуле вещества можно рассчитать массовую долю каждого химического элемента,
который входит в состав вещества.
Массовая доля (w) химического элемента в данном веществе равна
отношению относительной атомной массы данного элемента, умноженной на число его
атомов в молекуле, к относительной молекулярной массе вещества:
Массовые
доли обычно выражаются в процентах:
Рассчитаем,
например, массовые доли водорода и кислорода в воде Н2О:
УПРАЖНЕНИЯ
1.
Рассчитайте
массовую долю марганца в оксиде марганца (VII).
Решение: Молярные массы веществ равны: М(Mn) = 55
г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222
г/моль. Следовательно, масса Mn2O7 количеством вещества 1 моль
составляет:
m(Mn2O7) = M(Mn2O7)·n(Mn2O7)
= 222·1= 222 г.
Из
формулы Mn2O7следует, что количество вещества атомов
марганца в два раза больше количества вещества оксида марганца (VII). Значит,
n(Mn) = 2n(Mn2O7)
= 2 моль,
m(Mn)= n(Mn)·M(Mn) = 2·55
= 110 г.
Таким
образом, массовая доля марганца в оксиде марганца(VII) равна:
ω(X)=m(Mn) : m(Mn2O7)
= 110:222 = 0,495 или 49,5%.
_______________________________________________________________
2.
Определите массовую долю кристаллизационной воды в дигидрате хлорида
бария BaCl2 • 2H2O.
Решение: Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль.
Из формулы BaCl2 • 2H2O следует, что 1 моль
дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить
массу воды, содержащейся в BaCl2 • 2H2O: m(H2O) = 2 • 18 = 36 г. Находим
массовую долю кристаллизационной воды в дигидрате хлорида бария
BaCl2 • 2H2O. ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 =
14,75%.
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какие частицы обычно образуются в
результате соединения атомов.
2.
Чем можно выразить состав любой
молекулы.
3.
Что показывают химические формулы
4.
Чему равна масса молекулы
5.
Чему равна массовая доля данного
элемента в данном веществе.
6.
Опишите качественный м
количественный состав молекул следующих веществ: метан СН4, сода Na2CO3,
глюкоза C6H12O6
, хлор Cl2
, сульфат алюминия Al2(SO4)3.
7.
Молекула фосгена состоит из одного
атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины
состоит из одного атома углерода, одного атома кислорода и двух атомных групп
NH2. Напишите формулы фосгена и мочевины.
8.
Подсчитайте общее число атомов в
следующих молекулах:
Рассчитайте относительные
молекулярные массы веществ, которые указаны в упражнении 6.
.
Чему равны массовые доли элементов в следующих
веществах:
В
каком из этих веществ массовая доля азота наибольшая и в каком – наименьшая.
1. Про молекулу нельзя сказать, что она: | |
а) сохраняется в химических реакциях | б) носитель химических свойств |
в) разрушается в химических реакциях | г) имеет тот же качественный состав, |
2. Нельзя утверждать, что в состав молекулы воды | |
а) два атома Н и один атом О | б) молекула Н2 и один атом |
в) атомы различных химических | г) атомы Н и О в массовом соотношении |
3. Какими свойствами | |
а) качественным составом | б) строением |
в) количественным составом | г) электрической проводимостью |
4. Что одинакового для молекул НСl и | |
а) масса | б) массовая доля водорода |
в) качественный состав | г) число атомов в молекуле |
5. Что показывает химическая формула H2SO4: | |
а) одну молекулу серной кислоты | б) относительную атомную массу серной |
в) нет верного ответа | г) пространственное строение молекулы |
6. Какие свойства характеризуют и молекулу, и | |
а) качественный состав | б) электрическая проводимость |
в) физические свойства | г) агрегатное состояние |
7. Массовая доля хлора в его оксиде равна 59,66 %. | |
а) Cl2O | б) Cl2O3 |
в) Cl2O5 | г) Cl2O7 |
8. Какова формула оксида железа, в котором массовая | |
а) FeO | б) Fe2O3 |
в) Fe3O4 | г) FeO3 |
9. Какова массовая | |
а) 11 | б) 10 |
в) 15 | г)12 |
10. Рассчитайте массовую долю фосфора в веществе H3PO4: | |
а) 32 | б) 65 |
в) 36 | г) 17 |
Ответы:
1 | а |
2 | б |
3 | г |
4 | г |
5 | а |
6 | а |
7 | б |
8 | б |
9 | а |
10 | а |
Источник
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
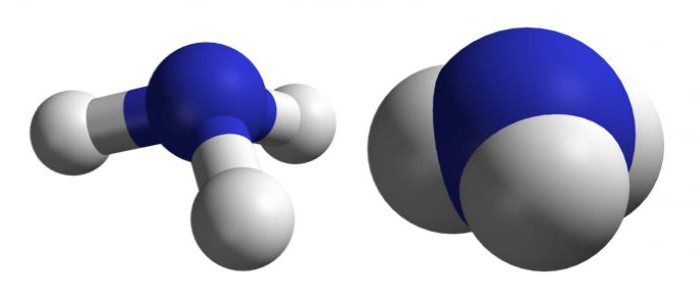
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
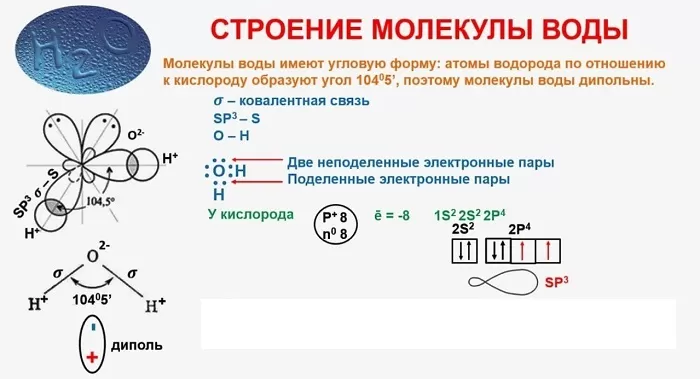
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая – ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная – основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная – имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная – может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
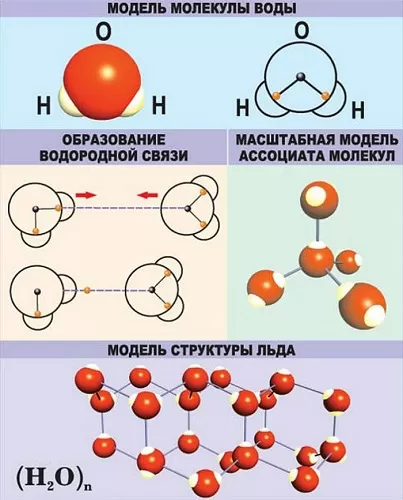
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
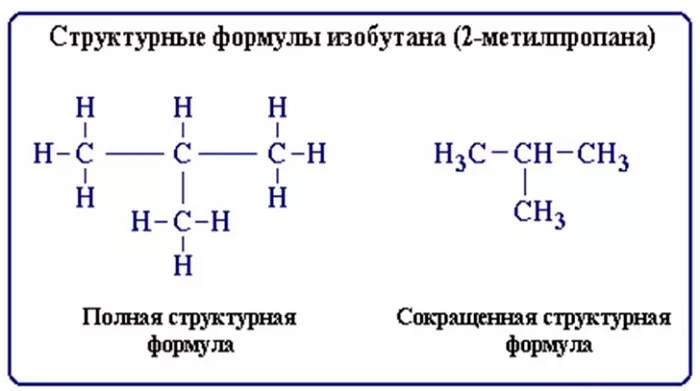
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим – расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
Электрические – этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические – дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные – объясняются распределением электронов в атомах.
Различают вещества:
диамагнитные – парных электронов нет;
парамагнитные – имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Источник
1.1.1.Молекулы. Химические формулы. Атомные и молекулярные массы. Элементный состав веществ
В момент выделения из пробирки атом водорода является атомарным. Атомарное состояние означает, что водород не связан с другими атомами, а летает в виде свободного атома. Соударяясь с другим атомом водорода, между ними возникает химическая связь и образуется молекула H2.
Молекулы HCl и H2O также образуются из атомов, объединяемых химическими связями:
Явление образования молекул из атомов объясняется появлением химических связей между атомами. Каждый атом имеет электронную плотность, которая заряжена отрицательно. При взаимодействии электронных плотностей (при их перекрывании) образуется общая электронная плотность, удерживающая два атома друг с другом. Такой тип химической связи по типу образования общей электронной плотности между атомами неметаллов называется ковалентной. Подробное описание химических связей мы рассмотрим в следующих главах.
В состав молекулы могут входить атомы не только одного химического элемента. Молекула может быть образована атомами разных химических элементов. При этом молекула отличается от атома наличием химических связей в ней, удерживающих атомы во взаимодействии. Тогда для того, чтобы выразить состав молекулы используют химические формулы.
Химические формулы показывают как качественный, так и количественный состав молекулы.
Качественный состав дает характеристику состава молекулы (из каких атомов химических элементов она состоит).
Количественный состав характеризует стехиометрические соотношения между молекулами (Один к одному или один к двум).
Например, молекула H2O состоит из атомов водорода и кислорода – качественный состав. Количество атомов водорода (H) в два раза больше, чем атомов кислорода (O) – это количественный состав.
Любое чистое вещество состоит из однотипных повторяющихся молекул. Тогда различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Тогда:
Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства.
Молекула состоит из атомов. А атом определяется наличем протонов и нейтронов в ядре и вращающихся вокруг ядра по энергетическим орбиталям электронов. Электроны практически ничего не весят, поэтому особого вклада в вес атома они не вносят. В свою очередь протоны и нейтроны имеют вес и приблизительно одинаковый. Таким образом, вклад в атомную массу вносят только протоны (p+) и нейтроны (n0).
m(p+) ≈ m(n0) ≈ 1 а.е.м. (атомная единица массы) ≈ 1/12m(атома C)
У каждого химического элемента в табл. Д.И. Менделеева есть свое значение относительной атомной массы. Относительная она потому, что ее отнесли к 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы.
Относительная атомная масса – это число, которое показывает, во сколько раз абсолютная масса атома данного элемента больше 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы.
Относительная атомная масса обозначается символом «Ar». Определение относительной атомной массы сводится к поиску заданного химического элемента в периодической таблице и определению его значения относительной атомной массы (Рисунок 3).
Рисунок 3 – Расшифровка записи химического элемента в периодической таблице
Так как значения относительной атомной массы нецелочисленные (есть цифры после запятой), то прибегают к математическим приближениям:
В случае аргона (Ar) значение относительной атомной массы 39,948 округляют до 40: Ar(Ar) = 40 а.е.м.
Это означает, что сумма протонов и нейтронов составляет значение 40:
Ar = p+ + n0
40 = p+ + n0
Количество протонов (p+) в атоме аргона равно 18 (так как порядковый номер определяет количество протонов в ядре атома). Тогда количество нейтронов находится по формуле:
n0 = Ar – p+
40 – 18 = 22
Таким образом, количество нейтронов в атоме аргона получилось равным 22, а количество протонов 18. В сумме количество нуклонов образовали относительную атомную массу равную 40 а.е.м.
Атомная единица массы (а.е.м.) – это 1/12 часть абсолютной массы атома углерода.
В таблице 3 приведены относительные атомные массы некоторых химических элементов.
Молекула состоит из атомов. Это означает, что зная относительную атомную массу, можно вычислить относительную молекулярную массу. Она будет складываться из суммы атомных масс входящих в состав молекулы атомов.
Mr(X) – относительная молекулярная масса вещества X.
Mr(H2O) = 2Ar(H) + Ar(O) = 2·1 + 16 = 18.
Относительная молекулярная масса вещества Mr – это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода C.
Относительные молекулярные и атомные массы являются величинами безразмерными.
Задания для самостоятельной работы
Определите количество протонов в атомах:
N 7 ; алюминий 13 ;
Na ; барий ;
Mg ; водород ;
Cl ; кремний ;
С ; фосфор ;
He ; сера ;
Ca ; калий ;
Ne ; фтор ;
Au ; серебро ;
Определите количество протонов, нейтронов, электронов и атомную массу для следующих химических элемнтов:
Распределите химические элементы на две группы в зависимости от количества субатомных частиц: Na, S, Be, C, P, Si, Ag, Ca, F, Cl.
Вставьте нужные по смыслу слова из скобок.
Молекула H2O состоит из атомов (водорода и кислорода/озона/трития) – этот факт характеризует ее (качественный/количественный) состав. Количество атомов водорода (H) в два раза больше, чем атомов кислорода (O) – это определяется (качественным/количественным)составом.
Закончите предложения со значениями: «электронов», «химических связей».
В нейтральном атоме количество протонов равно количеству _____________.
Явление образования молекул из атомов объясняется появлением _________________ между атомами.
Определите количество атомов в молекулах:
Пример: СaBr2. Количество атомов: 1Ca + 2Br = 3.
Ca(NO3)2 — 9 ; CaBr2 — 3 ;
NaNO3 — ; BaCl2 — ;
FeS — ; H2O — ;
Al2O3 — ; SO2 — ;
O3 — ; O2 — ;
N2O5 — ; CO2 — .
Определите молекулярную массу молекул:
Ca(NO3)2 — 164 ; CaBr2 — 200 ;
NaNO3 — ; BaCl2 — ;
FeS — ; H2O — ;
Al2O3 — ; SO2 — ;
O3 — ; O2 — ;
N2O5 — ; CO2 — .
Соотнесите молекулы с их структурой:
CO2, SF6, BF3, PF5, CH4.
 А Б В Г Д
А Б В Г Д
Источник
Все тела, которые нас окружают, состоят из атомов. Атомы, в свою очередь, собираются в молекулу. Именно благодаря различию в молекулярном строении, можно говорить об отличных друг от друга веществах, опираясь на их свойства и параметры. Молекулы и атомы всегда находятся в состоянии динамики. Двигаясь, они все же не разбегаются в разные стороны, а удерживаются в определенной структуре, чем мы обязаны существованию такого огромного разнообразия веществ во всем окружающем нас мире. Что же это за частички и каковы их свойства?
Общие понятия
Если отталкиваться от теории квантовой механики, то молекула состоит не из атомов, а их ядер и электронов, которые постоянно взаимодействуют между собой.
Для некоторых веществ молекула – это наименьшая частица, имеющая состав и химические свойства самой субстанции. Так, свойства молекул с точки зрения химии определяются ее химическим строением и составом. Но только для веществ с молекулярным строением работает правило: химические свойства веществ и молекул одинаковы. Для некоторых полимеров, например, этилена и полиэтилена, состав не соответствует молекулярному.
Известно, что свойства молекул определяются не только количеством атомов, их типом, но и конфигурацией, порядком соединения. Молекула – это сложная архитектурная постройка, где каждый элемент стоит на своем месте и имеет своих конкретных соседей. Атомная структура может быть более или менее жесткой. Каждый атом совершает колебание относительно своего равновесного положения.

Конфигурация и параметры
Бывает, что некоторые части молекулы совершают вращение по отношению к другим частям. Так, в процессе теплового движения свободная молекула обретает причудливые формы (конфигурации).
В основном свойства молекул определяются связью (ее типом) между атомами и архитектурой самой молекулы (структурой, формой). Таким образом, в первую очередь общая химическая теория рассматривает химические связи и основывается на свойствах атомов.
При сильно выраженной полярности свойства молекул трудно описать двух- или трехконстантными корреляциями, которые отлично подходят для неполярных молекул. Поэтому был введен дополнительный параметр с дипольным моментом. Но такой способ не всегда успешен, так как полярные молекулы имеют индивидуальные характеристики. Также были предложены параметры для учета квантовых эффектов, имеющие важность при низких температурах.
Что мы знаем о молекуле самого распространенного вещества на Земле?
Из всех веществ на нашей планете, самое распространенное – это вода. Она, в прямом смысле, обеспечивает жизнь всему сущему на Земле. Только вирусы могут без нее обойтись, остальные живые структуры в своем составе по большей части имеют воду. Какие свойства молекулы воды, характерные только ей, используются в хозяйственной жизни человека и живой природе Земли?
Ведь это поистине уникальная субстанция! Набором свойств, присущих воде, не может похвастаться больше ни одно вещество.
Вода — это основной растворитель в природе. Все реакции, протекающие в живых организмах, так или иначе происходят в водной среде. То есть вещества вступают в реакции, находясь в растворенном состоянии.
Вода обладает отличной теплоемкостью, но низкой теплопроводностью. Благодаря таким свойствам мы можем использовать ее в качестве транспортировки тепла. Этот принцип входит в механизм охлаждения большого числа организмов. В атомной энергетике свойства молекулы воды послужили поводом для использования этого вещества в качестве теплоносителя. Помимо возможности быть реактивной средой для других веществ, вода сама может вступать в реакции: фотолиз, гидратацию и другие.

Природная чистая вода – это жидкость, не имеющая запаха, цвета и вкуса. Но на толщине слоя, большем чем 2 метра, цвет становится голубоватым.
Вся молекула воды – это диполь (два разноименных полюса). Именно дипольная структура в основном определяет необычные свойства этого вещества. Молекула воды является диамагнетиком.
Еще одним интересным свойством обладает талая вода: ее молекула приобретает строение золотой пропорции, а структура вещества – пропорции золотого сечения. Многие свойства, которыми обладает молекула воды, установлены с помощью анализа поглощения и испускания полосатых спектров в газовой фазе.
Естествознание и молекулярные свойства
Все вещества, кроме химических, имеют физические свойства молекул, входящих в их структуру.
В физической науке понятие молекул используют для объяснения свойств твердых тел, жидкостей и газов. Способность всех веществ к диффузии, их вязкость, теплопроводность и другие свойства определяются подвижностью молекул. Когда французский ученый-физик Жан Перрен изучал броуновское движение, он экспериментально доказал существование молекул. Все живые организмы существуют благодаря тонко сбалансированному внутреннему взаимодействию в структуре. Все химические и физические свойства веществ имеют фундаментальное значение для естествознания. Развитие физики, химии, биологии и молекулярной физики послужило возникновению такой науки, как молекулярная биология, исследующая основные явления в жизни.
Используя статистическую термодинамику, физические свойства молекул, которые определяют методами молекулярной спектроскопии, в физической химии определяют термодинамические свойства веществ, необходимые для расчета химических равновесий и скоростей его установления.

Чем отличаются свойства атомов и молекул между собой?
Прежде всего, атомы не встречаются в свободном состоянии.
У молекул оптические спектры более богаты. Это связано с меньшей симметрией системы и с появлением возможности новых вращений и колебаний ядер. У молекулы суммарная энергия складывается из трех энергий, отличных по порядку величин составляющих:
- электронной оболочки (оптическое или ультрафиолетовое излучение);
- колебания ядер (инфракрасная часть спектра);
- вращения молекулы в целом (радиочастотный диапазон).
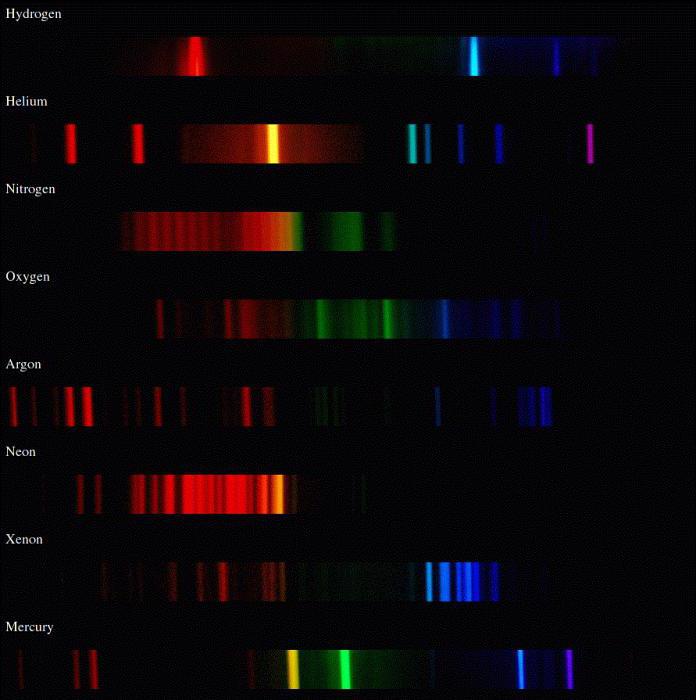
Атомы излучают характерные линейчатые спектры, а молекулы – полосатые, состоящие из множества близко расположенных линий.
Спектральный анализ
Оптические, электрические, магнитные и другие свойства молекулы определяются еще и связью с волновыми функциями. Данные о состояниях молекул и вероятном переходе между ними показывают молекулярные спектры.
Переходы (электронные) в молекулах показывают химические связи и структуру их электронных оболочек. Спектры, имеющие большее количество связей, имеют длинноволновые полосы поглощения, попадающие в видимую область. Если вещество построено из таких молекул, оно имеет характерную окраску. Это все органические красители.
Свойства молекул одной и той же субстанции являются одинаковыми во всех агрегатных состояниях. Это значит, что у одних и тех же веществ свойства молекул жидких, газообразных субстанций не отличаются от свойств твердого. Молекула одного вещества всегда имеет одинаковую структуру, независимо от агрегатного состояния самого вещества.
Электрические характеристики
То, как вещество ведет себя в электрическом поле, определяется электрическими характеристиками молекул: поляризуемостью и постоянным дипольным моментом.
Дипольный момент – это электрическая асимметрия молекулы. У молекул, которые имеют центр симметрии, как H2, нет постоянного дипольного момента. Способность электронной оболочки молекулы перемещаться под воздействием электрического поля, в результате которого в ней образуется наведенный дипольный момент, – это поляризуемость. Чтобы найти значение поляризуемости и дипольного момента, необходимо измерить диэлектрическую проницаемость.
Поведение в переменном электрическом поле световой волны характеризуют оптические свойства вещества, которые определяются поляризуемостью молекулы этой субстанции. Непосредственно с поляризуемостью связаны: рассеяние, преломление, оптическая активность и другие явления молекулярной оптики.
Часто можно услышать вопрос: «От чего, кроме молекул, зависят свойства вещества?» Ответ на него достаточно прост.
Свойства веществ, кроме изометрии и кристаллической структуры, определяются температурой окружающей среды, самой субстанции, давлением, наличием примесей.

Химия молекул
До формирования такой науки, как квантовая механика, природа химических связей в молекулах была нераскрытой тайной. Классическая физика объяснить направленность и насыщаемость валентных связей не могла. После создания базовых теоретических сведений о химической связи (1927 г.) на примере простейшей молекулы Н2, теория и методы расчёта стали постепенно совершенствоваться. К примеру, на основе широкого применения метода молекулярных орбиталей, квантовой химии, стало возможным вычислять межатомные расстояния, энергию молекул и химических связей, распределение электронной плотности и других данных, которые вполне совпадали с экспериментальными.
Вещества с одинаковым составом, но разным химическим строением и разными свойствами, называются структурными изомерами. У них разные структурные формулы, но одинаковые молекулярные.
Известны различные типы структурной изомерии. Различия заключаются в строении углеродного скелета, положении функциональной группы или положении кратной связи. Кроме того, еще существуют пространственные изомеры, у которых свойства молекулы вещества характеризуются одинаковым составом и химическим строением. Поэтому и структурные, и молекулярные формулы у них одинаковые. Отличия заключаются в пространственной форме молекулы. Для изображения разных пространственных изомеров используют специальные формулы.
Есть соединения, которые называются гомологами. Они похожи по строению и свойствам, но отличаются по составу на одну или несколько групп СН2. Все вещества, похожие по строению и свойствам, объединены в гомологические ряды. Изучив свойства одного гомолога, можно рассуждать о любом другом из них. Совокупность гомологов – это гомологический ряд.
При преобразованиях структур вещества химические свойства молекул резко меняются. Примером служат даже простейшие соединения: метан, соединяясь даже с одним атомом кислорода, становится ядовитой жидкостью с названием метанол (метиловый спирт – СН3ОН). Соответственно, его химическая комплементарность и действие на живые организмы становятся другими. Аналогичные, но более сложные изменения, происходят при модификации структур биомолекул.
Химические молекулярные свойства сильно зависят от строения и свойств молекул: от энергетических связей в ней и геометрии самой молекулы. Особенно это работает в биологически активных соединениях. Какая конкурирующая реакция окажется преобладающей, часто определяется только пространственными факторами, зависящими, в свою очередь, от исходных молекул (их конфигурации). Одна молекула, имеющая «неудобную» конфигурацию, вообще не вступит в реакцию, а другая, с таким же химическим составом, но другой геометрией, может среагировать на реакцию мгновенно.
Большое число биологических процессов, наблюдающихся при росте и размножении, связано с геометрическими соотношениями между продуктами реакции и исходными веществами. К сведению: действие немалого количества новых лекарств основывается на аналогичном строении молекул какого-либо соединения, вредного с биологической точки зрения для человеческого организма. Лекарство занимает место вредоносной молекулы и затрудняет ее действие.
С помощью химических формул выражают состав и свойства молекул разных веществ. На основании молекулярной массы, химического анализа устанавливается атомное соотношение и составляется эмпирическая формула.
Геометрия
Определение геометрической структуры молекулы производится с учетом равновесного расположения атомных ядер. От расстояния между ядрами атомов зависит энергия взаимодействия атомов. При очень больших расстояниях эта энергия нулевая. При сближении атомов начинает формироваться химическая связь. Тогда атомы сильно притягиваются друг к другу.
Если наблюдается слабое притяжение, то образование химической связи при этом не обязательно. Если атомы начинают сближаться на более близкие расстояния, между ядрами начинают действовать электростатические силы отталкивания. Препятствием для сильного сближения атомов является несовместимость их внутренних электронных оболочек.
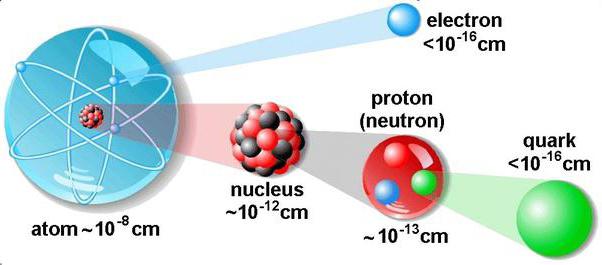
Размеры
Невооруженным глазом увидеть молекулы невозможно. Они так малы, что даже микроскоп с 1000-кратным увеличением нам не поможет их разглядеть. Биологи наблюдают бактерии размером 0,001 мм. Но молекулы в сотни и тысячи раз меньше их.
Сегодня строение молекул некой субстанции определяют дифракционными методами: дифракцией нейтронов, рентгеноструктурным анализом. Также существует колебатель
