Какими свойствами характеризуются вещества молекулярного строения

Все вещества состоят из атомов, которые объединяются в определенные структуры с помощью различных устойчивых связей. При этом структурная решетка физического тела может состоять, либо из отдельных однотипных групп атомов — молекул, либо из отдельных атомов. По типу связей различают вещества молекулярного и немолекулярного строения. Рассмотрим примеры веществ с молекулярным типом строения.

Строение вещества
Агрегатное состояние вещества (твердое, жидкое или газообразное) и особенности его строения определяются взаимодействием атомов и молекул, из которых состоят все вещества. Теория о молекулярном устройстве всех физических объектов подтвердилась многочисленными экспериментами. Современные приборы (электронные микроскопы) позволяют даже увидеть и сфотографировать отдельные молекулы и их расположение (структуру).
Перечислим базовые положения о молекулярном устройстве веществ:
- Все физические тела состоят из молекул — мелких частиц, каждая из которых имеет все основные химические и физические свойства, присущие всему веществу;
- Молекулы состоят из атомов;
- Атомы состоят из отрицательно заряженных электронов и ядра, включающего в себя положительно заряженные протоны и нейтроны, не имеющие зарядов;
- Молекулы вещества находятся в непрерывном, хаотическом движении;
- Взаимодействие частиц имеет электромагнитную природу: при сближении происходит отталкивание, а при удалении друг от друга возобновляется притяжение. В равновесном состоянии силы притяжения и отталкивания уравновешивают друг другу.
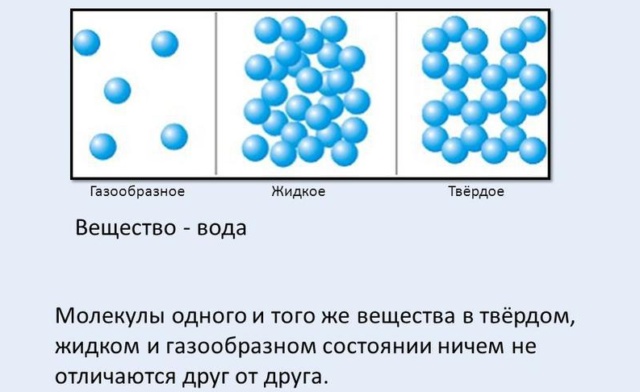
Рис. 1. Молекулы одного и того же вещества в разных агрегатных состояниях.
Древнегреческий философ Демокрит, живший более 2000 лет назад считается первым мыслителем, создавшим учение (теорию) о том, что весь наш мир построен из мельчайших. невидимых частичек — атомов. Слово атом имеет греческое происхождение (“атомос” — неделимый, неразрезаемый). Эта замечательная идея позднее была надолго забыта. Более тысячи лет безраздельно господствовало учение другого философа — Аристотеля, который отрицал существование атомов. Аристотель утверждал, что все вещества могут взаимно превращаться друг в друга, и любое тело можно делить до бесконечности. И Демокрит, и Аристотель строили свои предположения на основе общих, теоретических рассуждений. Только в начале ХIХ века на основе многочисленных опытов и экспериментов ученые (Гассенди, Ломоносов, Бойль, Мариотт, Дальтон и др.) окончательно пришли к общему мнению о реальности существования атомов и молекул.

Рис. 2. Портрет М. В. Ломоносова:.
Свойства веществ молекулярного строения
Для описания веществ со схожими свойствами выделяют два основных вида: вещества немолекулярного строения и вещества молекулярного строения. Вещества, состоящие из однотипных молекул, имеющих в своем составе один и тот же набор атомов, называются веществами молекулярного строения. Общими для этих веществ являются следующие свойства:
- Слабые связи между молекулами, которые при небольшом повышении температуры начинают разрываться — сначала происходит переход в жидкое состояние, а затем в газовую фазу;
- Низкие температуры плавления и кипения.
Примеры веществ молекулярного строения
К молекулярным веществам относятся:
- Большинство простых веществ-неметаллов: кислород (O2), сера (S2), фосфор (P4), водород (H2), азот (N2), хлор (Cl2), фтор (F2), бром (Br2), йод (I2);
- Соединения веществ-неметаллов друг с другом: аммиак (NH3), углекислый газ (CO2), серная кислота (HSO4), оксид азота (N2O5);
- Сахар;
- Нафталин.
Молекулярная кристаллическая решетка образована молекулами, которые соединены между собой слабыми силами межмолекулярного притяжения. Поэтому эти вещества летучи (их можно обнаружить по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Чаще всего молекулярные вещества при нормальных условиях находятся в жидком или газообразном агрегатном состоянии. Некоторые молекулярные вещества могут быть в твердом виде, но их отличительными свойствами являются: легкоплавкость и растворимость в воде (если в узлах полярные молекулы). Примерами таких веществ могут служить: сахар, глюкоза, нафталин, CO2 (“сухой лед”).
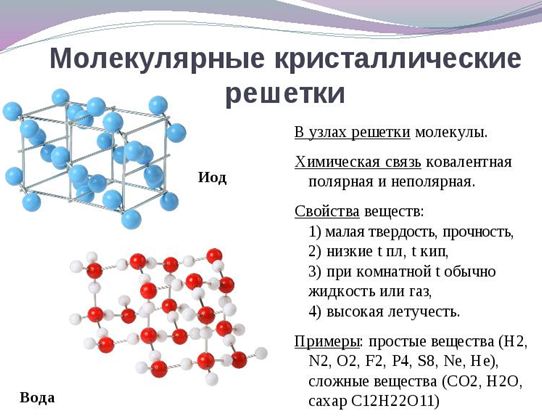
Рис. 3. Молекулярные кристаллические решетки, например: кислород, сера йод, вода:.
Атомов в составе молекулы может быть от 2 штук до бесконечности. Одно из первых мест по количеству атомов занимает молекула ДНК (дезоксирибонуклеиновая — кислота). В одной молекуле ДНК содержится атомов:
- углерода — 5750;
- водорода — 7227;
- кислорода — 4131;
- азота — 2215;
- фосфора — 590.
Что мы узнали?
Итак, мы узнали, что к веществам с молекулярным строением относятся газообразные, жидкие и твердые вещества, молекулярная кристаллическая решетка которых образована молекулами, соединенными между собой слабыми силами межмолекулярного притяжения. Такие вещества летучи (обнаруживаются по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Айша Алиева
5/5
Наталья Андрейко
4/5
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 209.
Источник
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
Оглавление
- Молекулярное и немолекулярное строение веществ
- Твердые вещества: аморфные и кристаллические
- Атомные кристаллические решетки
- Молекулярные кристаллические решетки
- Металлические кристаллические решетки
- Шпаргалки
- Задания для самопроверки
Молекулярное и немолекулярное строение веществ. Строение вещества
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярногои немолекулярного строения. Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Молекулярные и немолекулярные вещества
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl—, так и сложные SO42- , OH—. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Cl—, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Атомная решетка алмазаАтомная решетка графита
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H2O), и неполярными (N2, O2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Металлическая кристаллическая решетка
Шпаргалки
Взаимосвязь между типом кристаллической решетки и типом связи в веществе
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Источник
Основной структурной единицей веществ, имеющих молекулярное строение является молекула. Молекула состоит из ограниченного числа атомов, связанных друг с другом ковалентными химическими связями. Заряд молекулы также как и атома равен нулю.
Объединяясь в молекулу, атомы образуют определённую 2D или 3D-структуру (треугольник, квадрат, тетраэдр, октаэдр и т.д.).
Молекула – электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями и имеющая определённую пространственную структуру.
Отметим, что в некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь “молекулярное строение”, например, все инертные газы. Для инертных газов понятия атом и молекула пересекаются.
Ковалентные связи между атомами образуются в результате обобществления атомами валентных электронов.
Валентные электроны – это электроны, принимающие участие в образовании химических связей.
Валентные электроны в атомах элементов главных подгрупп находятся на внешнем электронном слое. В атомах элементов побочных подгрупп часть валентных электронов находится на внешнем электронном слое, их там как правило 2, а иногда 1, с учётом эффекта провала электрона, а оставшаяся часть на d-подуровне предвнешнего электронного слоя.
При обобществлении валентных электронов атомами возникают общие электронные пары. Поэтому более точно, ковалентная связь – это связь, возникающая за счёт общих электронных пар.
Общие электронные пары могут возникать двумя способами: в результате обобществления неспаренных валентных электронов (обменный или коллигативный механизм) и в результате обобществления неподелённой электронной пары одного из атомов (донорно-акцепторный механизм). Более подробно речь об этих механизмах пойдёт в соответствующей главе.
Обобществление неспаренных электронов атомов водорода (обменный механизм образования ковалентной связи)
Валентный штрих Купера, показывающий общую электронную пару
Количество общих электронных пар, образуемых атомом принято называть его валентностью.
Валентность – это количество ковалентных связей атома с другими атомами.
Особо отметим, что если связи между атомами ковалентные, то это не свидетельство того, что вещество имеет молекулярное строение, т.е. состоит из молекул. Например, связи между атомами кремния и кислорода в SiO2 являются ковалентными, но SiO2 имеет атомное строение.
Чтобы однозначно определить имеет ли вещество молекулярное строение, необходимо знать его физические свойства: температуру кипения, температуру плавления и т.д. Вещества, имеющие молекулярное строение, как правило легкоплавки, имеют относительно низкую температуру кипения, так как связи между молекулами (межмолекулярное взаимодействие) достаточно слабые, имеющие низкие значения энергии.
Молекулы всегда имеют постоянный состав, поэтому и вещества молекулярного строения имеют постоянный состав, т.е. являются дальтонидами. Дальтониды подчиняются закону постоянства состава – закону Пруста (Ж. Л. Пруст, 1801—1808 гг.).
Для того, чтобы отразить состав молекулы применяют условную запись под названием химическая формула.
Химическая формула – условная запись, отражающая качественный и количественный состав веществ, имеющих молекулярное строение (условная запись состава молекулы).
Если вещество имеет немолекулярное строение (атомное или ионное), то его состав отражает формульная единица.
К примеру, если хлорид натрия находится при стандартных условиях, то он имеет ионное строение, а значит запись NaCl для кристаллического хлорида натрия не является химической формулой, а является записью формульной единицы.
При достаточно высоких температурах хлорид натрия можно перевести в газообразное агрегатное состояние, в этом случае резко повышается степень ковалентности связи. Это значит, что в газовой фазе существуют молекулы состава NaCl. На сей счёт имеются экспериментальные доказательства. Действительно, подобные молекулы в настоящее время удаётся получить, изолировав их друг от друга в твёрдом аргоне при температуре -2630 С. В приведённом примере запись NaCl является химической формулой, отражающей состав молекулы.
Во многих пособиях и учебниках до сих пор встречается определение молекулы, как наименьшей частицы вещества, обладающей его химическими свойствами.
Отметим, что данное определение является устаревшим и неправильным. Так молекулу определял Канницаро в 1860 году.
Ошибочность определения заключается в следующем.
Молекула не является наименьшей частицей вещества, так как существуют вещества атомного строения.
Молекула не является носителем химических свойств вещества, свойства обусловлены не единичной частицей, а их совокупностью, характером их взаимодействия.
Одна молекула тринитротолуола не обладает свойством взрывчатости, как даже две, три и большее их количество. Свойством взрывчатости будет обладать совокупность громадного числа молекул тринитротолуола – вещество.
Состав и строение молекулы определяют свойства вещества, но не молекула является носителем этих свойств.
Для наглядного изображения пространственного строения молекул применяют различные модели: шаростержневая модель, полусферическая модель Стюарта-Бриглеба, модель Драйдинга.
Источник
