Какими свойствами обладает декальцинированная кость

Вспомните
1. Вопрос
Что такое скелет?
Ответ:
Скелет человека — это совокупность костей человеческого организма, пассивная часть опорно — двигательного аппарата. Служит опорой мягким тканям, точкой приложения мышц (система рычагов), вместилищем и защитой внутренних органов.
2. Вопрос
Какие типы скелетов встречаются в животном мире?
Ответ:
В животном мире встречаются следующие типы скелетов:
— гидростатический (у моллюсков и круглых червей);
— наружный (у ракообразных и насекомых);
— внутренний (у радиолярий, каракатиц и позвоночных).
Ответы к вопросам лабораторной работы № 4.
1. Вопрос
Какие свойства натуральной кости вы можете назвать?
Ответ:
Натуральная кость обладает прочностью, упругостью, твердостью.
2. Вопрос
Сожмите пережженную кость, попытайтесь ее согнуть. Что при этом происходит? Какими свойствами обладает пережженная кость?
Ответ:
Пережженная кость на сгибается, она рассыпается на твердые частицы, потому что становится хрупкой из — за отсутствия органических веществ.
3. Вопрос
Попробуйте согнуть и растянуть декальцинированную кость. Изменились ли ее свойства?
Ответ:
Декальцинированная кость сгибается и растягивается, но не держит форму, потому что минеральные вещества придающие кости прочность отсутствуют.
4. Вопрос
Объясните, почему кости (натуральные, декальцинированные, пережженные) обладают различными свойствами?
Ответ:
Кости состоят из неорганических и органических веществ, которые по совокупности придают кости прочность, твердость, упругость. Если какого — либо из составляющих компонентов не хватает, то свойства костей изменяются. При недостатке органических веществ кости теряют упругость, при недостатке неорганических — прочность.
1. Вопрос
Какие функции выполняет скелет? На какие части он подразделяется?
Ответ:
Скелет выполняет функции опоры, движения и защиты.
Различают скелет головы — череп, скелет туловища, к которому прикрепляются пояса конечностей — плечевой и тазовый, и кости свободных конечностей — рук и ног.
2. Вопрос
Докажите, что в движении участвуют не только мышцы, но и кости.
Ответ:
Скелет вместе с мышцами составляет двигательный аппарат. Кости в этом аппарате выполняют пассивную роль. Они являются рычагами, которые перемещаются в результате сокращения мышц.
3. Вопрос
Как классифицируют кости по форме?
Ответ:
Кости отличаются друг от друга формой и размерами. Различают длинные, короткие и плоские кости.
Примером плоских костей могут служить кости черепа, лопатки; длинных (трубчатых) — кости плеча, предплечья, бедра, голени; коротких — многие кости кисти и стопы.
4*. Вопрос
Нарисуйте схему строения трубчатой кости.
Ответ:
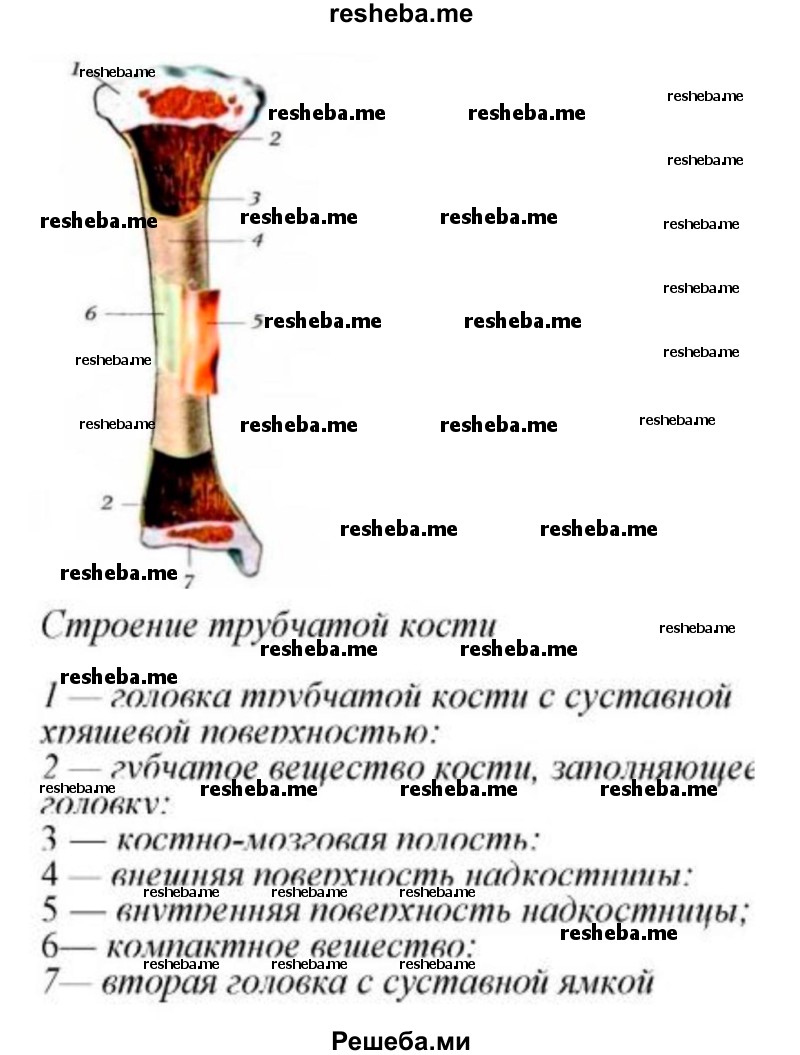
5. Вопрос
За счет чего кости растут в длину и в ширину?
Ответ:
В толщину кости растут за счет надкостницы, в длину — за счет замещения хрящевой ткани костной в зонах роста.
6. Вопрос
Как устроено компактное вещество кости?
Ответ:
Компактное вещество пронизано мельчайшими костными канальцами, по которым проходят сосуды и нервы. Вокруг них располагаются костные клетки, которые выделяют межклеточное вещество, имеющее форму костных пластинок. Костные пластинки в несколько слоев окружают полость канальца, образуя цилиндры, вложенные один в другой. Костные клетки располагаются позади каждого ряда. Они соединены между собой, образуя единую систему. Компактное вещество, находящееся под надкостницей, образует наружный слой кости.
7. Вопрос
Чем кости ребенка отличаются от костей пожилого человека?
Ответ:
У детей в костях процент органических веществ больше, поэтому они более гибкие и упругие, менее ломкие, но легче поддаются искривлению. С возрастом кости становятся более хрупкими, так как в них увеличивается процентное содержание минеральных солей.
8. Вопрос
Приведите примеры неподвижных, полуподвижных и подвижных соединений костей.
Ответ:
Неподвижно соединены кости черепа, кроме нижней челюсти.
Полуподвижное соединение осуществляется с помощью хрящей. Так соединены между собой позвонки, а также 10 пар ребер с грудиной.
Подвижные соединения костей называют суставами
9. Вопрос
Как устроен сустав?
Ответ:
Сустав образуют две или несколько костей, соединенных друг с другом прочными тяжами — связками из соединительной ткани.
Одна из костей образует суставную головку, другая — суставную впадину. Головка и впадина покрыты гладким суставным хрящом. Это облегчает движение костей. Сустав находится в суставной сумке. Ее стенки выделяют суставную жидкость, уменьшающую трение костей при движении и осуществляющую питание суставного хряща, в котором нет кровеносных капилляров.
10*. Вопрос
Внутри суставной сумки давление меньше, чем в окружающем воздухе. Чему это содействует: улучшению подвижности или повышению прочности сустава? Что произойдет, если герметичность суставной сумки будет нарушена?
*для проверки своего предположения проведите следующий контрольный опыт. Возьмите стакан, приложите его ко рту и втяните в себя воздух так, чтобы стакан присосался к лицу. Теперь нажмите на кожу углов рта и впустите атмосферный воздух. Почему присосавшийся стакан отпадает?
Ответ:
Давление в суставе ниже атмосферного (отрицательное давление). Это препятствует расхождению костей и придает суставу прочность.
Синовиальные (суставные) сумки — это небольшие по размеру карманы, которые в своей полости содержат жидкость, которая уменьшает механическую нагрузку на сам сустав, поглощает удар, уменьшает трение поверхностей кости в суставе.
Если нарушить герметичность суставной сумки, то синовиальная жидкость вытечет из нее, давление сравняется с атмосферным, головки суставных костей при трении друг о друга будут стачиваться, в результате сустав потеряет прочность.
При проведении контрольного опыта, можно убедиться, что если мы втянем в себя воздух, то в стакане создается вакуум, как только мы нарушим герметичность, атмосферное давление в стакане и окружающем воздухе сравняется, и в нём пропадёт вакуум — присосавшийся стакан отпадёт.
Источник
Лабораторная работа №2
Состав кости. Исследование свойств нормальной, жженной и декальценированной кости.
Цель:
наглядно убедиться, что связь строения и функции проявляется не только в морфологических признаках, но и в особенностях химического строения костей;
выяснить, что сочетание компонентов приводит к новому качеству, которым каждый из компонентов в отдельности не обладает;
научиться логическим приемам доказательства путем подведение под определение, а также приемам анализа путем исключения всех составляющих, кроме одного.
Оборудование:
кости (натуральная; декальценирован-
ная; пережженная), препаровальная ванночка, спиртовка, спички, держа-
тель.
Ход работы:
1.Доказать, что в костях содержится органическое вещество.
Доказательство: известно, что вещество, которое при горении обуливается, называется органическим. При горении сгорают органические вещества, вода испаряется, оставшаяся зола – пепел – минеральные (неорганические вещества). В пламени спиртовки подержать небольшую рыбью кость до обугливания.
2.Определить свойства минеральных веществ.
Доказательство: эта задача решается методом исключения. В костях есть органические и минеральные вещества. Чтобы узнать свойства минеральных веществ, надо удалить органические. Смотри пункт 1. Жженая кость хрупкая, минеральные вещества – твердые.
3.Определить свойства органических веществ.
Доказательство: необходимо удалить минеральные вещества, которые придают костям твердость и крепость. В состав костей входят соли кальция: карбонат кальция и фосфат кальция. Их можно удалить слабым раствором соляной кислоты ( 2%-5%). Через 2- 3 дня кость можно будет завязать узлом. Органические вещества придают костям гибкость, упругость, эластичность. Завязать узлом заранее приготовленную кость.
Сочетание свойств минеральных веществ и органических дают уникальные, т. е. новые качества которым каждый из компонентов не обладает. Например, бетон состоит из твердого щебня и эластичного цемента. Однако, чтобы материал был прочным эти компоненты должны быть в определенных соотношениях.
Выполните тестовую работу
1.Используя материал параграфа сформулируйте определение «скелет» т.е продолжите фразу: «Скелет – это…».
2.Скелет в основном участвует обмене
а) органических веществ
б) минеральных веществ*
в) водном
г) органических, минеральных и водном
3.Органические вещества придают костям:
а) эластичность*
б) прочность
в) хрупкость
г) твердость
4.В пожилом возрасте в костях увеличивается содержание:
а) воды
б) органических веществ
в) минеральных веществ*
г) неорганических веществ и органических
5. У детей в возрасте до года на темени прощупывается родничок*, а более позднем возрасте он полностью «зарастает». Какую диету вы бы порекомендовали для ребенка, у которого зарастание родничка происходит медленно?
*Черепные кости новорожденного находятся в состоянии неполного окостенения: в их состав входит хрящ и соединительная ткань. Лобная, затылочная и другие кости состоят из нескольких частей каждая. Края костей не имеют зубцов и соединяются друг с другом не швами, а полосками соединительнотканной перепонки. В местах, где сходятся узлы нескольких костей, эти перепонки расширяются и образуют роднички. После рождения отдельные части костей соединяются друг с другом. Зарастают роднички… .

РИС.1- кость декальценированная,; 2 – кость нормальная.
Источник
Костные образцы считаются одними из трудных объектов для гистологического исследования, так как межклеточное вещество содержит избыток различных солей кальция. Минерализация обусловливает опорно-механическую функцию костной ткани, но именно это обстоятельство представляет известную трудность в практической гистологии.
Для рутинного гистологического исследования наиболее употребимыми являются фиксация в 10% нейтральном забуференном формалине, заливка в парафин и окраска гематоксилином и эозином. Образцы костной ткани требуют удаления кальция и изменения технологии получения парафиновых срезов. Чрезвычайно важным этапом в технологии изготовления гистологических препаратов является фиксация. Предпочтительное использование формалина для фиксации определяется следующими соображениями:
1) это самый часто используемый фиксатор; подавляющее большинство гистологических лабораторий используют один и тот же фиксатор практически для всех гистологических объектов;
2) любой из рутинных образцов может быть подвергнут иммуногистохимическому исследованию, а использование подавляющего большинства первичных антител требует фиксации материала в 10% нейтральном забуференном формалине.
Наличие солей кальция не позволяет приготовить срезы тканей на обычных микротомах, поэтому кальций необходимо удалить перед проводкой ткани (декальцинация). Этой процедуре подвергают не только костные образцы, но любые ткани, содержащие патологические участки обызвествления.
Ниже описаны детали процедуры декальцинации и способы контроля окончания декальцинации, пригодные для современной гистологической лаборатории.
Выбор декальцинирующего агента
Все декальцинирующие агенты можно условно разделить на кислотные и бескислотные.
P. Gray [6] приводит 65 рецептов декальцинирующих жидкостей, каждый из которых включает, как минимум, одну из кислот.
К бескислотным декальцинаторам относятся ионообменные смолы, но они не столь широко используются в гистологии.
Считалось, что для удаления кальция из компактных костей лучше всего подходят декальцинирующие жидкости на основе сильных минеральных кислот (соляная, азотная). Они действительно быстро извлекают кальций (2—3 сут), но такие объекты совершенно не пригодны для иммуногистохимического (ИГХ) исследования.
Считается, что губчатые кости лучше декальцинировать растворами на основе слабых органических кислот (муравьиная, уксусная), но и в этом случае могут возникнуть трудности при проведении ИГХ-окрасок. Процедура декальцинации слабыми кислотами занимает 7—10 дней и более.
В любом случае, когда в лаборатории исследуются опухоли костей и трепанобиоптаты костного мозга, нужно использовать растворы на основе этилендиаминтетраацетата (ЭДТА) с рН 7,0. Если данная технология недоступна в лаборатории и используется метод декальцинации сильными кислотами, необходимо один репрезентативный кусочек опухоли вместе с костной тканью зафиксировать до процедуры декальцинации и сохранить его либо в 70% этаноле, либо в 70% изопропаноле, но не в формалине.
Процедура декальцинации
Выпиленные образцы толщиной 3 мм помещают в 10% нейтральный забуференный формалин на 24—48 ч при комнатной температуре в объеме фиксатора в 10—20 раз больше образца.
I. Dimmenstein [5] приводит описание некоторых приспособлений и вспомогательных приемов для вырезки костного материала. Перед проводкой избыток формалина отмывается в течение 20—30 мин в проточной воде.
Материал для декальцинации помещают в гистологические кассеты. Декальцинация каждого случая проводится в отдельной пластиковой емкости объемом не менее 200 мл, для контроля выбирают наиболее крупный образец. Процедура проводится без использования каких-либо приспособлений. Подогрев, мешалки, вакуум, микроволны, ультразвук и воздействие электрического поля могут изменить структуру белковых молекул и повредить антигены.
Объем декальцинатора по отношению к объему ткани должен быть, как минимум, в 50 раз больше, поскольку процесс извлечения происходит путем диффузии кальция в раствор. В свежем растворе декальцинация проходит сильнее. Необходимо заменять раствор на свежий ежедневно.
Определение окончания декальцинации
Это очень важный момент, так как он позволяет предотвратить необратимое разрушение тканей. Имеется несколько способов определения окончания процесса декальцинации.
1. Сгибание кусочка. Образец ткани пробуют согнуть пальцами. Пока в нем остается кальций, его очень трудно или невозможно согнуть, а при отсутствии кальция он легко гнется. Это быстрый и простой, но субъективный тест. При сгибании не полностью декальцинированной кости мягкие ткани могут отделяться от твердых, а также происходит повреждение структуры костной ткани. При слишком сильном сгибании ткани ломаются, даже если кальция в них уже нет [2, 11].
2. Проба образца тонкой иглой. Если игла проходит через образец без хруста, декальцинация считается законченной. При этом от иглы остаются следы, и это заметно под микроскопом. Нередко картина нарушается в самых ценных для диагностики местах. Тем не менее игла может проходить без затруднений и в тех случаях, когда в образце кальций еще остается в небольшом количестве [9].
3. Углекислотный тест. При помещении кусочка в декальцинирующую жидкость на поверхности раствора начинают появляться пузырьки углекислого газа. Отсутствие пузырьков газа свидетельствует об окончании процесса декальцинации. Это неточный тест, поскольку при наличии мелких кальцинатов пузырьки газа не визуализируются. Особенно трудно этот тест выполним на мелких костных фрагментах [10].
4. Всплывание образца на поверхность. Образец всплывает на поверхность, когда кальция в нем не остается. Это утверждение неверно, поскольку образец может всплывать независимо от наличия кальция или когда плотность образцов меньше плотности декальцинирующего раствора.
5. Оксалатный тест. Достаточно информативный и чувствительный метод [2, 4], который подходит для сильных и органических кислот, если их концентрация не превышает 10%. Он не подходит для растворов с ЭДТА. Продолжительность теста — 35 мин.
6. Рентгенографический метод. Впервые был описан в 1930 г. [7]. С помощью рентгеновского аппарата (обычного или специального, например, Faxitron) определяются даже минимальные количества кальция в исследуемом объекте. Можно определять отложения кальция и в парафиновых блоках [3]. Недостатки метода — дорогостоящая специальная аппаратура, а также влияние рентгеновского излучения на персонал. Преимущество — возможность тестирования большого количества объектов за короткое время.
7. Гравиметрический тест. Надежный тест, не требующий затрат реактивов, дорогостоящей аппаратуры и времени. Подходит для любого декальцинатора и любого объекта. Если масса объектов мала и они многочисленны, можно взвешивать их вместе. Исследуемый фрагмент промокают фильтровальной бумагой для удаления избытка воды и взвешивают его с точностью до миллиграмма. Массу фиксируют. В дальнейшем образец ткани после просушивания кусочками фильтровальной бумаги ежедневно взвешивают и сравнивают массу с предшествующим результатом. Пока удаляется кальций, масса образца будет убывать [1]. Имеется промежуток времени, когда масса остается постоянной. Как только кальций полностью будет удален, вода начинает замещать кальций, и масса образца начинает увеличиваться. Важно зафиксировать тот момент, когда кальций полностью удален из образца — декальцинация может считаться законченной [8]. После окончания декальцинации исследуемые образцы промывают в воде в течение 30—60 мин и начинают проводку по обычной схеме. Особенно важно выполнить промывку после использования жидкостей на основе ЭДТА, поскольку он при взаимодействии со спиртами образует осадки, значительно затрудняющие микротомию.
Определение момента окончания декальцинации является обязательным, но требует определенного навыка. Эти тесты рационально проводить на каком-либо одном (большем) образце от одного пациента, а не тестировать каждый объект.
Гравиметрический тест является наиболее быстрым, простым, удобным и дешевым. Для крупной лаборатории, постоянно работающей с костным материалом, целесообразно рассмотреть возможность приобретения портативной рентгеновской установки для тестирования момента окончания декальцинации. Оба метода оправдывают себя по затрате времени и простоте исполнения тестов, воспроизводимости и надежности результатов.
Прерывание декальцинации
Возможность прерывания процесса декальцинации является неоспоримым преимуществом в случае, когда процесс близок к окончанию, а возможность завершить его отсутствует (выходные и праздничные дни, ночь и др.). В этом случае кусочки костей извлекают из декальцинирующего раствора, промывают в проточной воде в течение 20—30 мин и помещают в 10% нейтральный забуференный формалин на нужный срок. Возобновляют декальцинацию после извлечения образцов из фиксатора и промывки в проточной воде в течение 20—30 мин.
Необходимо помнить, что декальцинации не подлежат хрящевые образцы, ткани с резко выраженным фиброзом, ногти, ороговевшая кожа и любые другие образцы, не содержащие солей кальция.
Декальцинирующие жидкости не обладают размягчающим действием и приводят к повреждению белковых структур. Декальцинаторы на основе минеральных кислот не могут применяться в тех случаях, когда может возникнуть необходимость в проведении ИГХ-исследований. Особенно это касается трепанобиоптатов костного мозга.
Поэтому группа декальцинаторов на основе сильных минеральных и органических кислот может использоваться только в тех случаях, например, когда нет подозрения на наличие опухолевого процесса, когда исследуют компактную кость.
Органические кислоты (муравьиная и ее соли, уксусная, трихлоруксусная, пикриновая, лимонная и ее соли) обладают более мягким действием, но требуют для полной декальцинации от нескольких дней до нескольких недель. В современных условиях, когда клиницисты требуют сократить сроки исследования, это вряд ли удобно.
Хелатирующие агенты (ЭДТА и ее соли) — отдельная группа декальцинирующих агентов. Механизм связывания кальция в зависимости от рН раствора можно представить следующим образом. ЭДТА связывает кальций в зависимости от рН за счет четырех карбоксильных кислотных групп (СООН) и двух аминогрупп (NH). При рН ниже 3,0 декальцинация не происходит вообще. При увеличении рН раствора протоны диссоциируют из этих групп. Этот процесс известен как депротонирование, и декальцинация становится возможной. При рН выше 10,0 группы СООН полностью депротонированы, эта форма ЭДТА быстро связывает кальций, и декальцинация происходит очень быстро. Однако при рН более 7,4 происходит необратимый щелочной гидролиз некоторых белков. При рН 7,0 декальцинация будет происходить достаточно эффективно. Детали эксперимента описываются в обзоре G. Callis, D. Sterchi [4].
К сожалению, в большинстве российских лабораторий чаще других используются декальцинаторы на основе сильных минеральных кислот (азотной, соляной), в которых концентрация кислот не превышает 10%. Более высокая концентрация не сокращает время извлечения кальция, а лишь ускоряет гидролиз белков ткани. Поэтому эта группа декальцинаторов подходит для извлечения больших масс кальция за короткое время, например для образцов компактной кости. Обычно время эффективного воздействия таких кислот ограничивается несколькими часами.
В формулах ЭДТА и ЭДТА с солями натрия более растворимы те, в которых больше натрия. Динатриевая соль ЭДТА менее растворима, чем тетранатриевая ЭДТА, но важно заметить, что их рН также отличаются.
Порошки ЭДТА, используемые для декальцинации, бывают нескольких видов.
А. ЭДТА (эдетовая кислота) имеет молекулярную массу 292 моль, она растворима в воде на 10%, концентрация ее полезна для декальцинации. Чтобы достичь высокой концентрации ЭДТА в растворе, ее нагревают и добавляют гидроксид натрия, который помогает «депротонировать» молекулу. Эта ЭДТА, растворенная в воде, имеет кислую рН (около 4,0) до добавки гидроксида натрия.
Б. Динатриевая соль ЭДТА имеет молекулярную массу 372 моль. 5% раствор имеет рН 4,0—5,0 при комнатной температуре. Соль растворяется в воде в концентрации до 10%, но при приготовлении раствора могут возникнуть трудности, пока рН раствора доводится до 7,0 с помощью гидроксида натрия. Наиболее часто применяется динатриевая соль ЭДТА, имеющая молекулярную массу 372,5 моль, раствор при комнатной температуре имеет рН 4,0—5,0:
вода дистиллированная, мл 850,0
ЭДТА динатриевая соль, г 125,0
натрия гидроксид, г 23,0.
Следует растворить динатриевую соль ЭДТА в воде, затем прибавить гидроксид натрия. Все процессы проводить, непрерывно помешивая. рН конечного раствора должен соответствовать 7,0, что достигается прибавлением по каплям 40% водного раствора гидроксида натрия, при помешивании и контроле рН с помощью предварительно откалиброванного рН-метра. Должен получиться совершенно прозрачный раствор, без каких-либо осадков и взвесей.
В. Тетранатриевая соль ЭДТА имеет молекулярную массу 380 моль и хорошо растворима в воде (14% или более), рН раствора 9,5—12,0. Эта молекула ЭДТА полностью «депротонирована», но высокий рН повреждает чувствительные к щелочам белки. При этом декальцинация будет очень быстрой, однако необходимо снизить рН уксусной кислотой до 7,4 (или до уровня, рекомендуемого для работы с ферментами) для гарантии качественных результатов при ИГХ-окрасках. Также рН можно снизить добавкой трис-гидроксиметиламинометана.
Приготовление растворов ЭДТА требует достаточного опыта, времени и четкого контроля рН с помощью рН-метра, что затруднительно в большинстве гистологических лабораторий. Поэтому целесообразно приобретать декальцинаторы, готовые к употреблению. Примерами могут служить Osteodec («Bio-Optica», Италия), бескислотный декальцинатор БМП («БМП», Россия) и др.
В итоге, находясь перед выбором декальцинирующего агента, лаборатория оказывается под влиянием следующих обстоятельств:
— неизвестно заранее, какой объект впоследствии будет подвергнут гистохимическому, иммуногистохимическому или молекулярному исследованию;
— клиницисты требуют выдачи результата в максимально короткие сроки;
— декальцинирующий раствор должен быть прост и эффективен, дешев и доступен и не повреждать элементы тканей.
По этим соображениям компромиссным представляется выбор декальцинатора на основе ЭДТА с нейтральной рН.
Костные образцы, фиксированные в 10% нейтральном забуференном формалине, могут быть декальцинированы с использованием разных декальцинирующих жидкостей, но с обязательным контролем окончания декальцинации. Такой подход позволяет контролировать качество декальцинации ткани, которая впоследствии будет подвергнута как рутинным, так и ИГХ-исследованиям. Декальцинацию для таких случаев важно проводить растворами на основе солей ЭДТА с нейтральной рН. Если в данной лаборатории ИГХ-методы не выполняются, то макроскопически репрезентативный образец, зафиксированный в 10% нейтральном забуференном формалине, должен сохраняться в 70% этиловом или изопропиловом спирте до тех пор, пока не потребуется ИГХ-исследование. Это чрезвычайно важно для выбора лечебной тактики при гематологических заболеваниях и опухолях костной ткани.
Источник
