Какими свойствами обладает пиридин
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 октября 2019; проверки требуют 10 правок.
| Пиридин | |
|---|---|
| Систематическое наименование | азин, пиридин |
| Традиционные названия | пиридин, азациклогексатриен |
| Хим. формула | C5H5N |
| Рац. формула | C5H5N |
| Состояние | жидкость |
| Молярная масса | 79,101 г/моль |
| Плотность | 0,9819 г/см³ |
| Динамическая вязкость | 0,94 Па·с |
| Энергия ионизации | 9,27 ± 0,01 эВ[1] |
| Температура | |
| • плавления | −41,6 °C |
| • кипения | 115,6 °C |
| • вспышки | 68 ± 1 °F[1] |
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] |
| Давление пара | 16 ± 1 мм рт.ст.[1] |
| Рег. номер CAS | 110-86-1 |
| PubChem | 1049 |
| Рег. номер EINECS | 203-809-9 |
| SMILES | c1ncccc1 |
| InChI | InChI=1S/C5H5N/c1-2-4-6-5-3-1/h1-5H JUJWROOIHBZHMG-UHFFFAOYSA-N |
| RTECS | UR8400000 |
| ChEBI | 16227 |
| ChemSpider | 1020 |
| Предельная концентрация | 0,6 мг/м³[2] |
| Токсичность | Обладает общетоксическим действием. Среднесмертельная доза для крыс составляет около 100-145 мг/кг[3] |
| NFPA 704 | 3 3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Пириди́н (ази́н, 1-азациклогекса-1,3,5-триен) — органическое вещество, шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
История открытия[править | править код]
Пиридин был известен ещё алхимикам, но первое письменное описание этого вещества было сделано шотландским химиком Томасом Андерсоном[en] в 1851 году. Он обнаружил его при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей. Среди прочих веществ, была получена бесцветная жидкость с неприятным запахом. В 1869 году Кернер в частном письме к Канниццаро высказал мысль, что пиридин можно рассматривать как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняет синтезы пиридина, но, главным образом, указывает, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар независимо от Кернера пришел к той же формуле, которая затем нашла подтверждение и в работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 году А. Вышнеградский высказал мнение, что все растительные основания, возможно, являются производными пиридина или хинолина, а в 1880 году Кенигс даже предлагал называть алкалоидами только те растительные основания, которые могут рассматриваться как производные пиридина. Однако сейчас границы понятия «алкалоиды» значительно расширились.
Получение[править | править код]
Основным исходным материалом для получения пиридина является каменноугольная смола.
Одним из методов промышленного синтеза пиридина и 2-алкилпиридинов, например, 2-метилпиридина является циклизация по Бённеманну. Она предполагает образование молекулы пиридина из двух молекул ацетилена и одной молекулы циановодорода или какого-либо нитрила в присутствии катализатора. Катализатором являются соединения кобальта, преимущественно, кобальтоцен:
Химические свойства[править | править код]
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по мета-положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
Применение[править | править код]
Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта.
Охрана труда[править | править код]
Пиридин ядовит[4], обладает общетоксическим действием. Его ОБУВ[5] в воздухе рабочей зоны 0,6 мг/м³[6]. Поскольку порог восприятия запаха этого вещества может достигать 39 мг/м3 (среднее значение в группе)
[7], а у отдельных работников может быть значительно выше среднего значения, можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с “заменой фильтров по появлении запаха под маской” (как это почти всегда рекомендуется в РФ поставщиками СИЗ органов дыхания) приведёт к чрезмерному воздействию паров пиридина на, по меньшей мере, часть работников из-за запоздалой замены противогазных фильтров. Для защиты от пиридина следует использовать изменение технологии и средства коллективной защиты.
Примечания[править | править код]
Ссылки[править | править код]
- Пиридин — статья из Большой советской энциклопедии.
- Д. А. Хардин. Пиридин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Пиридин С5Н5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота.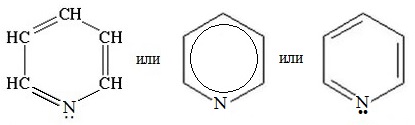
Электронное строение молекулы пиридина
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp2-гибридизации. Все s-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют p-электронную ароматическую систему.
Из трех гибридных орбиталей атома азота две образуют s-связи С–N, а третья содержит неподеленную пару электронов, которая не участвует в образовании p-электронной системы.
Физические свойства
Пиридин – бесцветная жидкость с характерным неприятным запахом, Ткип= 1150С. Хорошо растворяется в воде и органических жидкостях. Ядовит! Вдыхание его паров может привести к тяжелому поражению нервной системы.
Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
Основные свойства
Неподеленная электронная пара атома азота в молекуле не участвует в образовании единой π-электронной системы, поэтому пиридин подобно аминам, проявляет свойства основания. Пиридин – более слабое основание, чем алифатические амины.
1. Взаимодействие с водой
Водный раствор пиридина окрашивает лакмус в синий цвет.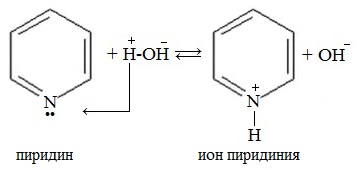
2. Взаимодействие с кислотами
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.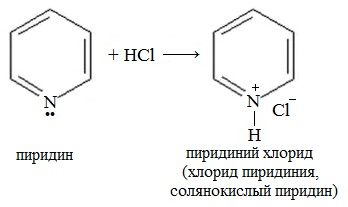
Ароматические свойства
1. Реакции электрофильного замещения
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения.
Нитрование
Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем у бензола, из-за большой электроотрицательности атома азота. Азот как более электроотрицательный элемент оттягивает электроны на себя и понижает плотность электронного облака в кольце, в особенности в положениях 2, 4 и 6 (орто- и пара- положения), создавая частичный отрицательный заряд в мета-положении.
Атом азота в реакциях электрофильного замещения ведет себя как заместитель II рода, электрофильное замещение идет в положение 3 (мета-положение).
Поэтому реакция нитрования пиридина проходит в более жестких условиях, чем у бензола ( при 3000С) и с низким выходом.
2. Реакции присоединения (гидрирование)
Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина.
Пиперидин представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин.
3. Реакции нуклеофильного замещения
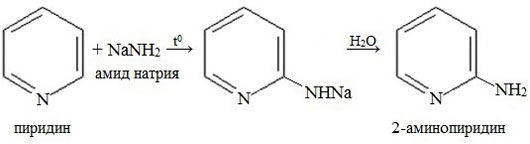
Аминирование
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина).
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты.
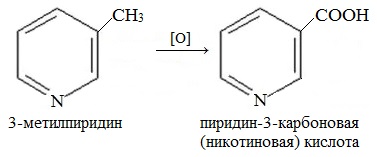
Пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании.
Получение
1. Выделение из каменноугольной смолы
Пиридин выделяют из каменноугольной смолы, в которой его содержание составляет 0,08%.
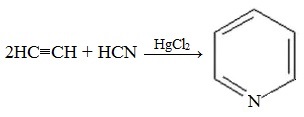
2. Синтез из ацетилена и циановодорода
В лабораторных условиях пиридин можно синтезировать из синильной кислоты (циановодород) и ацетилена:
Биологическая роль
Гомолог пиридина – 3-метилпиридин (β-пиколин) – при окислении образует никотиновую кислоту:
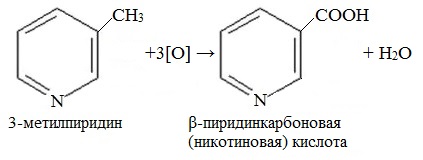
Никотиновая кислота и ее амид – никотинамид
представляют собой две формы витамина РР, который применяется для лечения пеллагры (кожное заболевание).
Многие производные пиридина играют важную роль в природе и жизни человека: они являются витаминами, биологически активными веществами, лекарственными препаратами, красителями и т.п.
Проявляя основные свойства, пиридин и его гомологи известны под общим названием пиридиновые основания.
Гетероциклические соединения
Источник
| Систематическое наименование | азин, пиридин | ||
|---|---|---|---|
| Традиционные названия | пиридин, азациклогексатриен | ||
| Хим. формула | C5H5N | ||
| Рац. формула | C5H5N | ||
| Состояние | жидкость | ||
| Молярная масса | 79,101 г/моль | ||
| Плотность | 0,9819 г/см³ | ||
| Динамическая вязкость | 0,94 Па·с | ||
| Энергия ионизации | 9,27 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −41,6 °C | ||
| • кипения | 115,6 °C | ||
| • вспышки | 68 ± 1 °F[1] | ||
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] | ||
| Давление пара | 16 ± 1 мм рт.ст.[1] | ||
| Рег. номер CAS | 110-86-1 | ||
| PubChem | 1049 | ||
| Рег. номер EINECS | 203-809-9 | ||
| SMILES | c1ncccc1 | ||
| InChI | InChI=1S/C5H5N/c1-2-4-6-5-3-1/h1-5H JUJWROOIHBZHMG-UHFFFAOYSA-N | ||
| RTECS | UR8400000 | ||
| ChEBI | 16227 | ||
| ChemSpider | 1020 | ||
| Предельная концентрация | 0,6 мг/м³[2] | ||
| Токсичность | Обладает общетоксическим действием. Среднесмертельная доза для крыс составляет около 100-145 мг/кг[3] | ||
| NFPA 704 | 3 3 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Пириди́н (ази́н, 1-азациклогекса-1,3,5-триен) — органическое вещество, шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
История открытия
Пиридин был известен ещё алхимикам, но первое письменное описание этого вещества было сделано шотландским химиком Томасом Андерсоном[en] в 1851 году. Он обнаружил его при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей. Среди прочих веществ, была получена бесцветная жидкость с неприятным запахом. В 1869 году Кернер в частном письме к Канниццаро высказал мысль, что пиридин можно рассматривать как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняет синтезы пиридина, но, главным образом, указывает, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар независимо от Кернера пришел к той же формуле, которая затем нашла подтверждение и в работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 году А. Вышнеградский высказал мнение, что все растительные основания, возможно, являются производными пиридина или хинолина, а в 1880 году Кенигс даже предлагал называть алкалоидами только те растительные основания, которые могут рассматриваться как производные пиридина. Однако сейчас границы понятия «алкалоиды» значительно расширились.
Получение
Основным исходным материалом для получения пиридина является каменноугольная смола.
Одним из методов промышленного синтеза пиридина и 2-алкилпиридинов, например, 2-метилпиридина является циклизация по Бённеманну. Она предполагает образование молекулы пиридина из двух молекул ацетилена и одной молекулы циановодорода или какого-либо нитрила в присутствии катализатора. Катализатором являются соединения кобальта, преимущественно, кобальтоцен:
Химические свойства
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по мета-положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
Применение
Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта.
Охрана труда
Пиридин ядовит[4], обладает общетоксическим действием. Его ОБУВ[5] в воздухе рабочей зоны 0,6 мг/м³[6]. Поскольку порог восприятия запаха этого вещества может достигать 39 мг/м3 (среднее значение в группе)
[7], а у отдельных работников может быть значительно выше среднего значения, можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с “заменой фильтров по появлении запаха под маской” (как это почти всегда рекомендуется в РФ поставщиками СИЗ органов дыхания) приведёт к чрезмерному воздействию паров пиридина на, по меньшей мере, часть работников из-за запоздалой замены противогазных фильтров. Для защиты от пиридина следует использовать изменение технологии и средства коллективной защиты.
Примечания
Ссылки
- Пиридин — статья из Большой советской энциклопедии.
- Д. А. Хардин. Пиридин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Эта страница в последний раз была отредактирована 6 января 2021 в 17:38.
Источник
