Какими свойствами обладает сернистый газ

Ñåðíèñòûé ãàç èëè äèîêñèä ñåðû ÿâëÿåòñÿ äîñòàòî÷íî ðàñïðîñòðàíåííûì õèìè÷åñêèì ñîåäèíåíèåì, ñîñòîÿùèì èç ñåðû è êèñëîðîäà (SO2). Ñåðíèñòûé ãàç ðàñòâîðèì â âîäå, ñåðíîé êèñëîòå, ýòèëîâîì ñïèðòå. Ïðè âûäåëåíèè äàííîãî ñîåäèíåíèÿ îùóùàåòñÿ äîñòàòî÷íî íåïðèÿòíûé çàïàõ.
Äèîêñèä ñåðû ïðåäñòàâëÿåò ñåðüåçíóþ óãðîçó äëÿ çäîðîâüÿ. Ñåðíèñòûé ãàç ìîæåò ïðèâåñòè ê çàáîëåâàíèÿì äûõàòåëüíûõ ïóòåé è ñëèçèñòûõ îáîëî÷åê ÷åëîâåêà. Ïðè ïîïàäàíèè ýòîãî ñîåäèíåíèÿ íà êîæó ìîãóò âîçíèêíóòü ðàçäðàæåíèÿ. Íà ïðîèçâîäñòâå, ãäå âûäåëåíèÿ ñåðíèñòîãî ãàçà íåèçáåæíî, ïðîâîäèòñÿ ñòðîãèé êîíòðîëü ñîäåðæàíèÿ äèîêñèäà â âîçäóõå, è óñòàíàâëèâàþòñÿ íîðìû åãî äîïóñòèìîãî çíà÷åíèÿ äëÿ áåçîïàñíîé ðàáîòû ëþäåé.
Ñåðíèñòûé ãàç â ïðèðîäå
Ñåðíèñòûé ãàç â ïðèðîäå â áîëüøèõ êîëè÷åñòâàõ âûäåëÿåòñÿ ïðè èçâåðæåíèè âóëêàíîâ. Âûëåòàÿ èç æåðëà âóëêàíà, ýòî ñîåäèíåíèå âñòóïàåò â ðåàêöèþ ñ âîäÿíûì ïàðîì, ÷òî ïðèâîäèò ê îáðàçîâàíèþ ñåðíîé êèñëîòû. Âñëåäñòâèå òàêîãî âçàèìîäåéñòâèÿ îáðàçóåòñÿ ìíîæåñòâî çåðêàëüíûõ êàïåëåê, êîòîðûå ïðåëîìëÿþò ñîëíå÷íûå ëó÷è, íå ïðîïóñêàÿ ñîëíå÷íûé ñâåò ê ïîâåðõíîñòè çåìëè. Ýòî ïðèâîäèò ê ðåçêèì òåìïåðàòóðíûì èçìåíåíèÿì, ÷òî ïàãóáíî ñêàçûâàåòñÿ íà ýêîëîãè÷åñêîé îáñòàíîâêå ðÿäîì ñ âóëêàíàìè.
Õàðàêòåðèñòèêè è ñâîéñòâà ñåðíèñòîãî ãàçà
Äèîêñèä ñåðû ïðè íîðìàëüíûõ óñëîâèÿõ èìååò ãàçîîáðàçíîå ñîñòîÿíèå. Ïî ìàññå ñåðíèñòûé ãàç ïðåâîñõîäèò âîçäóõ â äâà ñ ïîëîâèíîé ðàçà. Äèîêñèä ñåðû ïðåäñòàâëÿåò ñîáîé äîñòàòî÷íî ñòàáèëüíîå ñîåäèíåíèå. Ðàñùåïëåíèå, âõîäÿùèõ â ñîñòàâ åãî êîìïîíåíòîâ, íàáëþäàåòñÿ ëèøü ïðè êðàéíå âûñîêèõ òåìïåðàòóðàõ. Ïîä âîçäåéñòâèåì íèçêîé òåìïåðàòóðû, ñåðíèñòûé ãàç ïðèîáðåòàåò òâåðäîå ñîñòîÿíèå. Ïîä âîçäåéñòâèåì äàâëåíèÿ, êàê ëþáîé äðóãîé ãàç, äèîêñèä ñåðû ñæèæàåòñÿ. Êàê óæå áûëî îòìå÷åíî ðàíåå, äèîêñèä ñåðû ñïîñîáåí â íåçíà÷èòåëüíîé ñòåïåíè ðàñòâîðÿòüñÿ â âîäå, ÷òî âïîñëåäñòâèè ïðèâîäèò ê îáðàçîâàíèþ ñåðíèñòîé êèñëîòû.
Ñ õèìè÷åñêîé òî÷êè çðåíèÿ, ñåðíèñòûé ãàç àêòèâíî ïðîÿâëÿåò ñåáÿ â ðàçëè÷íûõ ðåàêöèÿõ.  îêèñëèòåëüíî-âîññòàíîâèòåëüíûõ ðåàêöèÿõ â áîëüøèíñòâå ñëó÷àåâ äèîêñèä ñåðû èãðàåò ðîëü âîññòàíîâèòåëÿ.
Ïëîòíîñòü ñåðíèñòîãî ãàçà
Äèîêñèä ñåðû â óìåðåííîì äèàïàçîíå òåìïåðàòóð îáëàäàåò ïëîòíîñòüþ ðàâíîé 2,926 êã/ñì3. Âñëåäñòâèå òåïëîâîãî ðàñøèðåíèÿ ãàçà ïîä âîçäåéñòâèåì áîëüøèõ òåìïåðàòóð, ïëîòíîñòü äàííîãî ñîåäèíåíèÿ çàìåòíî ñíèæàåòñÿ. Ïî ïëîòíîñòè äèîêñèä ñåðû íå óñòóïàåò òàêèì ãàçàì, êàê ôòîðèñòûé áîð è ôòîð îêèñü àçîòà.
Ìàññîâàÿ äîëÿ ñåðíèñòîãî ãàçà
 ðàçëè÷íûõ ïðîèçâîäñòâåííûõ ïðîöåññàõ, ñâÿçàííûõ ñ ïåðåðàáîòêîé ðóä, ñîäåðæàùèõ ñåðíèñòûå ñîåäèíåíèÿ, ïðîèñõîäèò âûäåëåíèå áîëüøîãî ÷èñëà âðåäîíîñíûõ ãàçîâ.  ñâÿçè ñ ýòèì, âîçíèêàåò îñòðàÿ íåîáõîäèìîñòü â îáåñïå÷åíèè íàäëåæàùåãî êîíòðîëÿ íàä êîíöåíòðàöèåé ñåðíèñòîãî ãàçà â âîçäóõå.
Äëÿ ðàñ÷åòà ìàññîâîé êîíöåíòðàöèè äèîêñèäà ñåðû â àòìîñôåðíîì âîçäóõå âáëèçè èñòî÷íèêà âûáðîñîâ ñåðíèñòûõ ñîåäèíåíèé ïðèáåãàþò ê ìåòîäó èíòåãðèðîâàííîãî îòáîðà ïðîá. Ïîñëå âçÿòèÿ ïðîá, ëàáîðàíòû ïðîâîäÿò àíàëèç ìàññîâîé äîëè ñåðíèñòîãî ãàçà è îïðåäåëÿþò åãî êîíöåíòðàöèþ, ïîñðåäñòâîì õèìè÷åñêîãî àíàëèçà ñ ïðèâëå÷åíèåì àâòîìàòè÷åñêèõ èçìåðèòåëüíûõ ñèñòåì.
Çàïàõ ñåðíèñòîãî ãàçà
Ñåðíèñòûé ãàç îáëàäàåò ðåçêèì ñïåöèôè÷åñêèì çàïàõîì, ÷åì-òî íàïîìèíàþùèé çàïàõ ãîðåëîé ñïè÷êè. Êðàéíå îïàñíî íàõîäèòüñÿ â íåïîñðåäñòâåííîé çîíå âûáðîñà äèîêñèäà ñåðû, òàê êàê òîêñè÷íûé çàïàõ äàííîãî ñîåäèíåíèÿ ìîæåò ïðèâåñòè ê ñåðüåçíûì ïîñëåäñòâèÿì äëÿ âàøåãî çäîðîâüÿ. Ïðè âäûõàíèè ïàðîâ ãàçà, âîçíèêàåò óãðîçà ïîðàæåíèÿ ñëèçèñòîé îáîëî÷êè.
Ñèìïòîìû îòðàâëåíèÿ:
- êàøåëü;
- ðâîòà;
- ãîëîâîêðóæåíèå.
Åñëè æå êîíöåíòðàöèÿ âåùåñòâà ïðåâûøåíà, òî âîçíèêàåò îïàñíîñòü ïîðàæåíèÿ ïå÷åíè è êðîâåíîñíîé ñèñòåìû ÷åëîâåêà
ÏÄÊ ñåðíèñòîãî ãàçà
ÏÄÊ ñåðíèñòîãî ãàçà – ýòî ïðåäåëüíàÿ êîíöåíòðàöèÿ äèîêñèäà ñåðû. Ìàêñèìàëüíî äîïóñòèìàÿ ðàçîâàÿ äîëÿ ãàçà â âîçäóõå äîëæíà ñîñòàâëÿòü íå áîëåå 0,5 ìã/ì3. Ñðåäíåñóòî÷íîå çíà÷åíèå ñîñòàâëÿåò 0,05 ìã/ì3. Äîïóñòèìàÿ íîðìà äëÿ ðàáî÷åé çîíû (ïîìåùåíèÿ) íå äîëæíà ïðåâûøàòü 10 ìã/ì3.
Ñïîñîáû ïîëó÷åíèÿ è ïðîèçâîäñòâà ñåðíèñòîãî ãàçà
Ñóùåñòâóþò ðàçíîîáðàçíûå ñïîñîáû ïîëó÷åíèÿ äèîêñèäà ñåðû, è êàæäûé èç íèõ òðåáóåò èñïîëüçîâàíèå îñîáûõ òåõíè÷åñêèõ ñðåäñòâ è ïðèåìîâ. Îòëè÷èòåëüíîé ÷åðòîé êàæäîãî ñïîñîáà ïîëó÷åíèÿ ñåðíèñòîãî ãàçà ÿâëÿåòñÿ ïðèìåíåíèå ðàçëè÷íîãî ñåðîñîäåðæàùåãî ìàòåðèàëà.
Îäíèì èç ñïîñîáîâ ïîëó÷åíèÿ äèîêñèäà ñåðû ÿâëÿåòñÿ îáæèã êîë÷åäàíà. Ïðè îáæèãå ïðîèñõîäÿò ðàçíûå õèìè÷åñêèå ïðîöåññû, à èìåííî: ðåàêöèÿ òåðìè÷åñêîãî ðàçëîæåíèÿ äèñóëüôèäà æåëåçà, âñëåäñòâèå ÷åãî îáðàçóåòñÿ ñóëüôèä æåëåçà è ïðîèñõîäèò âûäåëåíèå ñåðû, íàõîäÿùåéñÿ â ïàðîîáðàçíîì ñîñòîÿíèè. Âûäåëåíèå ñåðû âîçíèêàåò ïðè íàãðåâàíèè âåùåñòâà äî òåìïåðàòóðû â 500 0Ñ ãðàäóñîâ, è ñ ïîñëåäóþùèì ïîâûøåíèåì òåìïåðàòóðû òîëüêî óâåëè÷èâàåò ñâîþ èíòåíñèâíîñòü. Çàòåì, ïàðû ñåðû ñãîðàþò, âûäåëÿÿ ïðè ýòîì äèîêñèä ñåðû. Îáðàçîâàíèå ñåðíèñòîãî ãàçà ïðè ìåäëåííîì îêèñëåíèè ïèðèòà ïðîèñõîäèò ïðè òåìïåðàòóðå 170-260 0Ñ ãðàäóñîâ. Òåìïåðàòóðà âîñïëàìåíåíèÿ êîë÷åäàíà âî ìíîãîì çàâèñèò îò ñòåïåíè òîãî, íàñêîëüêî ìåëêî îí èçìåëü÷åí. ×åì ìåíüøå, òåì ðàíüøå êîë÷åäàí âîñïëàìåíèòñÿ. Ïðèìåíåíèå ðàçëè÷íûõ ïðèñàäîê è êàòàëèçàòîðîâ ïîçâîëÿåò ðåãóëèðîâàòü òåìïåðàòóðíûå ïàðàìåòðû.
Ñëåäóþùèé ñïîñîá ïîëó÷åíèÿ ñåðíèñòîãî ãàçà – ñæèãàíèå ñåðû. Ýòîò ìåòîä ïðåäïîëàãàåò èñïîëüçîâàíèå ðàçëè÷íûõ âèäîâ ïå÷åé. Äëÿ òîãî ÷òîáû äîáèòüñÿ îïòèìàëüíîé êîíöåíòðàöèè ãàçà öåëåñîîáðàçíî èñïîëüçîâàòü ïå÷è â ðàñïûëåííîì ñîñòîÿíèè. Äàííûé ìåòîä ïîëó÷åíèå äèîêñèäà ñåðû â íåñêîëüêî ðàç ýôôåêòèâíåå ïðåäûäóùåãî ñïîñîáà. Ñ òåîðåòè÷åñêîé òî÷êè çðåíèÿ, ïðè îêèñëåíèè ñåðû 21% êèñëîðîäîì âîçäóõà, íà âûõîäå ìîæíî ïîëó÷èòü òîò æå 21% ñåðíèñòîãî ãàçà.  òîì ñëó÷àå, åñëè ïðîèçâîäèòü îáæèã ñåðû ñ íåçíà÷èòåëüíîé ïîäà÷åé âîçäóõà, òî ìîæíî äîáèòüñÿ ïîëó÷åíèÿ ãàçà ñ áîëüøîé êîíöåíòðàöèåé SO2. Íà ïðàêòèêå æå, äîáèòüñÿ òàêèõ ðåçóëüòàòîâ íå ïðåäñòàâëÿåòñÿ âîçìîæíûì èç-çà òîãî, ÷òî òàêîé ïðîöåññ ïîâëå÷åò çà ñîáîé ðåçêèé ðîñò òåìïåðàòóðû, ÷òî íåäîïóñòèìî äëÿ ïå÷è.
Ïîëó÷åíèå ñåðíèñòîãî ãàçà èç ïèðèòà
Ïèðèò ïðåäñòàâëÿåò ñîáîé öåííîå ñûðüå äëÿ ïîëó÷åíèé ñåðíèñòîãî ãàçà. Ïðè åãî îáæèãå ïîëó÷àþò äî 50% äèîêñèäà ñåðû. Ïðîöåññ ïîëó÷åíèÿ ñåðíèñòîãî ãàçà ñîñòîèò èç íåñêîëüêèõ ýòàïîâ. Âíà÷àëå ïèðèò îáæèãàþò â ïå÷àõ ðàçëè÷íîé êîíñòðóêöèè.  ïðîöåññå îáæèãà âûäåëÿåòñÿ çíà÷èòåëüíîå êîëè÷åñòâî òåïëà. Êîãäà òåìïåðàòóðà äîñòèãàåò îòìåòêè â 5000Ñ è áîëåå, ïèðèò íà÷èíàåò ðàñùåïëÿòüñÿ. Âî âðåìÿ ïðîöåññà ðàñùåïëåíèÿ ñãîðàåò ñåðà. Ïîñëå ýòîãî ñóëüôèä æåëåçà îêèñëÿåòñÿ, è îñòàòêè ñåðû ïåðåõîäÿò â ñåðíèñòûé ãàç.
Ïîëó÷åíèå ñåðíèñòîãî ãàçà èç ñóëüôèäà
Äàííûé ñïîñîá ìîæåò áûòü ðåàëèçîâàí â óñëîâèÿõ ëàáîðàòîðèè. Ïîëó÷åíèå äèîêñèäà ñåðû ïðîèñõîäèò ïîñðåäñòâîì âîçäåéñòâèÿ ñèëüíûõ êèñëîò íà ñóëüôèäû.  ðåçóëüòàòå òàêîãî âçàèìîäåéñòâèÿ, êèñëîòà ðàñïàäàåòñÿ íà âîäó è ñåðíèñòûé ãàç.
Âîññòàíîâëåíèå ñåðíèñòîãî ãàçà
Ïðîöåññ âîññòàíîâëåíèå äèîêñèäà ñåðû îñóùåñòâëÿåòñÿ êîêñîì èëè äðåâåñíûì óãëåì. Ïðè âîññòàíîâëåíèè äî ñåðû, âîçíèêàþò ðàçëè÷íûå íåæåëàòåëüíûå ðåàêöèè, ÷òî ïðèâîäèò ê ÷ðåçìåðíîìó ðàñõîäó âîññòàíîâèòåëüíîãî ìàòåðèàëà. Äëÿ äîñòèæåíèÿ æåëàåìîãî ðåçóëüòàòà, âî âðåìÿ âîññòàíîâèòåëüíîé ðåàêöèè äîëæíà ïîääåðæèâàòüñÿ òåìïåðàòóðà ïîðÿäêà 900-1200îÑ. Ïðîöåññ âîññòàíîâëåíèÿ ïðè ïîìîùè êîêñà ïðîõîäèò íàìíîãî ìåäëåííåå, ÷åì ñ äðåâåñíûì óãëåì.  óñëîâèÿõ ëàáîðàòîðèè, â ïðîöåññå âîññòàíîâëåíèÿ èñïîëüçóþò ìåòàí è æåëåçèñòûé áîêñèä, âûïîëíÿþùèé ðîëü êàòàëèçàòîðà.
Îáîðóäîâàíèå è àïïàðàòû ïîëó÷åíèÿ ñåðíèñòîãî ãàçà
Ïîëó÷åíèå ñåðíèñòîãî ãàçà â ïðîìûøëåííûõ óñëîâèÿõ ïðîèñõîäèò ðàçíûìè ñïîñîáàìè. Äëÿ îñíîâíîãî èç íèõ òðåáóåòñÿ äèîêñèä ýëåìåíòà.
Ýòîò ïðîöåññ äåëèòñÿ íà ÷åòûðå ýòàïà:
- ñåðíèñòûé àíãèäðèä ïîëó÷àþò â ïðîöåññå ñæèãàíèÿ ñåðû â ñïåöèàëüíûõ ïå÷àõ;
- î÷èñòêà äèîêñèäà ñåðû îò èìåþùèõñÿ ïðèìåñåé;
- îêèñëåíèå ïîñðåäñòâîì ïðèìåíåíèÿ êàòàëèçàòîðà;
- àáñîðáöèÿ òðèîêñèäà ñåðû ñ èñïîëüçîâàíèåì âîäû.
 çàâèñèìîñòè îò âûáðàííîãî ñïîñîáà ïîëó÷åíèÿ ñåðíèñòîãî ãàçà èñïîëüçóþòñÿ ðàçíûå âèäû îáîðóäîâàíèÿ.  îñíîâíîì â ïðîìûøëåííîñòè ïðèìåíÿþòñÿ óñòàíîâêè Êëàóñà, êîòîðûå ñîñòîÿò èç ïå÷è-ðåàêòîðà, åìêîñòè äåãàçàöèè, êîòëà-óòèëèçàòîðà è äðóãîãî îáîðóäîâàíèÿ. Îáîðóäîâàíèå èçãîòàâëèâàåòñÿ èç ìåòàëëà, êîòîðûé äîïîëíèòåëüíî ïîäâåðãàåòñÿ àíòèêîððîçèéíîé îáðàáîòêå.
Ïðîèçâîäèòåëè îáîðóäîâàíèÿ äëÿ ïîëó÷åíèÿ è î÷èñòêè ñåðíèñòîãî ãàçà
Îáîðóäîâàíèå äëÿ ïîëó÷åíèÿ è î÷èñòêè ñåðíèñòîãî ãàçà ïðîèçâîäèò óçêîå ÷èñëî ïðîèçâîäèòåëåé. Ñ öåëüþ çàêóïêè ñîîòâåòñòâóþùèõ óñòàíîâîê ïðîèçâîäèòåëÿì íóæíî îáðàùàòüñÿ â ñïåöèàëèçèðîâàííûå êîìïàíèè, êîòîðûå ïðåäîñòàâëÿþò óñëóãè ïî îáóñòðîéñòâó è ðåêîíñòðóêöèè ïðîìûøëåííûõ ïðåäïðèÿòèé.
Ñðåäè ïðîèçâîäèòåëåé ìîæíî îòìåòèòü êîìïàíèè:
- «Äàëüíåâîñòî÷íûé çàâîä ýíåðãåòè÷åñêîãî ìàøèíîñòðîåíèÿ» (Äàëüýíåðãîìàø), çàíèìàþùèéñÿ ïðîèçâîäñòâîì íàãíåòàòåëåé ñåðíèñòîãî ãàçà 400-12-2, 700-13-1, 1050-13-1, Ý 1700-11-2Ì;
- Ðîññèéñêîå ïðèáîðîñòðîèòåëüíîå ïðåäïðèÿòèå «ÎÏÒÝÊ» ñïåöèàëèçèðóåòñÿ â îáëàñòè àíàëèòè÷åñêîãî ïðèáîðîñòðîåíèÿ è çàíèìàåòñÿ âûïóñêîì õåìèëþìèíåñöåíòíîãî ãàçîàíàëèçàòîðà äèîêñèäà ñåðû â àòìîñôåðíîì âîçäóõå.
Ïðèìåíåíèå ñåðíèñòîãî ãàçà
Ñåðíèñòûé ãàç àêòèâíî èñïîëüçóåòñÿ íå òîëüêî â õèìè÷åñêîé ïðîìûøëåííîñòè, íî è â ðàçíûõ îòðàñëÿõ ýêîíîìèêè. Äèîêñèä ñåðû îòëè÷àåòñÿ õîðîøèìè äåçèíôèöèðóþùèìè ñâîéñòâàìè, ïîýòîìó åãî àêòèâíî ïðèìåíÿþò â áîðüáå ñ ðàçëè÷íûìè áàêòåðèÿìè è ãðèáêàìè. Ñåðíèñòûì àíãèäðèäîì îêóðèâàþò ïîìåùåíèÿ, â êîòîðûõ õðàíèòñÿ ñåëüñêîõîçÿéñòâåííàÿ ïðîäóêöèÿ èëè âèííûå áî÷êè, à òàêæå ïîäâàëû.
Ñåðíèñòûé ãàç àêòèâíî ïðèìåíÿåòñÿ â ïèùåâîé ïðîìûøëåííîñòè. Ñåðíèñòûé ãàç èñïîëüçóþò â êà÷åñòâå àíòèáàêòåðèàëüíîãî è êîíñåðâèðóþùåãî ñðåäñòâà.  äèîêñèäå ñåðû ìîæíî âûìà÷èâàòü ñâåæèå ïëîäû èëè äîáàâëÿòü â ñèðîïû. Íàïðèìåð, ñóëüôèòèçàöèÿ ñîêà ñàõàðíîé ñâåêëû îáåñïå÷èâàåò îáåççàðàæèâàíèå ñûðüÿ è åãî îáåñöâå÷èâàíèå. Äèîêñèä ñåðû ñîäåðæèòñÿ â êîíñåðâèðîâàííûõ ñîêàõ è îâîùíûõ ïþðå äëÿ ïðåäîòâðàùåíèÿ îêèñëåíèÿ ïðîäóêöèè. Ñåðíèñòûé ãàç íàøåë ñâîå ïðèìåíåíèå è â äðóãèõ ïðîèçâîäñòâåííûõ è ïðîìûøëåííûõ îòðàñëÿõ.
Ïîëó÷åíèå ñåðû èç ñåðíèñòîãî ãàçà
 ñîâðåìåííûõ óñëîâèÿõ ïðîèçâîäèòåëè èñïîëüçóþò ñëåäóþùèå ìåòîäû Êëàóñà ñ öåëüþ ïîëó÷åíèÿ ñåðíûé è ñåðíèñòîãî ãàçà:
- Ïðÿìîòî÷íûé ïðîöåññ. Èñïîëüçóþò, åñëè â êèñëûõ ãàçàõ îáúåì ñåðîâîäîðîäà ïðåâûøàåò 50%, à óãëåâîäîðîäîâ ìåíüøå 2%. Ýòîò ìåòîä ïîäðàçóìåâàåò ïîäà÷ó ãàçà íà ñæèãàíèå â ïå÷ü-ðåàêòîð ñïåöèàëüíîé óñòàíîâêè, â êîòîðîé òàêæå ïðèñóòñòâóåò êîòåë-óòèëèçàòîð.  òîïêå ïå÷è òåìïåðàòóðà ñïîñîáíà äîñòèãíóòü 1100-1300 °Ñ. Ïðè÷åì âûõîä ñåðû ñïîñîáåí ñîñòàâèòü äî 70%. Äàëåå, ïîëó÷åíèå ñåðû ïîäðàçóìåâàåò èñïîëüçîâàíèå êàòàëèçàòîðîâ ïðè ìàêñèìàëüíîé òåìïåðàòóðå 220-260 °Ñ.  ðåçóëüòàòå ïðîõîæäåíèÿ êàæäîãî ýòàïà ïàðû ñåðû áóäóò êîíäåíñèðîâàòüñÿ íà ïîâåðõíîñòÿõ. Ïðè ñãîðàíèè ñåðîâîäîðîäà âûäåëèòñÿ òåïëî, ïðèìåíÿåìîå äëÿ ñîçäàíèÿ ïàðà íèçêîãî è âûñîêîãî äàâëåíèÿ.  ðåçóëüòàòå ïîëó÷åíèå ñåðû ñïîñîáíî ñîñòàâèòü äî 97%.
- Ðàçâåòâëåííûé ïðîöåññ. Ìîæåò èñïîëüçîâàòüñÿ, åñëè â êèñëîòíûõ ãàçàõ îáúåì ñåðîâîäîðîäà ñîñòàâëÿåò îêîëî 40%, à óãëåâîäîðîä íå ïðåâûøàåò 2%.  ðåçóëüòàòå ñæèãàþò îäíó òðåòüþ ãàçà ñ ïîñëåäóþùèì ïîëó÷åíèåì ñåðíèñòîãî àíãèäðèäà. Îñòàâøååñÿ âåùåñòâî ïîñòóïàåò íà ñïåöèàëüíóþ êàòàëèòè÷åñêóþ ñòóïåíü, à íå â ïå÷ü ðåàêòîð, êàê â ïðåäûäóùåì ñïîñîáå.  ðåçóëüòàòå âçàèìîäåéñòâèÿ ñåðîâîäîðîäà è ñåðíèñòîãî àíãèäðèäà ïîëó÷àåò äî 95% ñåðû.
- Ñõåìà ñ ïðåäâàðèòåëüíûì ïîäîãðåâîì âîçäóõà èëè ãàçà. Åñëè îáúåì ñåðîâîäîðîäà â ãàçå íå ïðåâûøàåò 30%, èñïîëüçóþò âòîðóþ ñõåìó, íî ìèíèìàëüíàÿ òåìïåðàòóðà â ïðîöåññå ðàáîòû òîïêè ïå÷è-ðåàêòîðå äîëæíà ñîñòàâëÿòü 930 °Ñ.
- Ñõåìà ïðÿìîãî îêèñëåíèÿ. Ïðèìåíÿåòñÿ, åñëè â ãàçå îáúåì ñåðîâîäîðîäà ñîñòàâëÿåò íå áîëåå 15%. Ïðè ýòîì íå ïðèìåíÿåòñÿ ñòàäèÿ ñæèãàíèÿ ãàçà ïîä âûñîêîé òåìïåðàòóðîé. Äèîêñèä ñåðû ñìåøèâàþò ñ âîçäóõîì è ïàäàþò íà êàòàëèòè÷åñêóþ ñòóïåíü êîíâåðñèè.  ðåçóëüòàòå ïîëó÷àþò äî 86% ñåðû.
Ñåðíèñòûé ãàç èñïîëüçóþò äëÿ îòáåëèâàíèÿ òêàíåé
Îäíîé èç ñôåð ïðèìåíåíèÿ ÿâëÿåòñÿ òåêñòèëüíîå ïðîèçâîäñòâî, ãäå èñïîëüçóþò ñåðíèñòûé ãàç, à òàêæå ïðîäóêòû õèìè÷åñêîãî âçàèìîäåéñòâèÿ. Ïîòðåáíîñòü â ýòèõ õèìè÷åñêèõ âåùåñòâàõ âîçíèêàåò, áëàãîäàðÿ õîðîøèì îòáåëèâàþùèì ñâîéñòâàì äèîêñèäà ñåðû.
Òåêñòèëüíûå êîìáèíàòû ïðèìåíÿþò ðàññìàòðèâàåìîå âåùåñòâî ñ öåëüþ îòáåëèâàíèÿ òêàíåé, ñîçäàííûõ èç øåðñòè è øåëêà. Ýòîò ìåòîä ÿâëÿåòñÿ îäíèì èç àêòóàëüíûõ âèäîâ îòáåëèâàíèÿ áåç ïðèìåíåíèÿ õëîðêè. Ïðåèìóùåñòâî ïðîöåäóðû ñîñòîèò â òîì, ÷òî âîëîêíà íå áóäóò ðàçðóøåíû.
Çàãðÿçíåíèå ñåðíèñòûì ãàçîì
Ñîåäèíåíèÿ ñåðû ñïîñîáíû ïðèâåñòè ê ñåðüåçíûì çàãðÿçíåíèÿì àòìîñôåðû. Îñíîâíûìè èñòî÷íèêàìè ñåðíèñòîãî ãàçà ÿâëÿåòñÿ âóëêàíè÷åñêàÿ äåÿòåëüíîñòü, à òàêæå ïðîöåññû îêèñëåíèÿ ñåðîâîäîðîäà.
Ïî äàííûì èññëåäîâàòåëåé, åæåãîäíî â àòìîñôåðó ïîïàäàåò ïðèìåðíî 4 ìèëëèîíîâ òîíí ñåðíèñòîãî ãàçà â ðåçóëüòàòå âóëêàíè÷åñêîé äåÿòåëüíîñòè, à 200 ìèëëèîíîâ òîíí îáðàçîâûâàåòñÿ è ñåðîâîäîðîäà. Áîëüøîé óùåðá òàêæå ïðèíîñÿò ïðîìûøëåííûå èñòî÷íèêè. Âàæíî ó÷èòûâàòü, ÷òî ñåðíèñòûé ãàç ÿâëÿåòñÿ ÿäîâèòûì è ïðåäñòàâëÿåò óãðîçó äëÿ çäîðîâüÿ ëþäåé è æèâîòíûõ, à òàêæå ïðè÷èíÿåò óùåðá ðàñòèòåëüíîñòè.
Îòðàâëåíèå ñåðíèñòûì ãàçîì
Ñåðíèñòûé ãàç îòëè÷àåòñÿ ðàçäðàæàþùèì äåéñòâèåì íà ñëèçèñòûå îáîëî÷êè. Îáúÿñíÿåòñÿ ýòî òåì, ÷òî âåùåñòâî ïðè êîíòàêòå ñ âîäîé îáðàçóåò ñåðíóþ è ñåðíèñòóþ êèñëîòû.  ðåçóëüòàòå îíà îêàçûâàåò ðåçîðáòèâíîå äåéñòâèå, êîòîðîå ïðèâîäèò ê íàðóøåíèþ ôåðìåíòàòèâíûõ è îáìåííûõ ïðîöåññîâ.
Ïðè íåáîëüøîé êîíöåíòðàöèè ñåðíèñòîãî ãàçà ïîÿâëÿåòñÿ ðàçäðàæåíèå ãëàç è âåðõíèõ äûõàòåëüíûõ ïóòåé, ãèïåðåìèÿ ñëèçèñòûõ îáîëî÷åê, ïåðøåíèå â ãîðëå, íàñìîðê, êàøåëü è îõðèïëîñòü ãîëîñà. Ïðè áîëåå âûñîêîé êîíöåíòðàöèè âîçíèêàåò âîñïàëåíèå èëè îæîã ñëèçèñòûõ îáîëî÷åê íîñîãëîòêè, ãëàç, áðîíõîâ è òðàõåè.
Òÿæåëîå îòðàâëåíèå ñïîñîáíî ïðèâåñòè ê ãíîéíûì áðîíõèòàì, îñòðîé ýìôèçåìå è òîêñè÷åñêîé ïíåâìîíèè. Äîïîëíèòåëüíûìè ñèìïòîìàìè ÿâëÿåòñÿ ðàññòðîéñòâî ñîçíàíèÿ. Âäûõàíèå ñåðíèñòîãî ãàçà ñ áîëüøîé êîíöåíòðàöèåé ñïîñîáíî ïðèâåñòè ê ðåôëåêòîðíîìó ñïàçìó ãîëîñîâîé ùåëè è ó ïîñòðàäàâøåãî áóäåò íàáëþäàòüñÿ îùóùåíèå óäóøüÿ. Åñëè ñåðíèñòûé ãàç â æèäêîì âèäå ïîïàäåò â ãëàçà, âåðõíèå ñëîè ðîãîâèöû ìîãóò áûòü óíè÷òîæåíû, ÷òî îñîáåííî îïàñíî äëÿ çðåíèÿ. Ïðè ïîïàäàíèè íà êîæó ñíà÷àëà ïîÿâëÿåòñÿ ïîáëåäíåíèå, à çàòåì, ãèïåðåìèÿ è îáðàçîâàíèå ïóçûðåé.  òàêèõ ñèòóàöèÿõ ïîìîùü ïîñòðàäàâøèì äîëæíà áûòü îêàçàíà íåçàìåäëèòåëüíî.
Î÷èñòêà ãàçà îò ñåðíèñòûõ ñîåäèíåíèé
Î÷èñòêà ãàçà îò ñåðíèñòûõ ñîåäèíåíèé âûïîëíÿåòñÿ çà ñ÷åò ïðîïóñêàíèÿ ÷åðåç êàòàëèçàòîð íèçêîòåìïåðàòóðíîé êîíâåðñèè îêèñè óãëåðîäà, îòðàáîòàííîãî â ïðîöåññå ïðîèçâîäñòâà àììèàêà. Òàêîé êàòàëèçàòîð ñîçäàþò íà îñíîâå ìåäè, õðîìà è öèíêà. Äàííûé ñïîñîá ïîëó÷åíèÿ îòíîñÿò ê ìåòîäàì òîíêîé î÷èñòêè ãàçîâ.
Î÷èñòêà îò ñåðíèñòûõ ñîåäèíåíèé ìîæåò ïðîèçâîäèòüñÿ è ïîñðåäñòâîì ïðîïóñêàíèÿ ãàçà ñ ïîìîùüþ êàòàëèçàòîðà ïðè òåìïåðàòóðå îò 200 äî 400 0C. Ïðè ýòîì ïîääåðæèâàåòñÿ äàâëåíèå îò 20 äî 30 àòì. Íåäîñòàòîê ïðåäñòàâëåííûõ ñïîñîáîâ ñîñòîèò â òîì, ÷òî ïðîöåññ îñóùåñòâëÿåòñÿ ñ ïðèìåíåíèåì êàòàëèçàòîðà âûñîêîé ñòîèìîñòè. Êëþ÷åâàÿ çàäà÷à ïðîèçâîäèòåëåé – ïîëó÷åíèå ñåðíèñòîãî ãàçà ñ ìèíèìàëüíûìè çàòðàòàìè. Ïðîáëåìó ìîæíî ðåøèòü ïîñðåäñòâîì î÷èñòêè ñ ïîìîùüþ ñïåöèàëüíîãî ïîãëîòèòåëÿ ñåðíèñòûõ ñîåäèíåíèé, êîòîðûé äîëæåí áûòü ïðèãîòîâëåí â ñîîòâåòñòâèè ñ òðåáîâàíèÿìè ÒÓ 113-03-2001-91.
Õèìè÷åñêîå ìàøèíîñòðîåíèå
Îòõîäû ïðåäïðèÿòèé
Ìèíåðàëüíîå ñûðüå
Источник
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).

Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
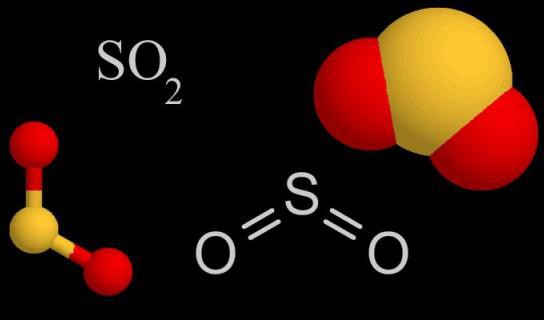
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).

Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.

Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + H2SO3;
- Na2SO3 + H2SO4 (разб.) = Na2SO4 + H2SO3;
- H2SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑.
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).

Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2H2S = 3S + 2H2O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли – сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.

Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Источник
