Какими свойствами обладает сероводород

Сероводород
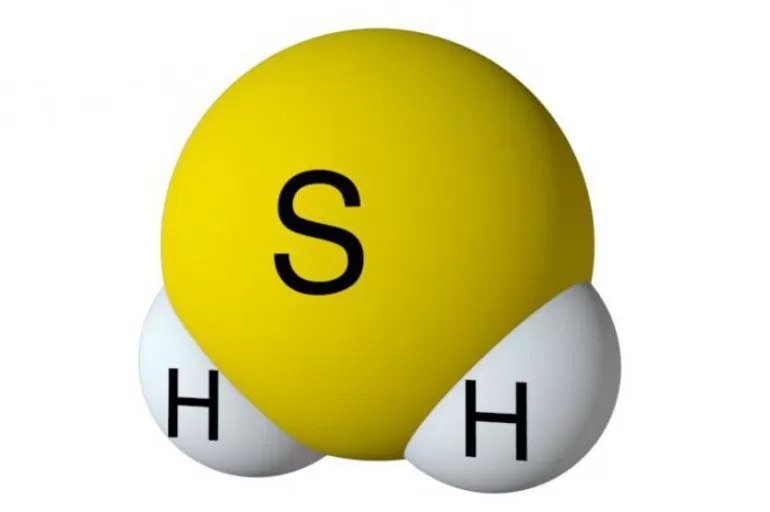
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.

Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
Сероводород – бинарное химическое соединение водорода и серы, имеющее формулу H2S.
Сероводород, формула, молекула, строение, состав, вещество:
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) – бесцветный газ со сладковатым вкусом с характерным неприятным тяжёлым запахом тухлых яиц (тухлого мяса).
Сероводород – бинарное химическое соединение водорода и серы, имеющее формулу H2S.
Химическая формула сероводорода H2S.
Строение молекулы сероводорода, структурная формула сероводорода:
Сероводород – наиболее активное из серосодержащих соединений.
Сероводород тяжелее воздуха. Его плотность составляет 1,539 кг/м3, по отношении к воздуху – 1,19. Поэтому скапливается в низких непроветриваемых местах.
Сероводород плохо растворяется в воде. Раствор сероводорода в воде – очень слабая сероводородная кислота. Хорошо растворим в бензоле и этаноле.
Термически устойчив при температурах менее 400 °C. При температурах более 400 °C разлагается на составляющие – простые вещества: водород и серу.
В отличие от воды, в сероводороде не образуются водородные связи, поэтому сероводород в обычных условиях не сжижается.
Сероводород является сверхпроводником при температуре 203 К (-70 °C) и давлении 150 ГПа.
Сероводород коррозионно активен, поэтому предъявляются дополнительные требования при разработке нефтяных, газовых и газоконденсатных месторождений, содержащий сероводород.
Чрезвычайно огнеопасен. Смеси сероводорода и воздуха взрывоопасны. Возможно возгорание на расстоянии. Горит синим пламенем.
Соли сероводородной кислоты (раствор сероводорода в воде) называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок в ходе химических реакций. Многие сульфиды ярко окрашены. Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
Сероводород в природе встречается редко, в незначительных количествах в составе природного газа, попутного нефтяного газа, сланцевого газа, а также в вулканических газах, в растворённом виде – в нефти, сланцевой нефти и в природных водах. Например, в Чёрном море слои воды, расположенные глубже 150-200 м, содержат растворённый сероводород (концентрация 14 мл/л).
Образуется при гниении белков, которые содержат в составе серосодержащие аминокислоты метионин и (или) цистеин. Небольшое количество сероводорода содержится в кишечных газах человека и животных.
Сероводород высокотоксичен и ядовит. Предельно допустимая концентрация (ПДК) сероводорода в воздухе населенных пунктов в России – 0,008 мг/м3, в России – 0,007 мг/м3.
Порог ощутимости запаха составляет 0,012-0,03 мг/м3. При вдыхании воздуха с небольшими концентрациями у человека довольно быстро возникает адаптация к неприятному запаху «тухлых яиц» и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус. При вдыхании воздуха с большой концентрацией из-за паралича обонятельного нерва запах сероводорода почти сразу перестаёт ощущаться.
При острых отравлениях возникает жжение и боль в горле при глотании, конъюнктивит, одышка, головная боль, головокружение, слабость, рвота, тахикардия, возможны судороги. Смертельная концентрация составляет 830 мг/м3 в течение 30 минут или 1100 мг/м3 в течение 5 минут.
При высокой концентрации сероводорода однократное вдыхание может вызвать мгновенную смерть.
Физические свойства сероводорода:
| Наименование параметра: | Значение: |
| Химическая формула | H2S |
| Синонимы и названия иностранном языке | hydrogen sulfide (англ.) водород сернистый (рус.) водорода сульфид (рус.) сероводородная кислота (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветный газ |
| Цвет | бесцветный |
| Вкус | сладковатый |
| Запах | неприятный тяжёлый запах тухлых яиц (тухлого мяса) |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (состояние вещества – твердое вещество, при -86 °C), кг/м3 | 1120 |
| Плотность (состояние вещества – твердое вещество, при -86 °C), г/см3 | 1,12 |
| Плотность (состояние вещества – жидкость, при -81 °C), кг/м3 | 938 |
| Плотность (состояние вещества – жидкость, при -81 °C), г/см3 | 0,938 |
| Плотность (состояние вещества – газ, при 0 °C), кг/м3 | 1,539 |
| Плотность (состояние вещества – газ, при 0 °C), г/см3 | 0,001539 |
| Температура кипения, °C | -60,28 |
| Температура плавления, °C | -85,6 |
| Температура самовоспламенения, °C | 260 |
| Критическая температура*, °C | 100,4 |
| Критическое давление, МПа | 9,01 |
| Критический удельный объём, м3/кг | 349 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | 4,3 – 46 |
| Молярная масса, г/моль | 34,082 |
| Растворимость в воде (20 oС), г/100 г | 0,379 |
| Сверхпроводимость | -70 °C, давление 150 ГПа |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Получение сероводорода:
Сероводород в лаборатории получают в результате следующих химических реакций:
- взаимодействия разбавленных кислот с сульфидами, например, с сульфидом железа.
- взаимодействия сульфида алюминия и воды:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S.
Данная реакция отличается чистотой полученного сероводорода
Химические свойства сероводорода. Химические реакции (уравнения) сероводорода:
Основные химические реакции сероводорода следующие:
1. реакция взаимодействия сероводорода и брома:
H2S + Br2 → 2HBr + S.
В результате реакции образуются бромоводород и сера. В ходе реакции используется насыщенный раствор сероводорода.
2. реакция взаимодействия сероводорода и йода:
H2S + I2 → 2HI + S.
В результате реакции образуются йодоводород и сера. В ходе реакции используется насыщенный раствор сероводорода.
3. реакция взаимодействия сероводорода и кислорода:
2H2S + O2 → 2S + 2H2O.
В результате реакции образуются сера и вода. Реакция протекает медленно на свету, в растворе или в газовой фазе. Сероводород в ходе реакции используется в виде насыщенного раствора. На данной реакции основан промышленный способ получения серы.
4. реакция горения сероводорода:
2H2S + 3O2 2SO2 + 2H2O (t = 250-300 °C).
В результате реакции образуются оксид серы и вода. Реакция горения сероводорода на воздухе.
5. реакция взаимодействия сероводорода и озона:
H2S + O3 → SO2 + H2O.
В результате реакции образуются оксид серы и вода. Сероводород в ходе реакции используется в виде газа.
6. реакция взаимодействия сероводорода и кремния:
Si + 2H2S SiS2 + 2H2 (t = 1200-1300 °C).
В результате реакции образуются сульфид кремния и водород.
7. реакция взаимодействия сероводорода и цинка:
H2S + Zn ZnS + H2 (t = 400-800 °C).
В результате реакции образуются сульфид цинка и водород.
8. реакция взаимодействия сероводорода и алюминия:
2Al + 3H2S Al2S3 + 3H2 (t = 600-1000 °C).
В результате реакции образуются сульфид алюминия и водород.
9. реакция взаимодействия сероводорода и галлия:
2Ga + H2S → Ga2S + H2.
В результате реакции образуются сульфид галлия и водород.
10. реакция взаимодействия сероводорода и молибдена:
Mo + 2H2S MoS2 + 2H2 (t > 800 °C).
В результате реакции образуются сульфид молибдена и водород.
11. реакция взаимодействия сероводорода и бария:
Ba + H2S BaS + H2 (t > 350 °C).
В результате реакции образуются сульфид бария и водород.
12. реакция взаимодействия сероводорода и магния:
Mg + H2S MgS + H2 (t = 500 °C).
В результате реакции образуются сульфид магния и водород.
13. реакция взаимодействия сероводорода и германия:
Ge + H2S GeS + H2 (t = 600-800 °C).
В результате реакции образуются сульфид германия и водород.
14. реакция взаимодействия сероводорода и кобальта:
Co + H2S CoS + H2 (t = 700 °C).
В результате реакции образуются сульфид кобальта и водород.
15. реакция взаимодействия сероводорода и серебра:
2Ag + H2S → Ag2S + H2.
В результате реакции образуются сульфид серебра и водород.
16. реакция взаимодействия сероводорода и оксида лития:
Li2O + H2S Li2S + H2O (t = 900-1000 °C).
В результате реакции образуются сульфид лития и вода.
17. реакция взаимодействия сероводорода и оксида цинка:
ZnO + H2S ZnS + H2O (t = 450-550 °C).
В результате реакции образуются сульфид цинка и вода.
18. реакция взаимодействия сероводорода и оксида железа:
FeO + H2S FeS + H2O (t = 500 °C).
В результате реакции образуются сульфид железа и вода.
19. реакция взаимодействия сероводорода и оксида молибдена:
MoO2 + 2H2S MoS2 + 2H2O (t = 400 °C).
В результате реакции образуются сульфид молибдена и вода.
20. реакция взаимодействия сероводорода и гидроксида натрия:
H2S + 2NaOH → Na2S + 2H2O.
В результате реакции образуются сульфид натрия и вода. В ходе реакции используется концентрированный раствор гидроксида натрия.
21. реакция взаимодействия сероводорода и гидроксида бария:
Ba(OH)2 + H2S → BaS + 2H2O.
В результате реакции образуются сульфид бария и вода. В ходе реакции используется разбавленный раствор сероводорода.
22. реакция взаимодействия сероводорода и гидроксида меди:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди и вода. В ходе реакции используется насыщенный раствор сероводорода и гидроксид меди в виде суспензии.
23. реакция взаимодействия сероводорода и азотной кислоты:
H2S + 2HNO3 → S + 2NO2 + 2H2O.
В результате реакции образуются сера, оксид азота и вода. В ходе реакции используется насыщенный раствор сероводорода и концентрированный холодный раствор азотной кислоты.
Аналогичные реакции протекают и с другими минеральными кислотами.
24. реакция взаимодействия сероводорода и карбоната кальция:
CaCO3 + H2S CaS + H2O + CO2 (t = 900 °C).
В результате реакции образуются сульфид кальция, оксид углерода и вода.
25. реакция взаимодействия сероводорода и карбоната бария:
BaCO3 + H2S BaS + CO2 + H2O (t = 1000 °C, kat = H2).
В результате реакции образуются сульфид бария, оксид углерода и вода.
26. реакция взаимодействия сероводорода и карбоната натрия:
H2S + Na2CO3 → NaHS + NaHCO3 (t = 1000 °C, kat = H2).
В результате реакции образуются гидросульфид натрия и гидрокарбонат натрия. В ходе реакции используется насыщенный раствор сероводорода.
27. реакция взаимодействия сероводорода и нитрата серебра:
2AgNO3 + H2S → Ag2S + 2HNO3.
В результате реакции образуются сульфид серебра и азотная кислота. В ходе реакции используется насыщенный раствор сероводорода.
28. реакция взаимодействия сероводорода и нитрата висмута:
2Bi(NO3)3 + 3H2S → Bi2S3 + 6HNO3.
В результате реакции образуются сульфид висмута и азотная кислота. В ходе реакции используется насыщенный раствор сероводорода.
29. реакция взаимодействия сероводорода и нитрата свинца:
Pb(NO3)2 + H2S → PbS + HNO3.
В результате реакции образуются сульфид свинца и азотная кислота. Данная реакция является качественной реакцией на сероводород. В результате реакции образуются соль свинца – сульфид свинца черного цвета, который выпадает в осадок.
30. реакция термического разложения сероводорода:
H2S H2 + S (t = 400-1700 °C).
В результате реакции образуются водород и сера. В ходе реакции используется насыщенный раствор сероводорода.
Применение сероводорода:
Из-за своей токсичности сероводород находит ограниченное применение:
- в аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы;
- в медицине в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод;
- в химической промышленности для получения серной кислоты, элементной серы, сульфидов;
- в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Ссылка на источник
Источник
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений. В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м. Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики

Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34. 10-29 Кл.м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O. Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O. Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.

В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S-2 = 2HBr + S0.
- 4Cl 2 + 4H 2 O +H 2 S-2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S-2 = S0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии. Средние соли с содержанием аниона S2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными. Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М2+(Н S)2 и M+ HS. Нестойкими являются гидросульфиды Ca2+ Sr2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот. Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно. В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения. Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом. Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:

- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий. Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров. Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.

Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси. Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие. Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа. Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови. В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.
В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.

Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей. Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.
Источник
