Какими свойствами обладает углекислый газ

Газировка, вулкан, Венера, рефрижератор – что между ними общего? Углекислый газ. Мы собрали для Вас самую интересную информацию об одном из самых важных химических соединений на Земле.
Что такое диоксид углерода
Диоксид углерода известен в основном в своем газообразном состоянии, т.е. в качестве углекислого газа с простой химической формулой CO2. В таком виде он существует в нормальных условиях – при атмосферном давлении и «обычных» температурах. Но при повышенном давлении, свыше 5 850 кПа (таково, например, давление на морской глубине около 600 м), этот газ превращается в жидкость. А при сильном охлаждении (минус 78,5°С) он кристаллизуется и становится так называемым сухим льдом, который широко используется в торговле для хранения замороженных продуктов в рефрижераторах.
Жидкая углекислота и сухой лед получаются и применяются в человеческой деятельности, но эти формы неустойчивы и легко распадаются.
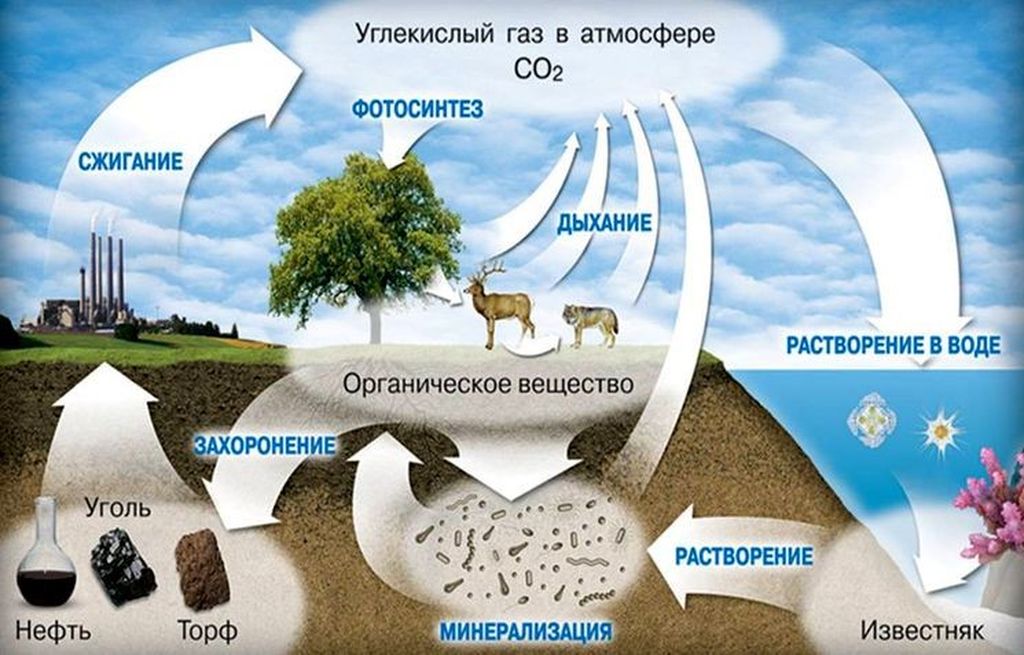
А вот газообразный диоксид углерода распространен повсюду: он выделяется в процессе дыхания животных и растений и является важной составляющей частью химического состава атмосферы и океана.
Свойства углекислого газа
Углекислый газ CO2 не имеет цвета и запаха. В обычных условиях он не имеет и вкуса. Однако при вдыхании высоких концентраций диоксида углерода можно почувствовать во рту кисловатый привкус, вызванный тем, что углекислый газ растворяется на слизистых и в слюне, образуя слабый раствор угольной кислоты.
Кстати, именно способность диоксида углерода растворяться в воде используется для изготовления газированных вод. Пузырьки лимонада – тот самый углекислый газ. Первый аппарат для насыщения воды CO2 был изобретен еще в 1770 г., а уже в 1783 г. предприимчивый швейцарец Якоб Швепп начал промышленное производство газировки (торговая марка Schweppes существует до сих пор).
Углекислый газ тяжелее воздуха в 1,5 раза, поэтому имеет тенденцию «оседать» в его нижних слоях, если помещение плохо вентилируется. Известен эффект «собачьей пещеры», где CO2 выделяется прямо из земли и накапливается на высоте около полуметра. Взрослый человек, попадая в такую пещеру, на высоте своего роста не ощущает избытка углекислого газа, а вот собаки оказываются прямо в густом слое диоксида углерода и подвергаются отравлению.
CO2 не поддерживает горение, поэтому его используют в огнетушителях и системах пожаротушения. Фокус с тушением горящей свечки содержимым якобы пустого стакана (а на самом деле — углекислым газом) основан именно на этом свойстве диоксида углерода.
Углекислый газ в природе: естественные источники
Углекислый газ в природе образуется из различных источников:
- Дыхание животных и растений.
Каждому школьнику известно, что растения поглощают углекислый газ CO2 из воздуха и используют его в процессах фотосинтеза. Некоторые хозяйки пытаются обилием комнатных растений искупить недостатки приточной вентиляции. Однако растения не только поглощают, но и выделяют углекислый газ в отсутствие света – это часть процесса дыхания. Поэтому джунгли в плохо проветриваемой спальне – не очень хорошая идея: ночью уровень CO2 будет расти еще больше. - Вулканическая деятельность.
Диоксид углерода входит в состав вулканических газов. В местностях с высокой вулканической активностью CO2 может выделяться прямо из земли – из трещин и разломов, называемых мофетами. Концентрация углекислого газа в долинах с мофетами столь высока, что многие мелкие животные, попав туда, умирают. - Разложение органических веществ.
Углекислый газ образуется при горении и гниении органики. Объемные природные выбросы диоксида углерода сопутствуют лесным пожарам.
Углекислый газ «хранится» в природе в виде углеродных соединений в полезных ископаемых: угле, нефти, торфе, известняке. Гигантские запасы CO2 содержатся в растворенном виде в мировом океане.
Выброс углекислого газа из открытого водоема может привести к лимнологической катастрофе, как это случалось, например, в 1984 и 1986 гг. в озерах Манун и Ньос в Камеруне. Оба озера образовались на месте вулканических кратеров – ныне они потухли, однако в глубине вулканическая магма все еще выделяет углекислый газ, который поднимается к водам озер и растворяется в них. В результате ряда климатических и геологических процессов концентрация углекислоты в водах превысила критическое значение. В атмосферу было выброшено огромное количество углекислого газа, который наподобие лавины спустился по горным склонам. Жертвами лимнологических катастроф на камерунских озерах стали около 1 800 человек.
Искусственные источники углекислого газа
Основными антропогенными источниками диоксида углерода являются:
- промышленные выбросы, связанные с процессами сгорания;
- автомобильный транспорт.
Несмотря на то, что доля экологичного транспорта в мире растет, подавляющая часть населения планеты еще не скоро будет иметь возможность (или желание) перейти на новые автомобили.
Активное сведение лесов в промышленных целях также ведет к повышению концентрации углекислого газа СО2 в воздухе.
Углекислый газ в организме человека
CO2 – один из конечных продуктов метаболизма (расщепления глюкозы и жиров). Он выделяется в тканях и переносится при помощи гемоглобина к легким, через которые выдыхается. В выдыхаемом человеком воздухе около 4,5% диоксида углерода (45 000 ppm) – в 60-110 раз больше, чем во вдыхаемом.
Углекислый газ играет большую роль в регуляции кровоснабжения и дыхания. Повышение уровня CO2 в крови приводит к тому, что капилляры расширяются, пропуская большее количество крови, которое доставляет к тканям кислород и выводит углекислоту.
Дыхательная система тоже стимулируется повышением содержания углекислого газа, а не нехваткой кислорода, как может показаться. В действительности нехватка кислорода долго не ощущается организмом и вполне возможна ситуация, когда в разреженном воздухе человек потеряет сознание раньше, чем почувствует нехватку воздуха. Стимулирующее свойство CO2 используется в аппаратах искусственного дыхания: там углекислый газ подмешивается к кислороду, чтобы «запустить» дыхательную систему.
Углекислый газ и мы: чем опасен СO2
Углекислый газ необходим человеческому организму так же, как кислород. Но так же, как с кислородом, переизбыток углекислого газа вредит нашему самочувствию.
Большая концентрация CO2 в воздухе приводит к интоксикации организма и вызывает состояние гиперкапнии. При гиперкапнии человек испытывает трудности с дыханием, тошноту, головную боль и может даже потерять сознание. Если содержание углекислого газа не снижается, то далее наступает черед гипоксии – кислородного голодания. Дело в том, что и углекислый газ, и кислород перемещаются по организму на одном и том же «транспорте» – гемоглобине. В норме они «путешествуют» вместе, прикрепляясь к разным местам молекулы гемоглобина. Однако повышенная концентрация углекислого газа в крови понижает способность кислорода связываться с гемоглобином. Количество кислорода в крови уменьшается и наступает гипоксия.
Такие нездоровые для организма последствия наступают при вдыхании воздуха с содержанием CO2 больше 5 000 ppm (таким может быть воздух в шахтах, например). Справедливости ради, в обычной жизни мы практически не сталкиваемся с таким воздухом. Однако и намного меньшая концентрация диоксида углерода отражается на здоровье не лучшим образом.
Согласно выводам некоторых исследований, уже 1 000 ppm CO2 вызывает у половины испытуемых утомление и головную боль. Духоту и дискомфорт многие люди начинают ощущать еще раньше. При дальнейшем повышении концентрации углекислого газа до 1 500 – 2 500 ppm критически снижается работоспособность, мозг «ленится» проявлять инициативу, обрабатывать информацию и принимать решения.
И если уровень 5 000 ppm почти невозможен в повседневной жизни, то 1 000 и даже 2 500 ppm легко могут быть частью реальности современного человека. Наш эксперимент в школе показал, что в редко проветриваемых школьных классах уровень CO2 значительную часть времени держится на отметке выше 1 500 ppm, а иногда подскакивает выше 2 000 ppm. Есть все основания предполагать, что во многих офисах и даже квартирах ситуация похожая.
Безопасным для самочувствия человека уровнем углекислого газа физиологи считают 800 ppm.
Еще одно исследование обнаружило связь между уровнем CO2 и окислительным стрессом: чем выше уровень диоксида углерода, тем больше мы страдаем от окислительного стресса, который разрушает клетки нашего организма.
Углекислый газ в атмосфере Земли
В атмосфере нашей планеты всего около 0,04% CO2 (это приблизительно 400 ppm), а совсем недавно было и того меньше: отметку в 400 ppm углекислый газ перешагнул только осенью 2016 года. Ученые связывают рост уровня CO2 в атмосфере с индустриализацией: в середине XVIII века, накануне промышленного переворота, он составлял всего около 270 ppm.
Несмотря на такое ничтожное процентное содержание диоксида углерода в атмосфере, он оказывает огромное влияние на климат планеты. Углекислый газ – один из парниковых газов. Он поглощает и удерживает инфракрасное излучение с поверхности Земли, что в конечном итоге способствует повышению температуры на планете. Этот процесс называется парниковым эффектом. Без парникового эффекта температура на земном шаре была бы примерно на 30°С ниже.
Атмосфера Венеры на 96,5% состоит из углекислого газа, и, по-видимому, тоже подвержена парниковому эффекту. Из-за него Венера является самой жаркой планетой Солнечной системы, она горячее даже ближайшего к Солнцу Меркурия. Температура на Венере около 464°С – этого хватит, чтобы расплавить свинец и олово.
Рост уровня СО2 в атмосфере Земли ведет к усилению парникового эффекта, а тот, в свою очередь – к необратимым изменениям климата. Уже сейчас можно наблюдать таяние ледников. Например, знаменитая снежная шапка Килиманджаро уменьшилась за последние 100 лет на 80%.
Что и говорить, без углекислого газа наш мир был бы совершенно другим. Он участвует в важнейших химических, биологических, климатических и геологических процессах на Земле. И чем больше мы о них знаем, тем проще нам принимать важные решения: выбирать образ жизни и создавать свою среду – свой здоровый и комфортный микроклимат.
Summary
Article Name
Что такое CO2
Description
Углекислый газ. Мы собрали для Вас самую интересную информацию об одном из самых важных химических соединений на Земле.
Author
Марина Гесс
Publisher Name
Tion.ru
Publisher Logo
Подпишись на наш Instagram и будь в курсе
самых интересных новостей и акций!
Источник
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
Источник
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
 Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
 Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Похожие статьи
- Сфера применения газовых ротаметров
- Какой газовый баллон выбрать?
- Гелий: применение в науке и промышленности
Источник
