Какими свойствами обладают белки ферменты
В каждой живой клетке происходит множество химических реакций. Ферменты (энзимы) – белки с особыми и крайне важными функциями. Их называют биокатализаторами. Основная функция белков-ферментов в организме заключается в ускорении биохимических реакций. Исходные реагенты, взаимодействие которых катализируется этими молекулами, именуются субстратами, а конечные соединения – продуктами.
В природе белки-ферменты работают только в живых системах. Но в современной биотехнологии, клинической диагностике, фармацевтике и медицине применяются очищенные энзимы или их комплексы, а также дополнительные компоненты, необходимые для работы системы и визуализации данных для исследователя.
Биологическое значение и свойства ферментов
Без этих молекул живой организм не смог бы функционировать. Все процессы жизнедеятельности слажено работают благодаря энзимам. Главная функция белков-ферментов в организме – регулирование обмена веществ. Без них невозможен нормальный метаболизм. Регуляция активности молекул происходит под действием активаторов (индукторов) или ингибиторов. Контроль действует на разных уровнях синтеза белков. Он также «работает» в отношении уже готовой молекулы.
Основное свойства белков-ферментов – специфичность к определенному субстрату. И, соответственно, способность катализировать только одну или реже ряд реакций. Обычно подобные процессы обратимы. За выполнение обоих функций ответственен один фермент. Но это еще не все.
Роль белков-ферментов существенна. Без них не протекают биохимические реакции. За счет действия ферментов появляется возможность реагентам преодолеть активационный барьер без существенных затрат энергии. В организме нет возможности нагреть температуру более 100 °С или использовать агрессивные компоненты наподобие химической лаборатории. Белок-фермент соединяется с субстратом. В связанном состоянии происходит модификация с последующим освобождением последнего. Именно так действуют все катализаторы, применяемые в химическом синтезе.
Какие уровни организации молекулы белка-фермента?
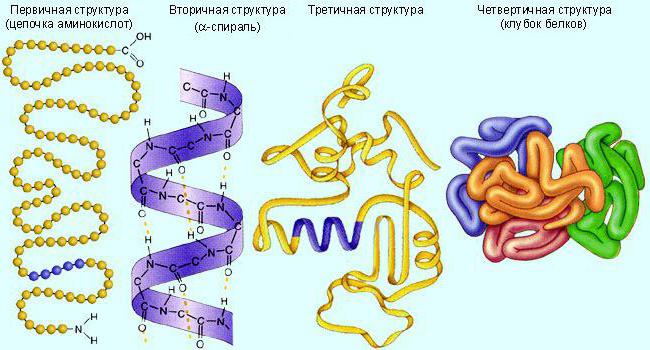
Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение.

Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Дополнительные свойства ферментов
Среди них выделяют следующие особенности компонентов:
- Стереоспецифичность – образование только одного продукта.
- Региоселективность – разрыв химической связи или модификация группы только в одном положении.
- Хемоселективность – катализ только одной реакции.
Особенности работы
Уровень специфичности ферментов варьируется. Но любой энзим всегда активен в отношении конкретного субстрата или группы соединений, аналогичных по структуре. Небелковые катализаторы не обладают таким свойством. Специфичность измеряется константой связывания (моль/л), которая может достигать 10−10 моль/л. Работа активного фермента стремительна. Одна молекула катализирует тысячи-миллионы операций в секунду. Степень ускорения биохимических реакций существенно (в 1000-100000 раз) выше, чем у обычных катализаторов.
Действие ферментов построено на нескольких механизмах. Наиболее простое взаимодействие происходит с одной молекулой субстрата с последующим образованием продукта. Большинство энзимов способны связывать 2-3 разные молекулы, вступающие в реакцию. Например, перенос группы или атома от одного соединения к другому или двойное замещение по принципу «пинг-понг». В данных реакциях обычно соединяется один субстрат, а второй связывается посредством функциональной группы с ферментом.
Изучение механизма действия фермента происходит с помощью методов:
- Определения промежуточных и конечных продуктов.
- Изучения геометрии структуры и функциональных групп, связываемых с субстратом и обеспечивающих высокую скорость реакции.
- Мутации генов фермента и определения изменения в его синтезе и активности.
Активный и связывающий центр
Молекула субстрата значительно меньше по размеру, чем белок-фермент. Поэтому связывание происходит за счет небольшого числа функциональных групп биокатализатора. Они формируют активный центр, состоящий из определенного набора аминокислот. В сложных белках в структуре присутствует простетическая группа небелковой природы, которая также может входить в состав активного центра.
Следует выделить отдельную группу энзимов. У них в состав молекулы входит кофермент, постоянно связывающийся с молекулой и освобождающийся от нее. Полностью сформированный белок-фермент называется холоферментом, а при удалении кофактора – апоферментом. В качестве коферментов часто выступают витамины, металлы, производные азотистых оснований (НАД – никотинамидадениндинуклеотид, ФАД – флавинадениндинуклеотид, ФМН – флавинмононуклеотид).
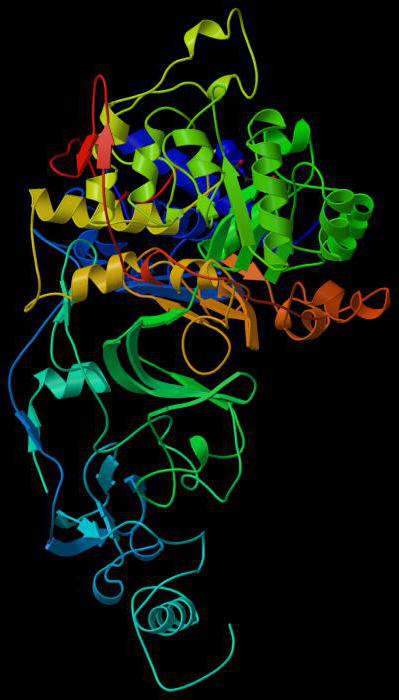
Связывающий центр обеспечивает специфичность сродства к субстрату. За счет него формируется устойчивый субстратно-ферментный комплекс. Структура глобулы построена так, чтобы иметь на поверхности нишу (щель или впадину) определенного размера, обеспечивающего связывание субстрата. Располагается эта зона обычно недалеко от активного центра. У отдельных ферментов есть участки для соединения с кофакторами или ионами металлов.
Заключение
Белок-фермент играет важную роль в организме. Подобные вещества катализируют химические реакции, отвечают за процесс обмена веществ – метаболизм. В любой живой клетке постоянно происходит сотни биохимических процессов, включающих восстановительные реакции, расщепление и синтез соединений. Постоянно происходит окисление веществ с большим выделением энергии. Она в свою очередь тратится на формирование углеводов, белков, жиров и их комплексов. Продукты расщепления являются структурными элементами для синтеза необходимых органических соединений.
Источник
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.

Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
- Активаторы. Вследствие их воздействия активность повышается. При ассоциации с ДНК эти вещества усиливают транскрипцию определенного гена. Яркий пример – Gal8. Он активирует гены, которые ответственны за усвоение дрожжами галактозы.
- Ингибиторы. Они, как можно предположить, активность понижают, задерживая течение физико-химических и физиологических процессов. В качестве примера можно привести гидрохинон. Это ароматическое органическое соединение является ингибитором окисления бензальдегида.
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.

Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.
Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
- Способность путем высаливания осаждаться из растворов.
- Амфотерность.
- Электрофоретическая подвижность.
- Способность к кристаллизации.
- Высокая специфичность действия.
- Зависимость реакции от рН-среды, активаторов, ингибиторов и температуры.
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
А некоторые ферменты и при низкой температуре ее демонстрируют. Например, амилаза картофеля. При -4 °C она действует в разы более активно, чем при плюсовых показателях. Кстати, этим обусловлен сладковатый вкус слегка замерзшей картошки.

Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
По сути, каждый фермент – это своеобразная молекулярная машина. Благодаря определенному расположению аминокислот и пространственной структуре своих компонентов, он имеет способность узнавать «свой» субстрат среди остальных. Поэтому присоединение выполняется мгновенно, что и обуславливает скорость химических реакций.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Дело в том, что в белковых молекулах многих ферментов имеются участки, способные узнавать еще и конечный продукт – тот, который, так сказать, «сходит» с полиферментного биохимического конвейера.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
- Ферменты проявляют свое действие в крайне небольших концентрациях. Амилаза способна ускорить гидролиз крахмала, будучи разведенной в пропорциях 1:1000000.
- В ходе катализируемой белком реакции он сам не расходуется, покидая ее в неизменном виде (это уже упоминалось ранее).
- Ферменты не смещают химическое равновесие. Эти вещества могут ускорить как обратную, так и прямую реакцию. Направленность определит концентрация исходных субстратов, а также конечных продуктов.
- Ферменты не способны инициировать реакцию. Они только влияют на скорость химических превращений.
- Они уменьшают уровень энергии активации. Ферменты могут обеспечить течение реакции, обойдя так называемый энергетический барьер.
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
Источник
Пища человека состоит из многих ингредиентов. Они делятся на макроэлементы — белки, жиры и углеводы и микронутриенты — витамины, микроэлементы и т. д. Белок обеспечивает около 10-15%. дневной энергии. 1 грамм белка высвобождает 4 ккал.
Белок — это основной строительный блок тела. Белки расщепляются на аминокислоты, которые важны для регенерации мышц, костей, кожи, крови и других жизненно важных систем. Кроме того, они используются в синтезе нуклеиновых кислот, несущих генетическую информацию.
Функции белков
У взрослых белок составляет около 16% массы тела. Из них 43% содержатся в мышцах,15% – в коже, 16% в крови и др.
Функции белков в организме человека:
- Структурная. Примерно половина белков в организме играет «каркасную» роль, например, в коже и мышцах. Эти белки — коллаген, актин и миозин.
- Транспортная. Белки помогают транспортировать многие питательные вещества через кровь и другие жидкости организма, такие как гемоглобин, липопротеины.
- Гормональная. Гормоны — это аминокислотные цепи, из которых состоят пептиды, такие как инсулин.
- Ферментативная. Все ферменты — белки. Например, пищеварительный фермент амилаза и другие.
- Иммунная. Антитела — это белковые молекулы. Белки также участвуют в подавлении воспалительных реакций.
- Защитная. Белок альбумин выполняет защитную функцию, поддерживая необходимый pH крови.
Функции белков в организме человека
По питательной ценности белок делится на полезный и менее ценный. Значение зависит от набора аминокислот, которые лучше всего усваиваются человеческим организмом. Этот «набор» меняется в зависимости от физиологического развития человека.
Коллаген
Коллаген — это основной белок соединительной ткани у животных. Коллаген содержится в костях, хрящах, сухожилиях, зубах, коже, роговице, легких, печени, кровеносных сосудах и других органах и тканях. На его долю приходится около 25-30% белка млекопитающих.
У человека и позвоночных было идентифицировано двенадцать типов коллагена, состоящего из более чем 24 различных полипептидных α-спиралей. Комбинации этих спиралей определяют типы коллагена. Например, наиболее распространенный коллаген I типа (90% общей массы коллагена) состоит из 2 спиралей α-1 и 1 α-2.
Структура коллагена
Коллаген отличается от других белков организма своим уникальным аминокислотным составом: 33%. из всех аминокислот составляют Gly, 10% – про, 10% – гидрокси-Pro и 1% – гидрокси-Lys. Основная структурная единица коллагена — тропоколаген, состоит из трех левовращающихся α-спиралей, скрученных в одну правовращающуюся суперспираль. Такие суперспирали связываются поперечными ковалентными связями с образованием фибрилл.
Миозин
Миозин — это белок сокращения мышечных волокон. Его молекула состоит из α-спирали двух полипептидных цепей. Мол. масса около – 470000, что составляет 40-60% всех мышечных белков. Связавшись с актином, он образует актомиозин — основной белок в системе сокращения мышц. Он характеризуется активностью аденозинтрифосфатазы: она преобразует химическую энергию АТФ в механическую энергию сокращения мышц. В 1 см 3 мышцы содержится около 1 г миозина.
Молекула миозина
Инсулин
Это полипептидный гормон, секретируемый В-клетками поджелудочной железы. Инсулин регулирует уровень глюкозы в крови, увеличивая проницаемость клеток мышечной и жировой ткани для глюкозы.
Инсулин
Гликоген синтезируется из глюкозы в печени и мышцах, а инсулин подавляет синтез глюкозы из других веществ (молочной кислоты, аминокислот, глицерина) в печени. При нехватке инсулина (из-за недостаточной выработки рукой или нарушения транспорта глюкозы из крови в клетки) начинается заболевание, называемое диабетом (сахарный диабет).
Аминокислоты
Белки состоят из аминокислотной цепи. Аминокислоты связываются между собой с образованием пептидных цепей, более 10 аминокислот — полипептиды.
Общая формула аминокислот H 2 N – CHR – COOH. Строение отдельных аминокислот кардинально отличается. Согласно им выделяют три основные группы аминокислот:
- алифатические;
- ароматические;
- гетероциклические.
Алифатические кислоты делятся на моноаминомонокарбоновые и моноаминодикарбоновые кислоты. В молекуле трех аминокислот — цистеина, цистина и метионина содержится атом серы.
Строение аминокислот
Аминокислоты — бесцветные кристаллические вещества. За исключением глицина, все они имеют асимметричный атом углерода и оптически активны. Человеческий белок содержит 20 отдельных аминокислот. Некоторые из них незаменимы (существенны), другие — заменяемы, потому что их можно синтезировать.
Во время катаболизма всех аминокислот образуются шесть веществ, которые участвуют в общем катаболическом процессе. Эти вещества представляют собой пируват, ацетил-КоА, кетоглутарат, сукцинил-КоА, фумарат и оксалоацетат.
Аминокислоты, из которых промежуточные продукты цикла Кребса (α-кетоглутарат, сукцинил-КоА, фумарат) образуются во время катаболизма и впоследствии превращаются в конечный продукт оксалоацетат и могут использоваться для гликогенеза, называются гликогенными аминокислотами.
Некоторые аминокислоты превращаются в ацетоацетат или ацетил-CoA во время катаболизма и могут использоваться для синтеза ацетоновых материалов. Их называют кетогенными. Многие аминокислоты используются в синтезе веществ глюкозы и ацетона, потому что катаболизм производит два продукта, соответствующий метаболит цикла Кребса и ацетоацетат (Tyr, Phe, Trp) или ацетил-КоА (Ile). Такие аминокислоты называют смешанными или гликокетогенными.
Почти все природные аминокислоты (за исключением метионина) реагируют с α-кетоглутаровой кислотой. Эта катализируемая трансаминазой реакция дает глутаминовую кислоту и соответствующую α-кетоновую кислоту. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием каталитической глутаматдегидрогеназы.
Незаменимые аминокислоты
Некоторые аминокислоты могут вырабатываться в организме, другие необходимо получать с пищей. Есть восемь незаменимых аминокислот.
Продукты, содержащие незаменимые аминокислоты
Важность некоторых аминокислот зависит от стадии физиологического развития человека. Например, в детстве очень важна одна аминокислота, а для взрослых она уже не важна. Пример: аргинин, гистидин, цистеин, глицин, тирозин, глутамин, пролин. Эти аминокислоты очень важны для детей, потому что детский организм не может их синтезировать из-за повышенной потребности. Во время метаболического стресса синтез глутамина может быть недостаточным, что делает его в таких случаях незаменимым.
Тирозин
Тирозин — ароматическая аминокислота, одна из двадцати аминокислот, необходимых для синтеза белка. Он образован из фенилаланина и других аминокислот. Тирозин участвует в синтезе адреналина, норадреналина, серотонина и дофамина.
Для правильного метаболизма тирозина в мозге необходимы витамин B 6 (пиридоксин) и фолиевая кислота. Тирозин используется для синтеза белков, катехоламинов, гормонов щитовидной железы, меланинов и может расщепляться на конечные метаболиты CO 2, H 2 O, NH + и энергию.
Между тирозином и α-кетоновой кислотой происходит реакция пераминирования, в результате чего п-гидроксифенилпируват вступает в реакцию с O 2.образуется гомогентизат. Ароматическое кольцо гомогентизата далее разрушается молекулярным кислородом с образованием малеилацетата. Он изомеризуется в фумарилацетоацетат, который гидролизуется до фумарата и ацетоацетата.
- Тирозин обладает улучшающими настроение и антидепрессивными свойствами.
- Он действует как адаптоген — улучшает адаптацию организма при стрессовых реакциях, снижает негативные последствия стресса, подавляет аппетит.
- Тирозин участвует в синтезе энкефалинов, обезболивающих.
- Используется в качестве нейротрансмиттера для стимуляции синтеза L-допа при болезни Паркинсона.
- Тирозин используется в сочетании с триптофаном и имипрамином в качестве антидепрессанта. Эти аминокислоты содержатся в соевых продуктах, курице, индейке, рыбе, бананах, молоке, сыре, семенах кунжута, овсянке.
Недостаток тирозина снижает синтез белка, отмечается повышенная утомляемость, признаки депрессии, нарушение функции печени, снижение активности щитовидной железы. Очень серьезный дефицит тирозина может возникнуть при генетическом заболевании — фенилкетонурии, при котором организм не может метаболизировать аминокислоту фенилаланин, поэтому ее необходимо исключить из рациона. В отсутствие фенилаланина тирозин не может образовываться.
Недостаток тирозина снижает активность щитовидной железы
Биологическая ценность белков
Биологическую ценность белков определяют аминокислоты. Белки со всеми незаменимыми аминокислотами в достаточном количестве, имеют высокую биологическую ценность. Белки с высокой биологической ценностью содержатся в источниках животного происхождения: мясе, яйцах, молочных продуктах, рыбе.
Если в белке нет одной или нескольких незаменимых аминокислот, его биологическая ценность низкая. Как правило, белки растительного происхождения имеют низкую биологическую ценность. Если питательная ценность ежедневного рациона слишком низкая, для выработки энергии используются белки организма.
Дефицит белка часто встречается у пациентов, перенесших операцию, и у пожилых людей. Дефицит белка возникает при заболеваниях почек, серьезных травмах, ожогах, сепсисе, мальабсорбции. Дефицит белка вызывает потерю мышечной массы, плохое заживление ран, восприимчивость к инфекциям, отек и ожирение печени.
Поделиться ссылкой:
Источник
