Какими свойствами обладают ферменты как белки
В каждой живой клетке происходит множество химических реакций. Ферменты (энзимы) – белки с особыми и крайне важными функциями. Их называют биокатализаторами. Основная функция белков-ферментов в организме заключается в ускорении биохимических реакций. Исходные реагенты, взаимодействие которых катализируется этими молекулами, именуются субстратами, а конечные соединения – продуктами.
В природе белки-ферменты работают только в живых системах. Но в современной биотехнологии, клинической диагностике, фармацевтике и медицине применяются очищенные энзимы или их комплексы, а также дополнительные компоненты, необходимые для работы системы и визуализации данных для исследователя.
Биологическое значение и свойства ферментов
Без этих молекул живой организм не смог бы функционировать. Все процессы жизнедеятельности слажено работают благодаря энзимам. Главная функция белков-ферментов в организме – регулирование обмена веществ. Без них невозможен нормальный метаболизм. Регуляция активности молекул происходит под действием активаторов (индукторов) или ингибиторов. Контроль действует на разных уровнях синтеза белков. Он также «работает» в отношении уже готовой молекулы.
Основное свойства белков-ферментов – специфичность к определенному субстрату. И, соответственно, способность катализировать только одну или реже ряд реакций. Обычно подобные процессы обратимы. За выполнение обоих функций ответственен один фермент. Но это еще не все.
Роль белков-ферментов существенна. Без них не протекают биохимические реакции. За счет действия ферментов появляется возможность реагентам преодолеть активационный барьер без существенных затрат энергии. В организме нет возможности нагреть температуру более 100 °С или использовать агрессивные компоненты наподобие химической лаборатории. Белок-фермент соединяется с субстратом. В связанном состоянии происходит модификация с последующим освобождением последнего. Именно так действуют все катализаторы, применяемые в химическом синтезе.
Какие уровни организации молекулы белка-фермента?
Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение.
Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Дополнительные свойства ферментов
Среди них выделяют следующие особенности компонентов:
- Стереоспецифичность – образование только одного продукта.
- Региоселективность – разрыв химической связи или модификация группы только в одном положении.
- Хемоселективность – катализ только одной реакции.
Особенности работы
Уровень специфичности ферментов варьируется. Но любой энзим всегда активен в отношении конкретного субстрата или группы соединений, аналогичных по структуре. Небелковые катализаторы не обладают таким свойством. Специфичность измеряется константой связывания (моль/л), которая может достигать 10−10 моль/л. Работа активного фермента стремительна. Одна молекула катализирует тысячи-миллионы операций в секунду. Степень ускорения биохимических реакций существенно (в 1000-100000 раз) выше, чем у обычных катализаторов.
Действие ферментов построено на нескольких механизмах. Наиболее простое взаимодействие происходит с одной молекулой субстрата с последующим образованием продукта. Большинство энзимов способны связывать 2-3 разные молекулы, вступающие в реакцию. Например, перенос группы или атома от одного соединения к другому или двойное замещение по принципу «пинг-понг». В данных реакциях обычно соединяется один субстрат, а второй связывается посредством функциональной группы с ферментом.
Изучение механизма действия фермента происходит с помощью методов:
- Определения промежуточных и конечных продуктов.
- Изучения геометрии структуры и функциональных групп, связываемых с субстратом и обеспечивающих высокую скорость реакции.
- Мутации генов фермента и определения изменения в его синтезе и активности.
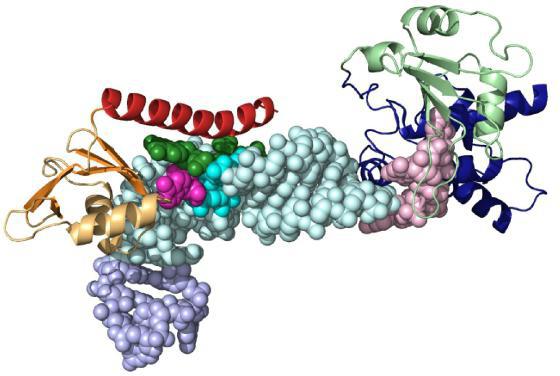
Активный и связывающий центр
Молекула субстрата значительно меньше по размеру, чем белок-фермент. Поэтому связывание происходит за счет небольшого числа функциональных групп биокатализатора. Они формируют активный центр, состоящий из определенного набора аминокислот. В сложных белках в структуре присутствует простетическая группа небелковой природы, которая также может входить в состав активного центра.
Следует выделить отдельную группу энзимов. У них в состав молекулы входит кофермент, постоянно связывающийся с молекулой и освобождающийся от нее. Полностью сформированный белок-фермент называется холоферментом, а при удалении кофактора – апоферментом. В качестве коферментов часто выступают витамины, металлы, производные азотистых оснований (НАД – никотинамидадениндинуклеотид, ФАД – флавинадениндинуклеотид, ФМН – флавинмононуклеотид).
Связывающий центр обеспечивает специфичность сродства к субстрату. За счет него формируется устойчивый субстратно-ферментный комплекс. Структура глобулы построена так, чтобы иметь на поверхности нишу (щель или впадину) определенного размера, обеспечивающего связывание субстрата. Располагается эта зона обычно недалеко от активного центра. У отдельных ферментов есть участки для соединения с кофакторами или ионами металлов.
Заключение
Белок-фермент играет важную роль в организме. Подобные вещества катализируют химические реакции, отвечают за процесс обмена веществ – метаболизм. В любой живой клетке постоянно происходит сотни биохимических процессов, включающих восстановительные реакции, расщепление и синтез соединений. Постоянно происходит окисление веществ с большим выделением энергии. Она в свою очередь тратится на формирование углеводов, белков, жиров и их комплексов. Продукты расщепления являются структурными элементами для синтеза необходимых органических соединений.
Источник
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.

Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
- Активаторы. Вследствие их воздействия активность повышается. При ассоциации с ДНК эти вещества усиливают транскрипцию определенного гена. Яркий пример – Gal8. Он активирует гены, которые ответственны за усвоение дрожжами галактозы.
- Ингибиторы. Они, как можно предположить, активность понижают, задерживая течение физико-химических и физиологических процессов. В качестве примера можно привести гидрохинон. Это ароматическое органическое соединение является ингибитором окисления бензальдегида.
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.

Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.

Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
- Способность путем высаливания осаждаться из растворов.
- Амфотерность.
- Электрофоретическая подвижность.
- Способность к кристаллизации.
- Высокая специфичность действия.
- Зависимость реакции от рН-среды, активаторов, ингибиторов и температуры.
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
А некоторые ферменты и при низкой температуре ее демонстрируют. Например, амилаза картофеля. При -4 °C она действует в разы более активно, чем при плюсовых показателях. Кстати, этим обусловлен сладковатый вкус слегка замерзшей картошки.

Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
По сути, каждый фермент – это своеобразная молекулярная машина. Благодаря определенному расположению аминокислот и пространственной структуре своих компонентов, он имеет способность узнавать «свой» субстрат среди остальных. Поэтому присоединение выполняется мгновенно, что и обуславливает скорость химических реакций.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Дело в том, что в белковых молекулах многих ферментов имеются участки, способные узнавать еще и конечный продукт – тот, который, так сказать, «сходит» с полиферментного биохимического конвейера.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
- Ферменты проявляют свое действие в крайне небольших концентрациях. Амилаза способна ускорить гидролиз крахмала, будучи разведенной в пропорциях 1:1000000.
- В ходе катализируемой белком реакции он сам не расходуется, покидая ее в неизменном виде (это уже упоминалось ранее).
- Ферменты не смещают химическое равновесие. Эти вещества могут ускорить как обратную, так и прямую реакцию. Направленность определит концентрация исходных субстратов, а также конечных продуктов.
- Ферменты не способны инициировать реакцию. Они только влияют на скорость химических превращений.
- Они уменьшают уровень энергии активации. Ферменты могут обеспечить течение реакции, обойдя так называемый энергетический барьер.
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
Источник
Тип урока: урок изучения нового материала с элементами практикума.
Форма урока: комбинированный.
Учебно-воспитательные задачи урока:
- Образовательные:
– сформировать у учащихся знания о разнообразных функциях белка
(многофункциональность), роли белков в формировании признаков организма, о
ферментах, их специфичности и механизме действия, ферментативном характере
всех реакций в клетке;
– развитие навыка систематизации понятий;
– развитие навыков системного мышления при анализе строения и функций
ферментов;
– познакомить учащихся с приемами мнемотехники при запоминании большого
количества терминов;
– развитие навыка учащихся по планированию работы и организации рабочего
места;
– развитие практических умений и навыков при выполнении лабораторной
работы.
– показать необходимость знаний о роли ферментах для здоровья человека и
в практике физической культуры и спорта.
Оборудование:
Демонстрационное оборудование: Таблица № 12 с изображением разных
уровней организации белковых молекул, отрезок гибкого провода длиной 1 м.,
металлический стержень длиной 30 см., таблица № 15 с изображением фермента
рибонуклеазы, магнитные модели строения ферментов, лекарственные препараты
содержащие различные ферменты (мизим, панзинор).
Лабораторное оборудование: (на каждый стол)
Штатив с пятью пробирками с натуральными объектами (вареный и сырой
картофель, вареное и сырое мясо), склянки с 3% раствором пероксида водорода,
песок, ступка и пестик. Инструкция по выполнению лабораторной работы.
Межпредметные связи.
Внутрипредметные связи – Ферменты. (Пищеварение, 9 класс)
Межпредметные связи – Химия, 10 класс. Белки. Нуклеиновые кислоты.
Ферменты. Химия, 9 класс. Скорость химических реакций.
Эпиграф урока:
“Проблема природы жизни – это проблема первичной организации материи в
живых объектах.”
Акад. В.А.Энгельгардт
Ход урока
1. Организационный момент.
Вступительное слово учителя.
Сегодня на уроке мы продолжим знакомство с разнообразными функциями белков в
живых организмах. Рассмотрим как изменяются свойства белков в связи с изменением
их структуры. Решение данных вопросов будем решать теоретически (на лекции), так
и практически (на лабораторной работе).
2. Повторение ранее изученного материала.
Устный опрос.
- Какие органические вещества входят в состав клетки?
- Из каких простых органических соединений состоят белки?
- Что такое пептиды?
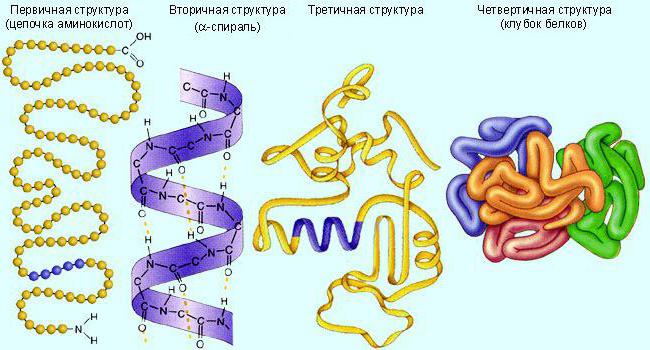
- Какова первичная структура белка? Каков характер связей в ней?
- Как образуется вторичная, третичная и четвертичная структура белка?
Каков характер связей в них? - Какие функции белков вам известны?
(При ответах учащиеся пользуются динамическим моделированием структур
белка при помощи гибкого шнура).
- Доказательно объясните первостепенное значение белков в клетках живых
организмов, занимающих в живой природе первое место как по количеству, так и
по значению. - Работа с терминами.
Дать определение опорным понятиям:
Биополимеры –
Белки –
Аминокислоты –
Водородные связи –
Структуры белка –
Денатурация белка –
Ренатурация белка –
Катализ –
По итогам устного опроса оцениваются знания учащихся.
Слово учителя:
Мы познакомились с различными белками, разобрали их строение, структуры,
свойства, функциональное значение для живых организмов. А как вы думаете,
изменится ли функция белка при нарушении его структуры?
Учащиеся совместно с учителем высказывают предположения, находят правильный
ответ (Белки утратят свои функции при нарушении его структуры).
На примере белков-ферментов мы сегодня рассмотрим как меняются свойства
белковых молекул с изменением их структуры. Решение этого вопроса будем
осуществлять при изучении нового материала с помощью практических опытов и
наблюдений.
3. Изучение нового материала в форме лекции. (На доске записан план
лекции, новые понятия и термины урока. Во время изложения учителем лекции
учащиеся в тетрадях записывают краткий конспект нового материала.)
Новые понятия и термины урока:
Фермент
Активный центр фермента
Апофермент
Кофермент
Специфичность ферментов
Условия работы ферментов
Лекция № 4.
Тема: “Ферменты”
План:
- Строение ферментов.
- Классификация ферментов.
- Свойства ферментов и их функции.
- Факторы, влияющие на активность ферментов.
- Механизм действия ферментов.
- Значение ферментов.
Ферменты – это высокоспециализированные белки, которые ускоряют
химические реакции в клетке, т.е. являются биологическими катализаторами.
Строение ферментов.
- Простые (однокомпонентные, состоят из белка: амилаза, пепсин, трипсин)
- Сложные (двухкомпонентные, состоят из белковой части (апофермент)
и небелковой части (кофермент – витамины или минеральные вещества).
Каталитическую активность сложные ферменты проявляют только в присутствии
коферментов. Каталитическую активность проявляет не вся молекула фермента, а
только его незначительная часть называемая активным центром.
Классификация ферментов.
| Классы ферментов | Катализируемая реакция | Примеры ферментов |
| 1. Оксидоредуктазы | Перенос атомов водорода или электронов от одного вещества к другому. | Дегидрогеназа, оксидаза. |
| 2. Трансферазы | Перенос определенной группы атомов (метильной, ацильной, фосфатной или аминогруппы) от одного вещества к другому. | Трансаминаза, киназа. |
| 3. Гидролазы | Реакции гидролиза. | Липаза, амилаза, протеаза. |
| 4. Лиазы | Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, С-N, C-O, С-S. | Декарбоксилаза, фумараза, альдолаза. |
| 5. Изомеразы | Внутримолекулярная перестройка | Изомераза, мутаза. |
| 6. Лигазы | Соединение двух молекул в результате образования новых связей С-С, С-N, C-O, С-S, сопряженное с распадом АТФ. | Синтеаза. |
Название фермента образуется от названия катализируемого вещества с
добавлением окончания “аза” (фермент ускоряющий распад белков – протеаза, жиров
– липаза, углеводов – амилаза).
Свойства ферментов.
1. Высокая каталитическая активность (углекислый газ из крови
связывается с гемоглобином в карбогемоглобин со скоростью 10 молекул в секунду,
а при ферменте карбоангидраза в 10 раз больше).
2. Специфичность (избирательность) действия (один
фермент катализирует одну реакцию).
3. Регулируемость активности ферментов (внутренняя среда
организма из-за действия ферментов всегда постоянна).
Факторы влияющие на активность ферментов.
1. Концентрация фермента и субстрата (чем выше концентрация
исходных веществ, тем выше скорость реакции).
2. Активная реакция среды (рН) (большинство ферментов проявляют
максимальную активность при значении рН=7 (нейтральная). Некоторые активны
только в кислой среде (пепсин рН=2), некоторые только в щелочной (липаза рН=9).
При физических нагрузках в мышцах накапливается молочная кислота, способная
закислять среду и снижать активность многих ферментов).
3. Температура (Различные клеточные ферменты работают в своем
диапазоне температур, где они проявляют наибольшую активность (средние
температуры 37-40 С) При низких температурах активность ферментов замедляется,
при высоких фермент(белок) разрушается (денатурация белка). При замораживании
фермент сохраняет свою структуру и затем при размораживании восстанавливает свои
свойства).
4. Активаторы и ингибиторы (ионы металлов, низкомолекулярные вещества)
активаторы повышают активность фермента (АТФ-аза миозина мышц
активируется ионами Са ), ингибиторы снижают активность фермента, т.к.
занимают место субстрата (конкурентные ингибиторы), или соединяются с неактивной
частью и тем самым меняют химическую природу фермента (катализ нарушается)
(неконкурентные ингибиторы – ионы тяжелых металлов – свинец, медь, ртуть, мышьяк
и многие яды).
Механизм действия ферментов.
Взаимодействие субстрата и фермента происходит в несколько стадий:
- взаимодействие субстрата (S) с активным центром фермента (Ф) и
образование фермент-субстратного комплекса, - преобразование в фермент-субстратном комплексе с образованием нового
продукта, - отделение продукта реакции от активного центра фермента (сам фермент в
ходе реакции не изменяется и вступает в другие реакции вновь).
А + В = АВ (скорость медленная)
субстрат новый продукт
А + Ф = АФ + В = АВ + Ф (скорость быстрая)
Модель взаимодействия фермента с субстратом.
1. Модель Фишера “ключ к замку”. Субстрат и фермент комплиментарны
(точно подходят друг к другу, как ключ к замку).
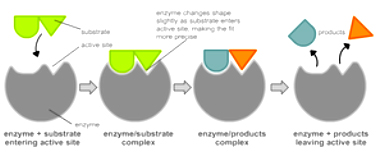
2. Модель Кошланда “перчатка-рука”. Субстрат и активный центр фермента
становятся соответствующими друг другу (как перчатка, одетая на руку) только
после того, как соединятся.
Значение знаний о ферментах.
| В медицине | В промышленности | В спорте |
| 1. Многие заболевания в организме связаны с изменением активности ферментов или процессом их синтеза (ферментопатия): – замедленное физическое развитие, – нарушение обмена веществ, – психическая неполноценность. | При изготовлении сыра, хлебопечении, пивоварения. При изготовлении антибиотиков, витаминов, … | 1. При мышечной деятельности может изменяться активность и биосинтез многих ферментов, что приводит к усилению или замедлению скорости метаболизма и процессов энергообразования. 2. От активности фермента зависит физическая работоспособность, скорость восстановления, адаптация к физическим нагрузкам. 3. Действие многих витаминов и других биологически активных веществ, которые применяются в практике спорта для восстановления организма и регуляции массы тела, связано с ферментами. |
4. Обобщение и закрепление знаний по новому материалу.
- Что такое ферменты?
- Какова роль ферментов в обмене веществ, диагностике функционального
состояния организма? - Как образуются названия ферментов?
- Как построены ферменты?
- Что такое кофермент и какова его роль? Какие знаете коферменты?
- Какова связь между ферментами и витаминами?
- Какую функцию выполняет активный центр фермента?
- Назовите основные свойства ферментов.
- В чем состоит специфичность действия ферментов?
- Раскройте механизм действия ферментов. Как фермент
- взаимодействует с субстратом?
- Как влияют отдельные факторы среды на активность фермента?
- Что такое активаторы и ингибиторы ферментов? Приведите примеры их
действия на отдельные ферменты. - Какие знаете классы ферментов?
- Как влияют физические нагрузки на активность т свойства ферментов?
5. Выполнение лабораторной работы № 3 по теме “Каталитическая
активность ферментов в живых тканях”.
Проведение работы по инструкции. (Приложение)
Учащиеся оформляют в лабораторных тетрадях отчет об итогах
лабораторной работы. Сдача лабораторных тетрадей на проверку.
6. Домашнее задание.
Общая биология: Учеб. Для 10–11 класс общеобразоват. О-28 / Д.К.Беляев,
П.М.Бородин, Н.Н.Воронцов и др. М.: Просвещение, 2005.
Источник
