Какими свойствами обладают химические соединения

Большинство людей не задумывается о составе окружающих их предметов, веществ, материи. Атомы, молекулы, электроны, протоны – эти понятия кажутся не только непонятными, но и далекими от действительности. Однако такое мнение ошибочно. Практически все, что нас окружает, состоит из химических связей. Химические соединения – это достаточно сложные формы веществ. В окружающем нас мире великое множество таких связей. Однако и соединения, состоящие только из одного элемента химического, могут относиться к ним, например, кислород или хлор. Поэтому стоит подробнее разобрать вопрос: “Химические соединения – это что?”

Сложный “химический” мир
Мало кто задумывается о том, что окружающий нас мир состоит из сложных структур, макромолекул и крошечных частиц. Удивительно, насколько разнородны даже размеры атомов у разных элементов. Различия в величинах атомных масс тоже впечатляют – бериллий со своими 9 а. е. м. – “легковес” по сравнению с “тяжеловесом” астатом: его атомный вес составляет 210 а. е. м. (а. е. м. – атомные единицы массы – единица измерения массы атомов, молекул, ядер, которая равна 1/12 массы атома углерода, находящегося в основном состоянии).
Многообразие элементов обуславливает и наличие множества химических соединений (это, простыми словами, комбинация соединенных между собой атомов различных и, в некоторых случаях, одинаковых частей). Большинство предметов, веществ представляют собой именно такого рода соединения. Необходимый для жизни кислород, поваренная соль, ацетон… Можно еще очень долго перечислять примеры и всем известные, и понятные только узким специалистам. Что же такое эти химические соединения?

Определение, отличие от смесей
Химические соединения – это сложные вещества, которые состоят из соединенных между собой атомов разных химических элементов, однако существуют исключения: к химическим соединениям относятся и простые вещества (то есть состоят из атомов одного элемента), если атомы этих веществ соединены ковалентной связью (она образована общими для обоих атомов электронами). К таким веществам относятся азот, кислород, большинство галогенов (в таблице Менделеева элементы седьмой группы главной подгруппы; фтор, хлор, бром, йод, предположительно и астат).
Зачастую путают между собой понятия “химическое соединение” и “смесь простых веществ”. Смесь веществ – это, как можно сделать вывод из названия, не самостоятельное вещество, а система двух и более компонентов. Сам состав этих двух единиц химических веществ является основным различием между ними. Как уже говорилось, соединение химических элементов и смесь простых (или сложных) веществ – это не одно и то же. Свойства, способы получения, методы разделения на компоненты также являются отличительными критериями смесей и соединений. Важно отметить, что ни получить, ни разделить химические соединения нельзя без проведения химических реакций, а смеси – можно.

Соединения веществ или элементов?
Очень многие люди также путают между собой словосочетания “соединение химических веществ” и “соединение элементов”. По непонятным причинам, но, скорее всего, в силу своей некомпетентности, большинство из них не видит разницы между первым и вторым научными понятиями. Стоит узнать и понимать, что не существует такой терминологии, как “соединение химических веществ”. Не стоит повторять за другими ошибки этимологии тех или иных не только выражений, но и слов.

Как определить свойства соединений
Зачастую свойства химических соединений разительно отличаются от свойств элементов, из которых они состоят. Например, молекула этилового спирта состоит из двух атомов углерода, шести атомов водорода и одного атома кислорода, однако его свойства разительно отличаются от свойств всех элементов своего состава. В связи с тем, что существуют разные классы соединений, то и свойства у каждого из них свои. Большинство реакций, безусловно, являются характерными для многих соединений, однако механизмы их проявления разные.

На какие классы делятся химические соединения
В зависимости от своей природы, существуют такие классы химических соединений, как органические и неорганические. Стоит сказать, что органическими называют вещества (соединения), в составе которых присутствует углерод (исключения составляют некоторые соединения, содержащие углерод, но относящиеся к неорганическим, ниже они приводятся). Основными группами органических соединений являются углеводороды, спирты, альдегиды, кетоны, эфиры, карбоновые кислоты, амиды и амины. Неорганические вещества (соединения) в своем составе не содержат атомов углерода, однако среди них можно выделить карбиды, цианиды, карбонаты и оксиды углерода, так как они, наравне с органическими соединениями, в своем составе содержат его атомы. И те, и другие соединения имеют свои особенности, свои свойства, причем разные группы соединений одного класса могут иметь разные характеристики.
Неорганические соединения: основные свойства
Все неорганические соединения можно разбить на несколько групп. У каждого из данных видов соединений есть общие свойства, зачастую не совпадающие с другими группами этого же класса. Итак, ответ на вопросы, какие химические соединения относятся к неорганическими, какие группы образуют и какими свойствами обладают, можно представить следующим образом:
- Первая группа – простые неорганические соединения неметаллической природы. Данную категорию соединений объединяют такие свойства, как возможность находиться в газообразном состоянии. Твердые соединения неметаллического характера обладают немолекулярным строением, в связи с чем способны к образованию кристаллов.
- Вторая группа – сложные неорганические соединения. Их можно разделить на четыре подгруппы.

Сложные неорганические соединения, их свойства
Как было сказано ранее, вторую группу неорганических соединений можно разделить на четыре подгруппы:
- Оксиды. Для этой подгруппы неорганических соединений характерны реакции взаимодействия с водой, кислотами и кислотными оксидами (у них есть соответствующая кислородсодержащая кислота).
- Кислоты. Эти соединения взаимодействуют с водой, щелочами и основными оксидами (у них есть соответствующее основание).
- Амфотерные соединения – соединения, которые могут вести себя и как кислоты, и как основания (обладают и теми, и теми свойствами). Такие соединения реагируют и с кислотными оксидами, и с основаниями.
- Гидроксиды. Эти вещества неограниченно растворяются в воде, изменяют окраску при воздействии на них щелочами.
Соединения органической природы
Большинство предметов, с которыми человек ежедневно сталкивается, изготовлены из органических соединений. Органические химические соединения представляют собой обширный класс связей, составы и свойства групп, при взаимодействии которых они отличаются завидной разнообразностью. Стоит подробнее рассмотреть группы этих соединений.

Группы органических соединений и их некоторые свойства
- Углеводороды. Они представляют собой соединения только атомов водорода и углерода. Можно выделить предельные и непредельные, линейные (ациклические) и карбоциклические, ароматические и не ароматические; алканы, алкены, алкины, диены, нафтены. Для всех перечисленных углеводородов является общим свойством их не смешиваемость с водой. Для предельных типичны реакции замещения, а для непредельных – присоединения.
- Спирты – соединения, содержащие в своем составе гидроксильную (-ОН) группу (конечно, органические соединения). Они обладают свойствами слабых кислот, для них характерны реакции нуклеофильного замещения и реакции окисления, а также спирты сами могут выступать в качестве нуклеофила.
- Простые и сложные эфиры. Простые эфиры малорастворимы в воде, обладают слабоосновными свойствами. Сложные эфиры выступают в качестве носителей электрофильных реагентов, вступают в реакции замещения.
- Альдегиды (содержат альдегидную -СНО группу). Они вступают в такие реакции, как присоединение, окисление, восстановление, сопряженного присоединения.
- Кетоны. Для них характерны гидрирование, конденсация, нуклеофильное замещение.
- Карбоновые кислоты. Они проявляют, конечно же, кислотные свойства. Восстановление, галогенирование, реакции нуклеофильного замещения у ацильного атома углерода, получение амидов и нитрилов, декарбоксилирование – основные характерные реакции.
- Амиды. Гидролизация, разложение, кислотность и основность – основные свойственные реакции для амидов.
- Амины. Являются основаниями; взаимодействуют с водой, с кислотами, с ангидридами, галогенами и галогеналканами.
Источник
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
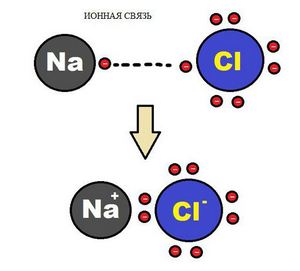
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
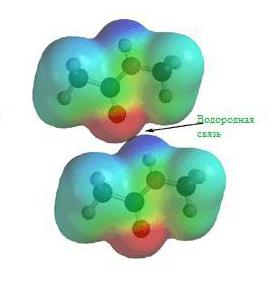
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
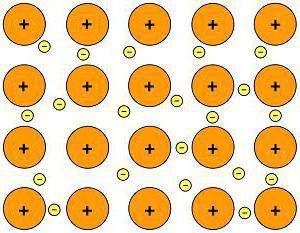
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.
Источник
Химические соединения
Химическое соединение – это вещество, состоящее из двух или нескольких типов атомов или ионов, соединенных в молекулу; поэтому его можно
разложить на два или несколько более простых веществ. Различные химические элементы в данном соединении всегда находятся в определенном весовом соотношении между
собой. Это обусловлено тем, что атомы соединены друг с другом химическими связями совершенно определенным образом.
Группу атомов, соединенных химическими связями, называют молекулой. Молекула – это наименьшая частица вещества, сохраняющая те же химические свойства и состав,
что и большее количество данного соединения. Молекула состоит не менее чем из двух атомов, которые могут быть одинаковыми (как, например, в молекуле кислорода или
азота) или различными. Если молекула данного вещества состоит из двух или большего числа разных атомов, то мы имеем дело с химическим соединением.
Обычно свойства химического соединения совершенно отличны от свойств составляющих его элементов. Каждая молекула воды содержит два атома водорода и один атом
кислорода, а вода по своим химическим свойствам совсем не похожа ни на водород, ни на кислород. Состав воды отражен в ее химической формуле – Н20. Таким
образом, химическая формула кратко фиксирует, какие типы атомов и в каком относительном количестве входят в состав молекулы.
Значительную часть вещества каждой клетки составляет вода. У человека содержание воды в различных тканях варьирует от 20% (в кости) до 85% (в ткани головного
мозга). Около двух третей общей массы организма человека составляет вода; в организме медузы вода составляет 95%. Вода выполняет в живых системах ряд важных функций.
В ней растворено большинство других веществ, для которых водная среда является необходимым условием для вступления в реакцию друг с другом.
Вода растворяет “отходы” метаболизма и помогает выведению их из клетки и из организма.
Вода обладает большой теплоемкостью, т. е. способностью поглощать тепло при минимальном изменении своей собственной температуры. Это обусловлено тем, что
расположенные рядом молекулы воды, находящейся в жидком или в твердом состоянии (лед), удерживаются вместе водородными связями (рис. 1) и определенное количество
тепла расходуется на разрыв этих связей. Таким образом, вода предохраняет клетку от резких изменений температуры.
Вода обладает способностью поглощать большое количество тепла при переходе из жидкого состояния в газообразное, что позволяет организму освобождаться от избытка
тепла путем испарения воды. Например, футболист, весящий 100 кг, может потерять за час игры 2 кг воды, испаряющейся при потоотделении. Теплота испарения воды равна
574 ккал/кг, отсюда 574 X 2 = 1148 ккал. Если бы вода не испарялась и все образующееся во время игры тепло сохранялось в организме, температура тела футболиста
повысилась бы на 11,5 °С. Характерная для воды высокая теплопроводность создает возможность равномерного распределения тепла между тканями тела. Наконец, вода
служит смазочным материалом, необходимым везде, где один орган трется о поверхность другого, а также в суставах.
В отличие от чистых химических соединений (например, воды) механическая смесь состоит из двух или большего числа типов атомов или молекул, которые могут
сочетаться в самых различных пропорциях. Воду можно смешать со спиртом в любом соотношении, а воздух представляет собой смесь варьирующих количеств кислорода и
азота с небольшой примесью водяного пара, углекислого газа, аргона и других газов. Из этого следует, что каждое химическое соединение должно обладать вполне
определенными химическими и физическими свойствами, тогда как свойства смеси меняются в зависимости от относительных количеств ее компонентов.
Атомы, составляющие молекулы, соединены между собой химическими связями (рис. 2). В веществах биологического происхождения важную роль играют
- электростатические связи (или ионные)
[показать] - водородные связи
[показать] - ковалентные связи
[показать]
Из ковалентных связей большое значение имеют ангидридные связи, образующиеся при соединении двух молекул с одновременным выделением молекулы воды (при
этом от одной молекулы отщепляется гидроксильная, или ОН-группа, а от другой – атом водорода). В биосинтетических реакциях такая связь часто образуется не в
результате действительного отщепления молекулы воды, а путем замещения ОН-группы в одной молекуле фосфатной группой с последующим удалением этой фосфатной группы
и атома водорода от другой молекулы; при этом освобождается неорганический фосфат и образуется ангидридная связь.
Ангидридные связи углеводов, или гликозидные связи, образуются при отщеплении атома водорода от спиртовой группы одной молекулы сахара и гидроксила от альдегидной
группы другой молекулы (рис. 2). Ангидридные связи белков, или пептидные связи, образуются в результате отщепления ОН от карбоксильной группы (-СООН) одной
аминокислоты и водорода от аминогруппы (-NН2) другой аминокислоты. Ангидридные связи жиров, или эфирные связи, возникают при отщеплении группы ОН от
карбоксильной группы жирной кислоты и водорода от спиртовой группы глицерина.
Из других эфирных связей большое биологическое значение имеют фосфорноэфирные связи, образующиеся при отщеплении Н от фосфорной кислоты и ОН-группы от
сахара, а также тиоэфирные связи, при образовании которых ОН отщепляется от карбоксильной группы кислоты, а водород – от SН-группы. В нуклеотидах сахар соединен
с пурином или пиримидином гликозидной связью, а с фосфатом – фосфорноэфирной. Кофермент А образует с целым рядом веществ тиоэфиры; например, ацетилко-фермент А
представляет собой тиоэфир уксусной кислоты и кофермента А.
Кроме того еще выделяют два типа слабых связей – вандерваальсовы силы и гидрофобные связи, которые играют особенно важную роль в структуре белковых молекул.
Ясное представление о химических связях и их полярности позволяют более четко понимать свойства молекул в живых системах.
В химии принято называть соединения, содержащие углерод (за исключением карбонатов), органическими соединениями, а все остальные вещества – неорганическими.
Однако неорганические соединения тоже играют важную роль в физиологии живых организмов.
На внешней орбитали атома углерода находятся четыре электрона, которые могут быть различным образом поделены между этим и соседними атомами. Поэтому углерод
может образовывать больше различных соединений, чем любой другой элемент. Некогда полагали, что органические соединения – это вещества совсем особого рода, синтез
которых возможен только в живых организмах. Это представление было опровергнуто в 1828 году, когда Вёлер впервые синтезировал мочевину (один из органических продуктов
обмена, содержащийся в моче многих животных и человека) из неорганических соединений – сернокислого аммония и цианистого калия. Впоследствии были синтезированы
многие тысячи органических веществ, в том числе сложные соединения, имеющие большое биологическое значение, например некоторые витамины, гормоны, антибиотики и
лекарственные вещества.
Из неорганических соединений в живых организмах содержатся вода, углекислота, различные кислоты, основания и соли. Кислота – это соединение, при диссоциации
которого в воде освобождаются ионы водорода (Н+). Кислоты изменяют цвет синей лакмусовой бумаги на красный и имеют кислый вкус. Соляная (НСl) и серная
(Н2S04) кислоты относятся к неорганическим кислотам; молочная кислота (содержится в кислом молоке) и уксусная кислота (содержится в уксусе) –
две из наиболее обычных органических кислот. Основанием называется соединение, при диссоциации которого в воде освобождаются гидроксильные группы (ОН-).
Основания изменяют цвет красной лакмусовой бумаги на синий. К наиболее обычным неорганическим основаниям (щелочам) относятся гидрат окиси натрия, или едкий натр
NаОН), и гидрат окиси аммония, или гидроокись аммония (NН4ОН).
Для удобства степень кислотности или щелочности той или иной жидкости, т.е. концентрацию в ней ионов водорода, можно выражать величиной рН (логарифм концентрации
ионов водорода, взятый с обратным знаком). Протоплазма большинства животных и растительных клеток не дает ни сильнокислой, ни сильнощелочной реакции; она содержит
почти нейтральную смесь веществ кислого и основного характера. Концентрация в ней водородных ионов (как и в чистой воде) составляет около 10-7 М, а
величина рН равна, следовательно, 7,0. При рН 7,0 концентрации свободных ионов Н+ и ОН- равны друг другу. Сколько-нибудь значительное
изменение рН протоплазмы несовместимо с жизнью. Так как шкала рН является логарифмической, то в растворе, имеющем рН 6, концентрация ионов водорода в 10 раз выше,
чем в растворе с рН 7.
При смешивании кислоты и основания водородный ион кислоты соединяется с гидроксильным ионом основания и образуется молекула воды (Н20). Остаток кислоты
(анион) соединяется с остатком основания (катионом), образуя соль. Например, соляная кислота реагирует с гидратом окиси натрия с образованием воды и хлористого
натрия, т. е. обыкновенной поваренной соли: Н+С1- + Na+ОН –> Н2О + Nа+Сl-.
Соль можно определить как соединение, получающееся при замещении водородного атома кислоты каким-нибудь металлом.
При растворении солей, кислот или оснований в воде их молекулы разделяются на составляющие их ионы. Растворы, содержащие эти заряженные частицы, способны
проводить электрический ток; поэтому эти вещества называются электролитами. Сахара, спирты и многие другие вещества, которые при растворении не распадаются на
заряженные частицы и растворы которых поэтому не проводят электрического тока, называются неэлектролитами.
Клетки и внеклеточные жидкости содержат множество различных минеральных солей; при этом важнейшими катионами (положительно заряженными ионами) являются натрий,
калий, кальций и магний, а главными анионами (отрицательно заряженными ионами) – хлорид-, бикарбонат-, фосфат- и сульфат-ионы. Жидкости тела наземных животных по
общему содержанию солей значительно отличаются от морской воды, однако по составу солей и по их относительным концентрациям они в общем близки к ней (табл. 1).
Общая концентрация солей в жидкостях тела большинства морских животных равна концентрации их в морской воде (примерно 3,4%). У наземных, пресноводных и морских
позвоночных содержание солей в жидкостях тела составляет около 1%, а у наземных и пресноводных беспозвоночных – от 0,3 до 0,7%. Для нормального протекания жизненных
процессов необходимо наличие в организме определенных солей, причем их относительные концентрации не должны выходить за определенные границы.
| Таблица 1. Ионный состав морской воды и жидкостей тела различных животных (содержание натрия принято за 100) | |||||||
| Объект | Группа | Na | К | Са | Мg | Сl | SО4 |
| Морская вода | 100 | 2,74 | 2,79 | 13,94 | 136,8 | 7,10 | |
| Медуза | Кишечнополостные | 100 | 2,90 | 2,15 | 10,18 | 113,1 | 5,15 |
| Морской еж | Иглокожие | 100 | 2,30 | 2,28 | 11,21 | 116,1 | 5,71 |
| Phascolosoma | Сипункулиды | 100 | 10,07 | 2,78 | – | 114,1 | – |
| Uenus | Моллюски | 100 | 1,66 | 2,17 | 5,70 | 117,3 | 5,84 |
| Carcinus | Ракообразные | 100 | 2,32 | 2,51 | 3,70 | 105,2 | 3,90 |
| Водолюб | Насекомые | 100 | 11,10 | 0,92 | 16,8 | 33,6 | 0,12 |
| Морской черт | Рыбы | 100 | 2,85 | 1,01 | 1,61 | 71,9 | – |
| Лягушка | Земноводные | 100 | 2,40 | 1,92 | 1,15 | 71,4 | – |
| Человек | Млекопитающие | 100 | 3,99 | 1,78 | 0,66 | 84,0 | 1,73 |
Кровь человека и наземных позвоночных отличается от морской воды относительно большим содержанием калия и меньшим – магния и хлора. Жизнь, вероятно, возникла
в море, и клетки первых организмов были приспособлены к тем солям и тем их относительным концентрациям, которые были характерны для моря в то время (хотя концентрация
солей в первичном океане, вероятно, была ниже, чем в современном). В процессе эволюции жидкости тела животных стали в общем сходными по относительной концентрации
солей, так как всякое значительное отличие в солевом составе привело бы к подавлению тех или иных клеточных ферментов и поставило бы таких животных в невыгодные
условия в борьбе за существование.
У некоторых животных развились почки и другие органы выделения, позволяющие избирательно задерживать в организме или, наоборот, выводить из него те или иные ионы.
Поэтому жидкости тела в известной мере различаются по относительным концентрациям солей, поскольку концентрация ионов каждого типа определяется относительной
скоростью поглощения и выделения их из организма.
В нормальных условиях содержание различных солей чрезвычайно постоянно, и всякое значительное отклонение от нормы приводит к серьезным последствиям, а иногда и
к смерти. Понижение концентрации ионов кальция в крови у млекопитающих вызывает судороги и смерть. Сердечная мышца может нормально сокращаться только при наличии
соответствующего баланса ионов натрия, калия и кальция. Если изолировать сердце лягушки и поместить его в чистый раствор хлористого натрия, то оно вскоре перестанет
сокращаться, остановившись в расслабленном состоянии; если поместить его в раствор хлористого калия или в смешанный раствор хлоридов натрия и кальция, оно
остановится в состоянии сокращения. Если же поместить сердце в раствор этих трех солей взятых в надлежащем соотношении, оно будет продолжать сокращаться. Эта проба
с сердцем лягушки настолько чувствительна, что ее можно использовать для измерения концентрации ионов кальция в растворах.
Помимо этого специфического действия на определенные клеточные функции, минеральные соли играют важную роль в поддержании осмотических отношений между клеткой и
окружающей ее средой.
Виртуальные консультации
На нашем форуме вы можете задать вопросы о проблемах своего здоровья, получить
поддержку и бесплатную профессиональную рекомендацию специалиста, найти новых знакомых и
поговорить на волнующие вас темы. Это позволит вам сделать собственный выбор на основании
полученных фактов.
Обратите внимание! Диагностика и лечение виртуально не проводятся!
Обсуждаются только возможные пути сохранения вашего здоровья.
Подробнее см. Правила форума
Последние сообщения
Реальные консультации
Реальный консультативный прием ограничен.
Ранее обращавшиеся пациенты могут найти меня по известным им реквизитам.
Заметки на полях
Нажми на картинку –
узнай подробности!
Новости сайта
Ссылки на внешние страницы
20.05.12
Уважаемые пользователи!
Просьба сообщать о неработающих ссылках на внешние страницы, включая ссылки, не выводящие прямо на нужный материал,
запрашивающие оплату, требующие личные данные и т.д. Для оперативности вы можете сделать это через форму отзыва, размещенную на каждой странице.
Ссылки будут заменены на рабочие или удалены.
Тема от 05.09.08 актуальна!
Остался неоцифрованным 3-й том МКБ. Желающие оказать помощь могут заявить об этом на
нашем форуме
05.09.08
В настоящее время на сайте готовится полная
HTML-версия МКБ-10 – Международной классификации болезней, 10-я редакция.
Желающие принять участие могут заявить об этом на нашем форуме
25.04.08
Уведомления об изменениях на сайте можно получить через
раздел форума “Компас здоровья” – Библиотека сайта “Островок здоровья”
Источник
